基于RNA-Seq技术初步探索顺铂在口腔鳞状细胞癌的相关耐药机制
2024-01-26张万林李一村杨宏宇
张万林,李一村,杨宏宇,
(1.遵义医科大学 口腔医学院,贵州 遵义 563099;2.北京大学深圳医院 口腔医学中心,口腔颌面外科,广东 深圳 518036)
口腔鳞状细胞癌(简称口腔鳞癌)是最常见的恶性肿瘤之一,占口腔部位恶性肿瘤病例的90%以上[1]。口腔鳞癌是一种对人类健康构成严重威胁的疾病。据2020年全球185个国家的统计数据,每年口腔癌的发病数量超过37万例,死亡人数超过17万例,严重威胁了人类的健康[2]。多数口腔鳞癌患者在初诊时已经进展到中晚期,手术切除配合放射治疗和化学治疗是主要的治疗方式[3]。目前,以顺铂为基础的化疗方案是临床上的首选治疗策略,在多数患者中可见到较为显著的治疗效果[4]。然而,部分患者表现出对顺铂化疗的耐药性,这成为了严重影响患者5年生存率的关键因素[5]。因此,研究和克服顺铂相关的化疗耐药性,已成为口腔鳞癌治疗领域中迫切需要解决的问题。顺铂耐药机制涉及复杂的生物学过程,如DNA损伤及修复、上皮间充质转化、药物代谢以及细胞凋亡途径的改变等[6]。目前口腔鳞癌细胞对顺铂耐药的具体分子机制尚未完全阐明。
RNA-Seq技术,作为近年来高通量测序技术的主要代表,能够在较短时间内全面检测和量化组织或细胞中数以万计的基因表达水平,进而深入解析药物作用引起的组织或细胞表型及其功能变化[7]。本研究利用转录组测序技术结合生物信息学分析,挖掘与顺铂抗药性密切相关的候选基因及其潜在信号传导途径,旨在为口腔鳞状细胞癌的抗药性机理研究提供新的视角和策略。
1 资料与方法
1.1 构建耐药细胞模型 如图1所示,从野生型(Wild type)口腔鳞癌细胞系HN6-WT(获赠于北京大学口腔医学院)出发,实验组以低浓度(1 μmol/L)顺铂进行处理。与此同时,对照组加入等量的顺铂溶剂(无菌水)。每日监测两组细胞状态,分别每3 d更换1次培养基。在适当的时间点进行细胞传代,以进入下一阶段培养。随后,将实验组的顺铂浓度升至1.5 μmol/L进行处理,每天观察细胞状态,于适当时间去除顺铂后,每3 d更换1次培养基。这一过程持续14 d。随后,依此类推,逐步提高顺铂浓度,直至达到4 μmol/L。在此期间,对照组同步处理及传代后标记为HN6-WT_Control。在扩大培养后,将两组细胞冻存于-80 ℃以进行保种。
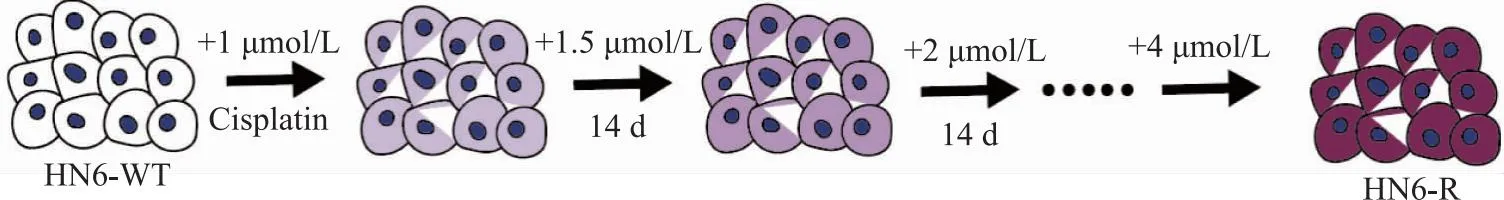
图1 口腔鳞癌耐药细胞系模型的构建过程示意
1.2 耐药细胞模型的鉴定 使用96孔板每孔接种5 000个对照组HN6-WT_Control细胞。与此同时,使用96孔板每孔接种5 000个在方法1.1中诱导的实验组HN6-R细胞。二者在孵育12 h使细胞贴壁后,用梯度药物浓度的顺铂处理细胞。放培养箱(37℃,5%CO2)孵育24 h和48 h后,加入10% Cell Counting Kit-8(CCK8)溶液,再孵育2 h。使用酶标仪微孔板读取器在450 nm处测量光密度值(OD值),使用软件GraphPad Prism 8.0.2分别计算IC50。为评估在顺铂诱导前后细胞耐药性的动态变化,本研究采纳了t检验以进行精确的统计分析。对于2个细胞群体,即HN6-WT_Control(非顺铂耐药型)和HN6-R(顺铂耐药型),计算了其平均细胞存活率,并运用t检验对这两群体之间的潜在差异进行比较。在设定显著性水平为0.05的前提下,将基于t检验结果,以P<0.05的阈值为依据,判定HN6-R在顺铂敏感性上是否发生了显著变化。
1.3 转录组测序(RNA-Seq) 分别选取液氮罐冻存的顺铂耐药细胞3例,非顺铂耐药细胞3例,放入干冰箱内寄于杭州联川生物技术股份有限公司进行RNA提取及转录组测序分析。
1.4 差异表达基因的筛选 利用DESeq软件对各个样本基因的counts数目进行标准化处理后,计算基因表达的差异(log2FC),并对差异进行显著性检验,选取|log2FC|>1,adjustedPvalue<0.05的基因作为表达具有显著差异的基因。利用软件GraphPad Prism 8.0.2作图,其中log2FC>1的为表达上调基因,log2FC<-1的为表达下调基因。
1.5 使用GSEA软件对差异基因作用的信号通路富集分析 通过Gene Set Enrichment Analysis(GSEA)软件(4.2.3版)富集RNA-Seq检测获得的基因表达数据,参考基因集使用分子特征数据库(MSigDB)中的50个标志性基因集(h.all.v2023.2.Hs.symbols.gmt)作为对照基因集,置换检验的置换次数被设定为1 000次,P<0.05被认为具有统计学意义。
1.6 关键差异基因表达的验证 收集HN6-WT_Control和HN6-R两组细胞后置于冰上,加入TRIzol裂解液冰上静止裂解细胞,提取细胞总RNA,反转录试剂盒反转录为cDNA,以cDNA为模板进行qRT-PCR,反应体系为20 μL:ChamQ SYBR qPCR Master Mix(Without ROX) 10 μl,cDNA 1 μL,上下游引物各0.4 μL,DEPC水8.2 μL;反应程序为95 ℃ 30 s;95 ℃ 10 s;60 ℃ 30 s,循环40次;引物序列见表1。

表1 各目的基因的引物序列
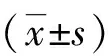
2 结果
2.1 耐药模型的构建 通过使用药物浓度递增法逐步诱导使口腔鳞癌细胞系HN6-WT对顺铂耐药性增加,从而建立起顺铂耐药细胞系模型。如图2所示,利用CCK8实验分别检测非耐药细胞(HN6-WT_Control)与顺铂耐药细胞(HN6-R),不同浓度(0~10 μmol/L)顺铂处理24 h与48 h的细胞活性,并依次计算IC50值。结果显示顺铂处理24 h时HN6-WT_Control的IC50为8.951 μmol/L,而HN6-R的IC50为19.17 μmol/L。顺铂处理两组细胞48 h时,HN6-WT_Control的IC50为0.143 μmol/L,HN6-R的IC50为2.133 μmol/L。在2个顺铂处理时间点,HN6-R的IC50都显著高于HN6-WT_Control。并且,如图3A所示HN6-WT_Control与HN6-R在不同浓度的顺铂处理24 h时呈现的细胞存活率结果,其中在2、4、6、8 μmol/L的顺铂处理24 h时两组细胞存活率存在明显差异(P<0.05),加入顺铂48 h后两组细胞在实验设置的所有浓度(0.4、2、3、6、10 μmol/L)药物作用上均有统计学差异(图3B)。可以得出HN6-R相比HN6-WT_Control对顺铂更加不敏感。以上结果说明HN6-R的顺铂耐药性显著高于HN6-WT_Control,口腔鳞癌顺铂耐药细胞株已经成功建立(图4)。
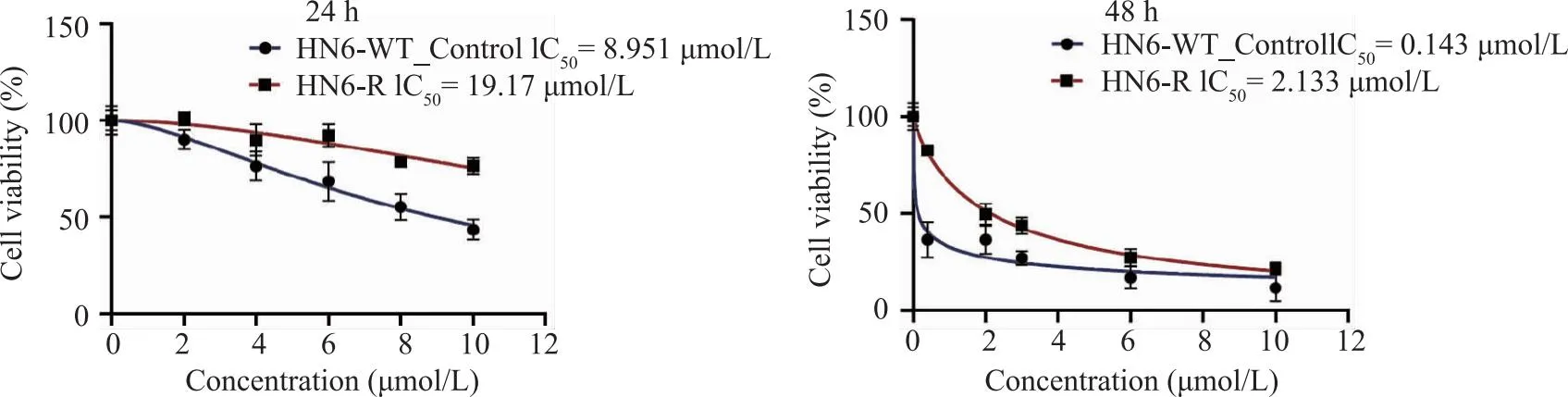
图2 顺铂耐药细胞与非顺铂耐药细胞24 h与48 h测定的IC50

图3 顺铂耐药细胞与非顺铂耐药细胞24 h与48 h细胞存活率差异对比

图4 光镜下非顺铂耐药细胞与顺铂耐药细胞形态学对比
2.2 通过RNA-Seq测序分析耐药细胞与非耐药细胞间差异基因 为了深入探究顺铂耐药的口腔鳞状细胞癌细胞系与非耐药细胞系之间的基因表达差异,本研究分别对耐药株和非耐药株进行了RNA测序(RNA-Seq)分析,每个条件下设立了3个生物学重复实验,以确保结果的可靠性和重现性。通过高通量的RNA-Seq数据,运用生物信息学工具和算法进行了综合分析,设定对数比值(log2FC)的绝对值大于1且矫正P值(adjustedPvalue)小于0.05作为显著性差异表达基因的筛选标准。经过筛选,识别出216个差异表达基因。在这些基因中,有55个基因的表达在耐药株中显著下调,而161个基因的表达则上调(图5)。
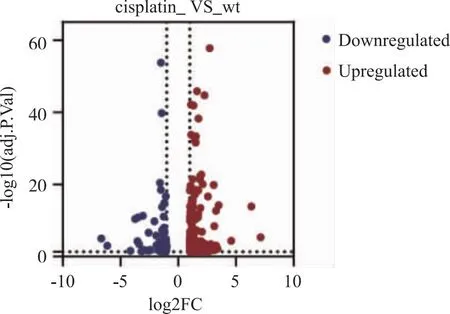
图5 差异表达基因火山图
2.3 GSEA富集分析 为了确定在顺铂耐药细胞与非顺铂耐药细胞之间激活信号通路的差异,本研究采用基因集富集分析(GSEA)软件进行了系统的分析。通过计算各信号通路的富集分数(Enrichment Score, ES)并进行标准化,对激活的信号通路进行了排序。在非耐药细胞群中,识别出20条显著激活的信号通路(P<0.05)。其中排名前五分别为PI3K-AKT-mTOR信号通路、刺猬信号通路、氧化磷酸化通路、活性氧通路和MYC目标基因集合V1(图6A)。而在顺铂耐药细胞中发现同样有20条信号通路被激活,其中最为显著的五条信号通路为:IL6/JAK2/STAT3信号通路、TNF-α和NF-κB信号通路、低氧通路、干扰素-γ应答和干扰素-α应答信号通路等(图6B)。本研究特别关注那些在顺铂耐药细胞中显著激活的信号通路,这些通路在多种生物学过程中扮演着关键角色,包括调控炎症反应、免疫应答、细胞生长与死亡、巨噬细胞与自然杀伤细胞的活化(如干扰素-γ和α)以及细胞对低氧环境的适应性反应。这些结果指示了耐药与非耐药细胞在信号传导网络上存在根本性的差异,为后续针对耐药机制的研究提供了重要的生物学信息。
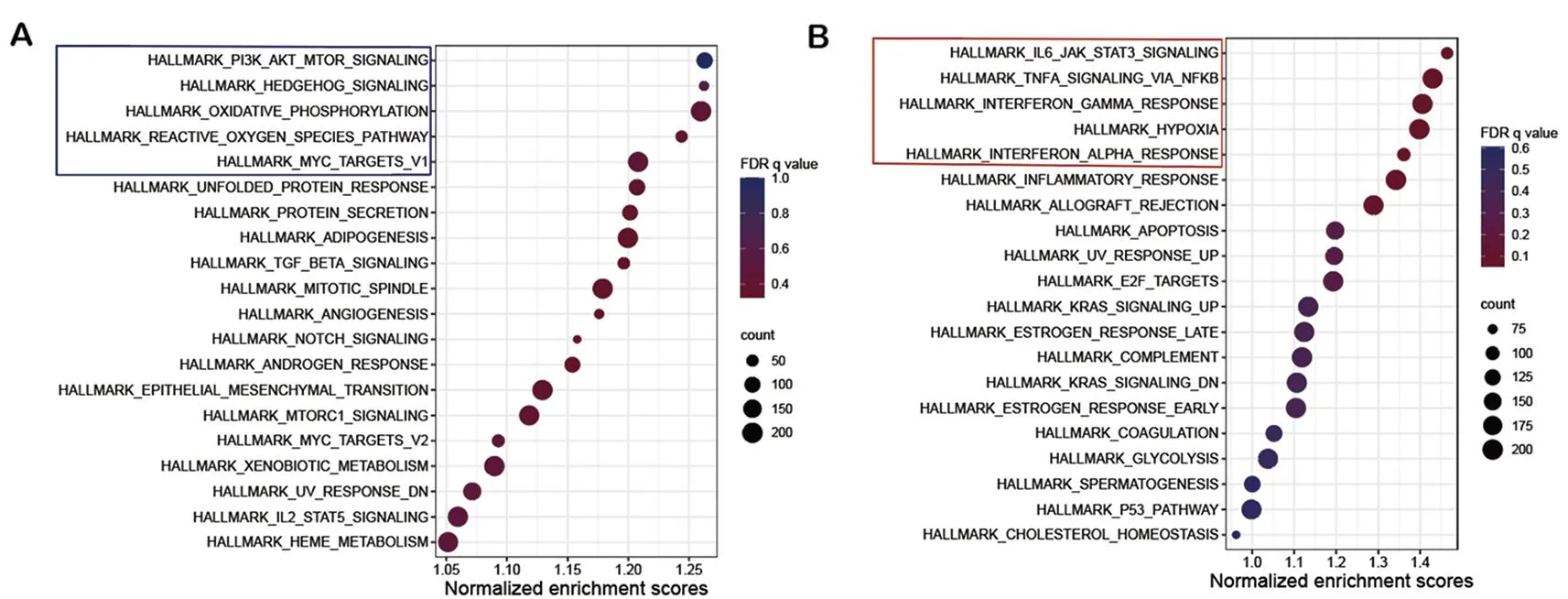
A:非顺铂耐药细胞HALLMARK富集Top20信号通路;B:顺铂耐药细胞HALLMARK富集Top20信号通路。图6 非顺铂耐药细胞和顺铂耐药细胞HALLMARK富集通路
2.4 信号通路中差异基因的表达 在顺铂耐药细胞中,发现了5个主要的信号通路,它们分别是IL6/JAK2/STAT3信号通路、TNF-α和NF-κB信号通路、低氧通路、干扰素-γ应答和干扰素-α的应答信号通路。在这5个信号通路中,进一步筛选出了前20个差异基因进行展示。图7展示了这些差异基因在各个信号通路中的分布情况。在筛选出的前20个差异基因中,发现CXCL10和CXCL11基因在多个信号通路中均起着关键基因的作用。这些信号通路包括IL6/JAK2/STAT3信号通路、TNF-α和NF-κB信号通路、干扰素-γ应答和干扰素-α的应答信号通路。此外,CXCL10和CXCL11基因在其中4个信号通路中的富集程度均排名前5(图8)。这些结果表明,CXCL10和CXCL11基因可能在口腔鳞癌细胞顺铂耐药机制中扮演着重要的角色。另外,还发现了一些其他基因在特定的信号通路中扮演了关键的耐药作用。例如,CXCL9、CXCL1和CSF2基因在IL6/JAK2/STAT3信号通路中起重要作用(图8A);NR4A3、EGR3和CXCL1在TNF-α和NF-κB信号通路中起关键作用(图8B);CXCL9、CFB和DDX60在干扰素-γ应答与肿瘤细胞耐药中起调控作用(图8C);与低氧相关的基因IGFBP3、MT1E、LOX、INHA和ATF3也参与了顺铂耐药的机制(图8D);基因DDX60、IFIT2和OASL调控了干扰素-α的应答信号通路与顺铂耐药的相关性(图8E)。
2.5 关键差异基因的mRNA表达体外验证 为了验证RNA-Seq结果,本研究对上述信号通路中筛选的关键差异表达基因进行了体外验证。采用了qRT-PCR方法在HN6-WT_Control和HN6-R两组细胞中分别验证了CXCL10、CXCL11、NR4A3和IGFBP3关键基因的表达情况。结果显示,在HN6-R细胞系中,CXCL10、CXCL11、NR4A3和IGFBP3基因的表达较高,且两组之间的表达情况具有统计学差异(P<0.05),与测序数据的趋势一致(图9)。
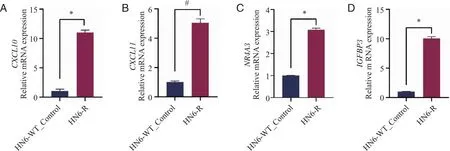
A :HN6-WT_Control和HN6-R中CXCL10的mRNA表达量比较;B:HN6-WT_Control和HN6-R中CXCL11的mRNA表达量比较;C:HN6-WT_Control和HN6-R中NR4A3的mRNA表达量比较;D:HN6-WT_Control和HN6-R中IGFBP3的mRNA表达量比较;*:P<0.0001;#:P<0.0001。图9 关键差异基因的mRNA表达
3 讨论
本课题组成功建立了口腔鳞状细胞癌细胞系HN6的耐药株,并应用转录组学高通量测序技术对其基因表达谱进行了详细分析,以辨识和比较与药物耐药性相关的基因表达模式。经测序分析,与非耐药株相比,耐药株中广泛的基因表达发生了变化。推断这些差异表达的基因可能与顺铂耐药有关,并且基因表达的变化揭示了耐药株的耐药机制。对表达差异的基因进行富集分析,发现与顺铂耐药相关的信号通路,包括IL6/JAK2/STAT3信号通路、TNF-α和NF-κB信号通路、低氧通路、干扰素-γ应答和干扰素-α的应答信号通路。这些信号通路涉及的关键差异基因有CXCL10、CXCL9、CXCL11、CXCL1、CSF2、NR4A3、EGR3、CFB、IGFBP3、MT1E、LOX、INHA、ATF3、DDX60、IFIT2、OASL等。其中,CXCL10、CXCL11在其中4条通路都起关键作用,CXCL10、NR4A3和IGFBP3是5条通路中排名指标分数位居第一。因此,将CXCL10、CXCL11、NR4A3和IGFBP3基因作为本研究的关键耐药基因进行探讨。
CXCL10和CXCL11属于C-X-C趋化因子家族,是一类趋化蛋白(chemokines),主要由免疫细胞如单核细胞、巨噬细胞、淋巴细胞以及非免疫细胞如内皮细胞产生。它们通过结合CXCR3受体,该受体广泛表达在免疫细胞上,包括T淋巴细胞、B淋巴细胞、自然杀伤细胞等,引导免疫细胞向炎症和感染区域迁移,参与免疫应答、抗病毒免疫等生理过程。在与CXCR3结合后,CXCL10和CXCL11可能诱导免疫细胞迁移到炎症部位,发挥免疫调节和炎症反应的效应[8]。在肿瘤微环境中,CXCL10和CXCL11基因主要调节免疫细胞活动,同时在肿瘤微环境中引发炎症反应[9-10]。在肿瘤微环境中的作用方面,它们的表达水平可能随免疫细胞浸润而变化,这与肿瘤细胞对顺铂的耐药性可能存在关联[11]。这是因为免疫细胞的存在可能改变肿瘤微环境,从而影响顺铂化疗的效果。这一调控过程可能与肿瘤对顺铂等治疗的反应有关,但具体的机制仍需要深入研究。此前,已有研究证明CXCL9、CXCL10、CXCL11/CXCR3 轴调节免疫细胞迁移、分化和激活,从而抑制肿瘤(旁分泌轴)。并讨论了它们在癌症治疗中的潜在作用。该轴通过自分泌轴诱导肿瘤生长和转移[9]。临床前研究将轴定义为癌症治疗的一个有希望的目标。头颈鳞状细胞癌已被证明表达多种趋化因子及其受体,这可能会促进化疗耐药性[12]。在 mRNA 水平上,大多数头颈鳞状细胞癌细胞系表达CCL5、CCL20、CXCL1、CXCL2、CXCL3、CXCL10和CXCL11[13]。这与本文分析的结果相符合。另有研究表明TR3 调节卵巢癌的铂耐药性[14],其中TR3(也称Nur77)是一种核孤儿受体,是NR4A1编码的立早基因产物,属于类固醇/甲状腺受体视黄酸受体超家族成员[15]。TR3广泛参与各种生命活动过程,如细胞生长、分化、凋亡和自噬等调控被认为是良好的抗肿瘤药物设计靶标[16]。NR4A家族包含3个成员: TR3(NR4A1)、Nurr1(NR4A2)和Nor-1(NR4A3)[17],据此猜测NR4A3在肿瘤顺铂耐药方面也扮演一个重要角色。NR4A3,即核受体亚家族4A成员3,是核受体超家族的一员,其编码的核受体蛋白参与多个细胞生物学过程,包括细胞凋亡、分化和代谢的调控。NR4A3的表达广泛分布于多种组织和细胞类型,其受体活性受到内外部刺激的调节。在细胞内,NR4A3通过与核激活子结合,参与调控基因的转录,影响细胞的生理状态[18]。NR4A3不仅涉及到细胞生存和凋亡的调节,其可能作为介导者参与细胞对顺铂引起的DNA损伤作出的应答,由此影响细胞对化疗药物的敏感性。有文献报道表明,NR4A3可能通过调控基因的转录活性,对DNA修复途径相关的生物学过程施加调控影响[19]。IGFBP3是胰岛素样生长因子结合蛋白家族的一种,与细胞生长和凋亡调控有关[20]。主要功能是结合和调节胰岛素样生长因子(IGF)的生物活性。IGFBP3的表达受到多种生长因子和激素的调控,其受体活性直接影响细胞的生长、凋亡和代谢。在细胞膜表面,IGFBP3通过与其受体结合,调节细胞对IGF的响应,从而影响细胞生物学功能。有研究表明IGFBP3可能调控细胞周期,影响细胞对顺铂的敏感性[21-22]。另有研究报道IGFBP3的过度表达与OSCC患者的肿瘤大小增加和淋巴结转移相关,表明IGFBP3可能增强口腔鳞癌的恶性程度[23-24]。这提示IGFBP3可能在口腔鳞癌顺铂化疗耐药机制中也可能存在一定作用。
在顺铂耐药信号通路中,已有研究表明β-榄香烯通过体内外抑制JAK2/STAT3 通路减轻口腔鳞状细胞癌细胞的顺铂耐药[25],这与本文的研究结果相一致。TNF-α 通过 NF-Kappa B通路促进口腔鳞状细胞癌的侵袭和转移[26],间接说明该通路可能参与顺铂耐药的分子生物学过程。肿瘤微环境由肿瘤细胞本身、多种基质细胞和细胞外基质组成,通常以缺氧和免疫抑制为特征[27-29],缺氧与肿瘤细胞顺铂耐药的关系还有待研究。干扰素-γ应答和干扰素-α的应答信号通路不仅可以抑制肿瘤发展,还具有促进肿瘤的分子机制[30],但是其具体机制尚不清楚,未来可以通过设计干扰该通路来实现耐药机制的改变。
综上所述,以CXCL10、CXCL11、NR4A3和IGFBP3基因为新靶点降低口腔癌耐药具有广泛的研究前景。这些发现提供了更深入的口腔鳞癌细胞的顺铂耐药机制,并可能为未来的治疗提供新的靶点。然而,仍需要进行更多的研究来验证这些发现,并确定这些基因在顺铂耐药机制中的具体作用。以便更好地理解耐药发生的生物过程,并寻找潜在的逆转耐药的治疗靶点。
