小反刍兽疫病毒RT-RAA-CRISPR/Cas12a可视化快速检测方法的建立
2023-12-08黄超华阮周曦曹琛福林彦星花群义
黄超华,阮周曦,路 平,吴 江,曹琛福,林彦星,花群义*
(1.深圳海关 动植物检验检疫技术中心,广东 深圳 518045;2.中国动物卫生与流行病学中心,山东 青岛 370200)
小反刍兽疫(peste des petits ruminants,PPR)是一种由小反刍兽疫病毒(peste des petits ruminants virus,PPRV)引起的动物疫病,其易感动物主要为山羊、绵羊、鹿、骆驼以及其他野生小反刍动物。PPR典型临床症状为发热、腹泻、呼吸困难、口腔与鼻黏膜溃疡和结膜炎等,病死率可达90%以上[1-2];PPR是世界动物卫生组织(WOAH)规定的必须报告的动物疫病,在我国属于一类动物疫病。该病自2007年在西藏阿里地区首次发生以来,已在我国多个地区多次发生,尤其在2013—2014年发生的PPR大流行期间,给我国的养羊业造成了巨大的经济损失[3]。我国农业农村部于2015年底制定了全国PPR根除计划,直到2021年我国基本完成了全国消灭PPR的任务。但由于PPR在我国周边国家仍呈地方性流行状态,且近年的野外调查发现PPR有在国内形成自然疫源地的风险[4-6],因此加强入境小反刍动物及其产品的PPRV筛查以及对国内野生小反刍动物开展PPR疫情调查成为我国PPR防控工作的重点。我国国家标准《小反刍兽疫诊断技术》中推荐的PPRV分子生物学检测方法为针对PPRVN基因的普通RT-PCR、实时荧光RT-PCR,但耗时较长,且需要大型仪器设备,不适合用于PPRV的快速筛查和野外调查。因此建立一种快速灵敏的便携式的PPRV可视化检测方法十分必要。
RT-RAA-CRISPR/Cas12a可视化快速检测方法是一种将CRISPR/Cas12a的反式切割活性与RT-RAA扩增技术相结合并通过侧向流试纸实现结果的可视化核酸检测方法。2018年DOUDNA等[7]首次将CRISPR/Cas12a与 RPA 方法结合在一起建立了DETECTR检测平台,可在常温下快速特异性地检测 HPV16 和 HPV18 核酸。其原理即通过特异性的 crRNA(CRISPR RNA) 引导CRISPR/Cas12a特异性识别RPA扩增的目的DNA序列,进而激活CRISPR/Cas12a反式切割活性、对反应体系中的ssDNA报告探针进行切割,从而实现荧光信号的释放,最终通过侧流层析试纸实现反应结果的可视化。该方法因具有快速、准确、操作简单、且不需要特殊仪器设备等优点而在近年得到快速发展和应用。该技术已在新冠病毒、非洲猪瘟病毒、猪繁殖与呼吸综合征病毒等病毒核酸及其他病原微生物的检测等方面得到应用[8-11]。目前,尚无基于RT-RAA-CRISPR/Cas12a技术的PPRV检测方法。因此,本研究结合RT-RAA扩增技术与CRISPR/Cas12a反式切割和侧向流试纸建立了一种小反刍兽疫病毒核酸的快速可视化检测方法。
1 材料与方法
1.1 主要材料小反刍兽疫灭活疫苗、蓝舌病毒(BTV)、鹿流行性出血热病毒(EHDV)、口蹄疫病毒(FMDV)、羊痘病毒(CaPV)、猪水泡病毒(SVDV)、伪狂犬病病毒(PRV)等病毒核酸为深圳海关动植物检验检疫技术中心提供;CRISPR/Cas12a蛋白(M0653T)、HiScribe T7 Quick High Yield RNA Synthesis Kit(E2050S)、NEBuffer r2.1(B6002V)、10×NEB buffer 3(B7003S)为New England Biolabs 公司产品;RNA纯化试剂盒miRNeasy Mini Kit (50)(217004)为德国QIAGEN公司产品;RT-RAA扩增试剂盒(基础型)(S003ZC)为杭州众测生物科技有限公司产品;侧向流试纸条(JY0301)为北京宝盈同汇生物技术有限公司产品;RT-qPCR母液(4442135)为美国赛默飞公司产品;相关引物探针及质粒均由生工生物工程(上海)股份有限公司合成。
1.2 方法
1.2.1RT-RAA引物的设计合成及筛选 利用NCBI BLAST功能对PPRVN基因进行比对,分析其保守区域,并以Primer Premier 5软件设计获得了12组特异性引物对,利用RT-RAA扩增进行筛选。RT-RAA体系为:A buffer 41.5 μL、特异性上、下游引物各2.0 μL、PPRV核酸2.0 μL和B buffer 2.5 μL,反应条件为42℃ 30 min;反应后通过全自动毛细管电泳分析系统进行分析,筛选出可用于后续试验的引物组合。
1.2.2crRNA的设计合成 CRISPR/Cas12a识别的PAM为TTTN,分析PPRVN基因序列,选取PAM 序列后的20~23 bp,并在其前加上T7 启动子(TAA TAC GAC TCA CTA TAG G)+LbCas12a的 scaffold 序列(aatttctactaagtgtagat),从而获得多条PPRV特异性crRNA序列;由生工生物工程(上海)股份有限公司合成 crRNA-F以及反向互补链 crRNA-R,并通过退火合成相应的 DNA 双链;以T7体外转录试剂盒(HiScribe T7 Quick High Yield RNA Synthesis Kit)将DNA双链转录成RNA,并利用RNA纯化试剂盒(miRNeasy Mini Kit (50))进行纯化,最终获得crRNA,-80℃保存待用。
1.2.3CRISPR/Cas12a反应体系 CRISPR/Cas12a反应体系:200 nmol/L Cas12a、250 nmol/L crRNA、200 nmol/L 报告探针(5′ 6-FAM-TTATT-Biotin 3′)、10 μL NEBuffer r2.1、5 μL RT-RAA产物、2 U RNase 抑制剂、DEPC处理的H2O补足至100 μL。反应条件为37℃ 20 min。随后将侧向流试纸条插入到体系,观察检测线(test-line)和质控线(control-line)显示情况。结果判读:清晰显示检测线的即为阳性结果;仅显示质控线的为阴性结果。
1.2.4crRNA的筛选 以1.2.1筛选获得的特异性引物组合和反应体系与条件进行RT-RAA扩增,取其产物进行CRISPR/Cas12a反应,从而对1.2.2获得的crRNA进行筛选。20 min后,取CRISPR/Ca-s12a反应产物测定荧光强度,筛选出最佳的RT-RAA扩增引物和最佳的crRNA。
1.2.5特异性试验 为确定方法的特异性,以建立的RT-RAA-CRISPR/Cas12a可视化检测方法对BTV、EHDV、FMDV、CaPV、SVDV、PRV等病毒核酸进行检测。
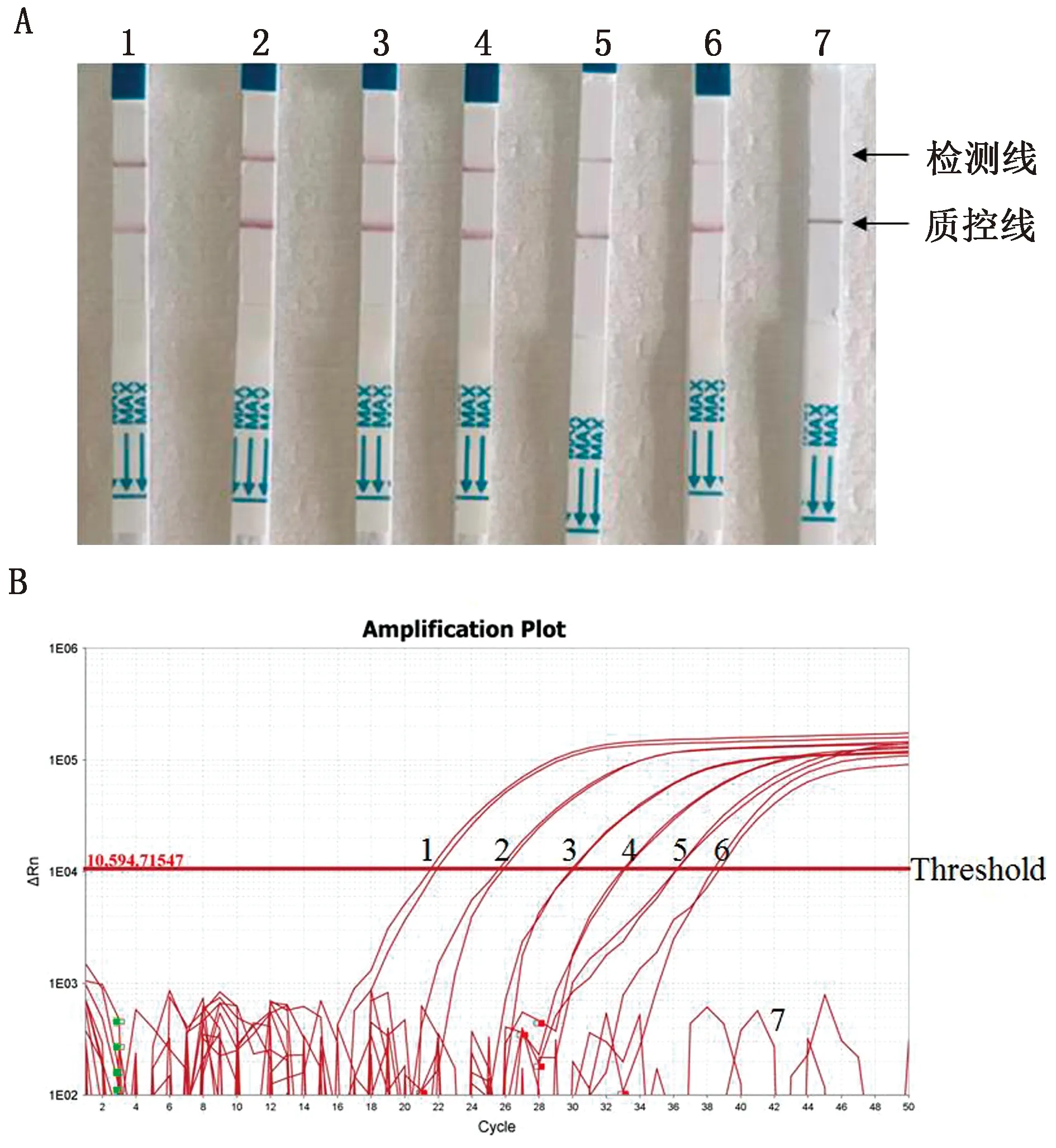
1.2.6敏感性试验 为确定方法的敏感性,将PPRV核酸稀释至4.30×106~4.30×100拷贝/μL,同时以建立的RT-RAA-CRISPR/Cas12a可视化检测方法和国家标准《小反刍兽疫诊断技术》中推荐的实时荧光RT-PCR方法进行检测。
1.2.7重复性试验 为确定方法的重复性,以建立的RT-RAA-CRISPR/Cas12a可视化检测方法对4.30×101,4.30×103,4.30×105拷贝/μL 3个浓度的PPRV核酸进行3次重复检测。
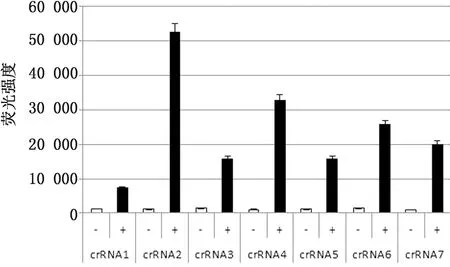
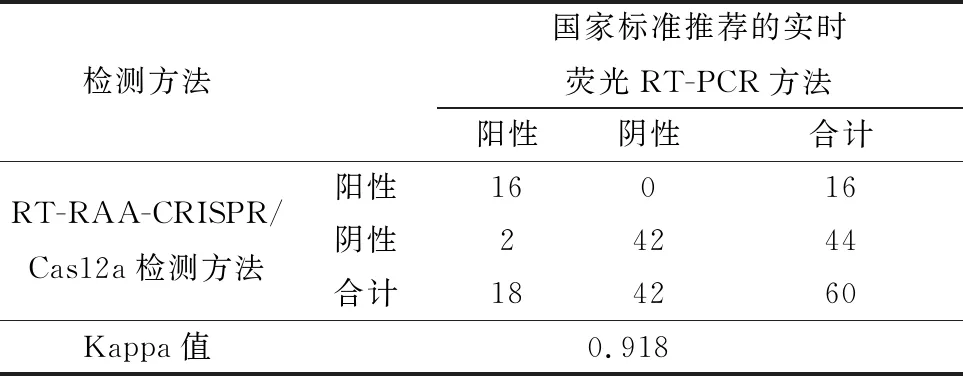
1.2.8符合性试验 为评估本研究建立的方法与国家标准推荐的实时荧光RT-PCR方法的符合性,本研究制备了60份模拟样品,分别以这2种方法进行检测,比较两者的检测结果,并计算两者的符合率以及Kappa值。若0 2.1 RT-RAA引物的筛选结果以RT-RAA扩增试验对设计、合成的12组引物进行筛选。结果表明,3对引物组合没有扩增条带,9对引物组合出现扩增条带;其中,2,3,6,10和11组的扩增条带最为清晰且无非特异性扩增,结果见图1。因此,选取2,3,6,10和11组为RT-RAA特异性引物,进行下一步的试验。 图1 不同引物组合RT-RAA扩增结果 2.2 crRNA 的筛选结果以2.1筛选获得的特异性引物组合和反应体系与条件进行RT-RAA扩增,取其产物进行CRISPR/Cas12a反应,从而对制备的crRNA进行筛选。结果表明,crRNA2所产生的荧光最强,结果见图2。由于crRNA2的序列在RT-RAA特异性引物组合3所在的序列之中,为此,最终确定RT-RAA特异性引物组合为组合3,最佳crRNA为crRNA2,具体序列: 图2 不同 crRNA的荧光强度 PPRV-F:5′-TGG TGC TGA TTT AGA CAA CGA GGC AGA CAT-3′; PPRV-R:5′-TGT GCT AGT ATG GAG GCT AAC AAC ATA TTG AAC T-3′; PPRV-crRNA:5′-AAU UUC UAC UAA GUG UAG AUG AGA ACA GAG AAA UAA UAG AC-3′(下划线为PPRV特异性RNA序列)。 2.3 特异性试验结果以对BTV、EHDV、FMDV、 CaPV、SVDV、PRV等病毒核酸为模板进行特异性试验,评价本方法的特异性。试验结果(图3)显示,PPRV阳性对照有明显的检测线显示,其他病毒核酸及对照均未出现检测线,说明本方法特异性强,能准确检测出PPRV核酸,而与其他病原核酸无交叉反应。 1.PPRV;2.BTV;3.EHDV;4.FMDV;5.CaPV;6.SVDV;7.PRV;8.H2O 2.4 敏感性试验结果为确定本方法的敏感性,将PPRV核酸稀释至4.30×106~4.30×100拷贝/μL,同时以本方法和国家标准《小反刍兽疫诊断技术》推荐的实时荧光RT-PCR方法进行检测。结果显示,本方法的最低检出限可达到4.30×101拷贝/μL,与实时荧光RT-PCR方法相当(图4)。 A.RT-RAA-CRISPR/12a方法的敏感性试验;B.国家标准推荐的RT-qPCR的敏感性试验;1~7.4.30×106 ~4.30×100拷贝/μL 2.5 重复性试验结果以建立的检测方法对4.30×101,4.30×103,4.30×105拷贝/μL 3个浓度的PPRV核酸进行3次重复性试验。结果显示,本方法均能检出前述3个浓度的PPRV核酸,且结果一致性良好(图5),表明本方法的重复性良好。 1~3.4.30×105拷贝/μL;4~6.4.30×103拷贝/μL;7~9.4.30×101拷贝/μL 2.6 符合性结果为确定本方法与国家标准《小反刍兽疫诊断技术》推荐的实时荧光RT-PCR方法的符合性,本研究制备了60份模拟样品,分别以前述2种方法进行平行检测。结果显示,阳性符合率为88%(16/18),Kappa值为0.918>0.750。说明本研究建立的PPRV RT-RAA-CRISPR/Cas12a检测方法与国家标准《小反刍兽疫诊断技术》推荐的实时荧光RT-PCR方法具有高度一致性(表1)。 表1 符合性试验结果 份 由于PPR可造成巨大损失,我国农业农村部于2015年底制定了全国PPR消灭计划,并于2021年基本实现了PPR根除任务。但是我国研究者多次在野生小反刍动物中检出PPRV,周边邻国也有野生动物感染PPRV的报道。因此在野生动物中筛查PPRV,防止PPRV自然疫源地的形成,是目前我国PPR防控的重点之一。另一个重点在于加强入境动物检疫,在关口一线实现PPRV精准快速筛查,防止PPRV境外输入。虽然实时荧光RT-PCR是PPRV核酸检测的金标准,但由于需要大型的仪器和固定场所,所以不适用于PPRV野外筛查和边境关口一线的快速筛查。 为实现PPRV的快速检测,本研究借鉴DOUDNA等[7]的DETECTR 检测平台,把RT-RAA扩增技术与CRISPR/Cas12a反式切割反应结合起来,并通过侧向流试纸实现结果的可视化,建立了一种PPRV核酸的快速可视化检测方法。PPRV特异性的RT-RAA扩增引物和PPRV特异性的crRNA,双重特异性增强了检测方法的特异性,规避了RT-RAA的非特异性扩增。特异性试验结果显示,本研究建立的方法对常见反刍动物病毒如BTV、EHDV、FMDV、CaPV、SVDV、PRV均无交叉反应,说明本方法具有良好的特异性。在敏感性方面,本方法最低检出限可达4.30×101拷贝/μL,灵敏性高于单独使用RT-RAA方法,与实时荧光RT-PCR相当。而与实时荧光RT-PCR相比,本方法通过侧向流试纸显示,结果直观可见;且方法在37~42℃即可完成检测,可在缺少大型仪器设备的基层实验室或野外现场检测中使用,操作便捷快速。 综上,本研究建立了一种基于RT-RAA-CRISPR/Cas12a的可视化PPRV核酸检测方法,具有特异性好、敏感性高、且操作简单、无需特殊仪器等优点,可应用于野外或基层农场以及口岸现场的PPRV快速筛查检测工作。2 结果



3 讨论
