应用适配体捕获建立H5N1亚型禽流感病毒拉曼光谱快速检测技术
2023-12-08崔焕忠李乾学
李 想,崔焕忠*,李乾学
(1.吉林农业大学 动物科学技术学院,吉林 长春 130118;2.中国农业科学院 长春兽医研究所,吉林 长春 130112)
自H5N1亚型禽流感病毒暴发以来,全国乃至全球养殖业深受影响,尤其我国作为禽类养殖大国,H5N1亚型禽流感病毒不仅给禽类养殖造成巨大的经济损失,更严重的是同样对人类存在高致病性,它能使禽类的病死率高达100%,人类则达到60%以上。随着候鸟的迁徙和人类的大规模活动[1],全球已有60多个国家发现H5N1亚型禽流感病毒,但现存的对于H5N1亚型禽流感病毒检测的方法大部分都耗时过长,操作复杂,不能达到现场快速诊断的目的[2],所以建立一种能够在现场快速检测的方法至关重要。
近些年来,拉曼光谱逐渐被认知,作为新型病原检测的一种方式,它具有快速、无需培养、自动化、高灵敏度的优势。拉曼光谱检测仪会对与入射光频率不同的散射光谱进行分析,得到分子振动、转动方面的信息,并应用于分子结构研究的一种分析方法。其不但可以处理各种性状的样品,包括液体和固体,还可以满足实时、活体、微量与宏观的检测[3]。
表面增强拉曼散射(surface enhanced Raman scattering,SERS)是一种特殊表面吸附分子将拉曼散射信号增强的现象,SERS是在拉曼光谱检测的基础上增强待检物的拉曼信号的方法,作为一种新兴的分子光谱检测技术,通过金属纳米结构的局域表面等离激元共振(localized surface plasmon resonance,LSPR)所造成的局部电磁场来增强目标信号,能够将目标信号放大百万甚至千万倍,并且可以无视水的影响,检测水样样本[4]。因其能实现对分析物分子的极低浓度检测,被广泛应用于痕量分析领域[5]和病毒检测[6]。SERS光谱具有高敏、高分辨率、增强信号、谱带窄的优势,并且还可以提供分子结构振动的指纹图谱信息,在亚微米尺度上获得细胞成像等众多特点,能够快速准确的鉴别待检物。在样品处理好的情况下最快可30 s检测出结果。
核酸适配体是指通过指数富集的配体系统进化技术体外筛选的能与靶标高亲和性和高特异性结合的核糖核酸(RNA)和单链脱氧核糖核酸(ssDNA)。适配体对目标物有良好的特异性和灵敏性。筛选快、成本低、有良好的稳定性使其超过抗体成为更多人的选择[7]。适配体可应用于临床诊断、传染病监测与抑制、癌症治疗、新药研发、微生物检测、肿瘤影像学等诸多领域[8]。
因H5N1亚型禽流感病毒生物病原体本身拉曼信号较弱,故应用免疫磁球偶联特异性适配体捕获H5N1亚型禽流感病毒,在空间位置效应的作用下,适当的空间距离适合纳米银的增强,但是经拉曼检测后发现该方法在被纳米银还原后的拉曼信号还是较弱,于是在前序试验不变的基础上引入第2个特异性适配体,通过比较被纳米银还原后的拉曼信号发现在引入第2个特异性适配体后拉曼信号显著增强,因此通过比较建立双适配体夹心技术检测H5N1亚型禽流感病毒。
1 材料与方法
1.1 材料
1.1.1毒株及鸡胚 毒株H5N1亚型禽流感病毒,由中国农业科学院长春兽医研究所实验室提供;9日龄鸡胚,购自长春市嘉禧牧业有限公司。
1.1.2主要试剂及仪器 链霉亲和素磁珠(直径1 μm)(海狸生物);PBS缓冲液(北京索莱宝);去离子水(北京索莱宝);AgNO3(Sigma);NaBH4(上海宏瑞化工);磁力架(赛默飞);高温金属浴(南京舜玛);低温离心机(赛默飞);LabRAM HR Evolution显微拉曼仪(HORIBA Scientific);石英载玻片(沭阳晶通石英);生化培养箱(上海一恒);-80℃超低温冰箱(青岛海尔);超净台(苏州净化);智能压力蒸汽灭菌锅(上海嘉措);电子分析天平(梅特勒)。
1.1.3适配体序列 H5N1适配体序列2198(GCAGAGGTCCGCTGACGGATGGATGGAAC-AGGGGTTTAGCAGCAGGACCACTCTTGAGC-G),H5N1适配体序列3498(ACCTGGTTACTGGGTGGCTACAGGGGACACCACTCCGCTTC-CTCCGGCCCGGGGAGTGGC)由自上海生工合成。
1.2 方法
1.2.1病毒培养 取保存于-80℃冰箱内的H5N1流感病毒接种至9日龄的鸡胚中,每个鸡胚接种100 μL,接种后对鸡胚进行封蜡处理,将鸡胚放置于37℃生化培养箱中培养72 h,将24 h内死亡的鸡胚舍弃。培养72 h后将鸡胚放入4℃处理,冷胚12 h,在超净台内收集鸡胚尿囊液,收毒后用2%鸡红细胞悬液测定其血凝效价,病毒分装好置于-80℃保存备用。
1.2.2H5N1亚型禽流感病毒捕获体系的建立 将存于-20℃的适配体3498和2198取出,8 000 r/min离心2 min,加适当的去离子水稀释至100 mmol/L,混匀后放95℃金属浴15 min,然后迅速冰浴15 min,冰浴过后室温放置15 min,此时2个适配体已被折叠好。取0.2 mg链霉亲和素磁珠于内壁光滑的离心管中,用500 μL PBS溶液洗涤,离心管置于磁力架上1 min,重复洗涤3次,加入20 μL折叠好的适配体3498室温孵育30 min。经磁性分离后用500 μL PBS溶液洗涤3次,洗去未结合的游离的适配体3498,制备成捕获磁珠IMBs。
1.2.3IMBs-H5N1@AgNPs的制备 在IMBs中加入200 μL H5N1禽流感病毒,充分混匀后4℃孵育1 h,每间隔20 min重悬1次保证磁珠处于悬浮状态,孵育结束后用PBS溶液洗涤3次,洗去未结合的H5N1禽流感病毒,制备成IMBs-H5N1保存于4℃冰箱备用。
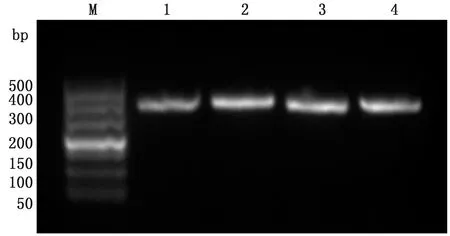
M.Marker 1.H5N1病毒培养原液中提取的RNA反转录所得的cDNA;2~4.3管培养的流感病毒待验证尿囊液RNA
采用Shameli K 方法通过NaBH4做还原剂对AgNO3还原合成AgNPs,通过在室温条件下调节两者的浓度比例与孵育时间合成最佳的AgNPs[9]。据试验数据显示,AgNO3最佳孵育时间为10 min,最佳浓度为10 mmol/L;NaBH4最佳孵育时间为1 min,最佳浓度为10 mmol/L。2种溶液均为现用现配。向制备好的IMBs-H5N1中加入现配制的10 mmol/L 50 μL AgNO3溶液,充分混匀,避光4℃孵育10 min,孵育期间令溶液始终处于悬浮状态,之后匀速加入50 μL现配制的10 mmol/L NaBH4溶液,混匀反应1 min,立即于1 000 r/min离心1 min,弃掉上清,用50 μL无菌去离子水重悬,命名为IMBs-H5N1@AgNPs。取10 μL样品滴至清洗干净的石英载玻片表面上,待样品干燥,进行SERS检测。
1.2.4建立双适配体夹心 在IMBs-H5N1的基础上,加入20 μL特异性适配体2198,充分混匀后4℃孵育,期间保证磁珠处于悬浮状态。经磁性分离将未偶联的适配体洗脱。命名为IMBs-H5N1-Apt。
为了确定适配体2198和IMBs-H5N1的最适孵育时间,在加入20 μL适配体2198后,4℃孵育0.25,0.50,0.75,1.00,1.25,1.50,1.75,2.00 h,期间轻摇离心管保持溶液内混合物悬浮。磁性分离吸弃上清,还原后每个样品重复SERS检测3次。
1.2.5SERS检测方法的建立 检测前使用硅片进行仪器校正,以 520.7 cm-1处的拉曼峰作为基准峰[10]。取 10 μL 待测样品滴至酸液浸泡洗涤并冲洗干净的石英载玻片中央,使用 532 nm的He-Ne激光进行激发,激光功率为 13.5 mW,激光功率密度为 0.214 mW·μm-2,物镜选择50倍,激光衰减参数选择1%,分辨率设置为1 cm-1,曝光时间为30 s,积分次数为2次,进行拉曼信号采集。数据分析采用 Origin software 8.5 软件。
2 结果
2.1 血凝效价血凝效价结果如表1所示,取效价为27以上的病毒液混匀后分装,-80℃保存备用。

表1 H5N1禽流感病毒血凝效价结果
2.2 培养病毒中存在H5N1的验证为了验证培养的病毒尿囊液中存在H5N1流感病毒,提取培养原液中H5N1流感病毒和3管培养的流感病毒待验证尿囊液的RNA,以病毒原液中提取的RNA进行反转录所得的cDNA为模板,用引物Forward-H5N1/Reverse-H5N1在退火温度65℃进行扩增,经3%琼脂糖凝胶电泳鉴定PCR扩增产物,可以看到4个泳道在421 bp都有明亮条带(图1)。
2.3 H5N1流感病毒的SERS检测选用10 μL适配体3498偶联磁球捕获流感病毒进行试验,IMBs-H5N1@AgNPs的检测结果如图2黑线所示,信号较弱,所以在前序试验操作不变的基础上,在溶液里加入适配体2198,还原后检测如图2红线所示,可以看出后者拉曼信号强于前者,峰更高更容易检测。原因可能为后者结构更适合产生LSPR,从而增强H5N1流感病毒的拉曼信号。所以我们选择对后者做进一步优化,通过对比建立双适配体夹心检测H5N1流感病毒[11]。
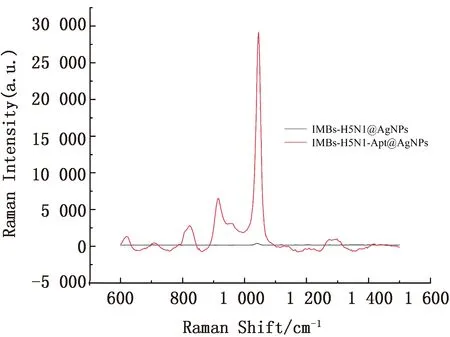
图2 IMBs-H5N1@AgNPs和IMBs-H5N1-Apt@AgNPs SERS图
2.4 适配体2198和IMBs-H5N1最适孵育时间在 IMBs-H5N1的基础上加入20 μL适配体2198后,4℃孵育0.25,0.50,0.75,1.00,1.25,1.50,1.75,2.00 h,SERS检测结果如图3所示。
图3 适配体2198与IMBs-H5N1孵育时间的优化
2.5 特异性评价为了考察该方法的特异性,采用尿囊液、H9N2、H1N1和H3N2亚型禽流感病毒作为对照样品进行了拉曼光谱检测,通过对5种样品的光谱图经过基线校正、归一化和平滑处理得到的谱图结果如图4所示[12]。仅H5N1亚型禽流感病毒有明显的拉曼信号,而其他禽流感病毒和尿囊液均无明显的拉曼信号强度,结果表明该方法能直接检测H5N1流感病毒,具有较好的特异性。
图4 H5N1亚型禽流感病毒SERS检测方法特异性评价
2.6 灵敏性评价为了评价该方法检测H5N1亚型禽流感病毒的检测限,在优化条件下,分析了基于免疫磁球捕获不同浓度H5N1亚型禽流感病毒的拉曼光谱。将病毒按1∶10,1∶100,1∶1 000……稀释成10个梯度体系为200 μL病毒液,分别与0.2 mg免疫磁珠孵育,制备待检样品,对其进行拉曼光谱扫描,结果如图5所示。从图中可以看出,1 058 cm-1处 SERS 峰在10-1~10-10病毒浓度范围内呈线性相关,相关性R2= 0.994 9。 病毒的检测限达到了稀释尿囊液的1010倍。
A.H5N1亚型禽流感病毒SERS检测方法灵敏度评价;B.1 058 cm-1谱带强度与H5N1亚型禽流感病毒浓度线性关系
2.7 不同批次样品重复性检测选择共制备3个批次待检样品,试验参数设置一致,每个样品重复扫描3次,结果见图6,显示峰位一致,强度稳定,显示该方法重复性良好。
图6 不同批次IMBs-H5N1-Apt@AgNPs
2.8 实样分析为了研究该方法在真实样本中的应用潜力,通过对已感染/未感染H5N1病毒的鸡胚尿囊液进行检测,应用该方法和HA方法评价两者的检测结果是否一致。从50个感染和50个未感染的鸡胚中随机选择14个样本,如表2所示,通过HA试验发现其中10个为阳性,4个为阴性,如图7所示,拉曼光谱显示随机样本中10个有峰4个没有峰,SERS检测结果与HA检测结果一致,我们所提出的方法在H5N1实样分析中显示出良好的应用前景。
图7 实际样本中H5N1的SERS检测

表2 H5N1禽流感病毒样本分析HA结果
3 讨论
拉曼光谱检测因其具有快速、无损、原位、指纹特征被广泛应用于生物检测,通过研究表明SERS光谱可以直接检测细菌[13],但是病毒与细菌的不同之处在于病毒依赖宿主细胞生存、复制和繁殖,并且很难获得没有杂质的纯病毒,因此几乎不可能利用SERS指纹来区分不同的病毒。
在SERS的基础上,本研究开发了1种针对H5N1流感病毒来说直观的、无标签的拉曼光谱检测方法,根据适配体-病毒-适配体相互作用的特点,用适配体3498偶联免疫磁珠形成捕获体系,用该体系去捕获H5N1流感病毒,并且发现在加入适配体2198后,信号大大增加。根据LSPR理论,信号大幅增强是由于在待测物与Ag纳米链的强耦合等离子体纳米结构之间产生了高强度的电磁场,两者表面等离激元(SP)可以在金属-电介质界面处激发并传播增强其拉曼信号[14],故推测可能是Ag纳米链到IMBs-H5N1-Apt复合物结构的距离比到IMBs-H5N1复合物结构的距离更近,导致IMBs-H5N1-Apt@AgNPs信号远远高于IMBs-H5N1@AgNPs。
H5N1流感病毒的SERS结果在1 058 cm-1处显示出狭窄的、对称性良好的峰形,重复性较好,同时用H1N1、H3N2或H9N2替代H5N1后,在1 058 cm-1处未见特征峰,并且原病毒液稀释到1010倍时仍能检测到拉曼信号,此方法也在真实临床样本中验证了SERS检测H5N1流感病毒的实际适用性。该方法具有特异性、高增强能力、稳定性和灵敏性,可用于H5N1亚型禽流感病毒的检测。
