HP-PRRSV重组新城疫病毒载体疫苗构建及小鼠免疫评价
2023-12-08何海强陶一墨南福龙解长占金宁一鲁会军
何海强,陶一墨,南福龙,解长占,王 鹏,张 赫,金宁一,鲁会军*
(1.吉林农业大学 动物医学院,吉林 长春130118;2.中国农业科学院 长春兽医研究所,吉林 长春 130122;3.广西大学 动物科学技术学院,广西 南宁 530004;4.青岛大学 基础医学院 特种医学系,山东 青岛 266000)
高致病性猪繁殖与呼吸综合征(highly pathogenic porcine reproductive and respiratory syndrome,HP-PRRS)是世界范围内养猪业重要的疾病之一,由高致病性猪繁殖与呼吸综合征病毒(highly pathogenic porcine reproductive and respiratory syndrome virus,PRRSV)所引起。该病毒隶属于动脉炎病毒科(Arteriviridae),动脉炎病毒属(Arterivirus)。我国主要流行的是PRRSV-2型,主要分为Lineage 1,3,5,8,从2006年HP-PRRS流行之后的HP-PRRSV代表毒株有JXA1、HuN4、TJ等。YN-LQ毒株为云南分离的Lineage 8 HP-PRRSV毒株,与JXA1同源性最近。国内针对HP-PRRSV疫苗主要以减毒活疫苗(MLV)为主,1994年美国就开始对PRRSV减毒活疫苗安全性和有效性的大量研究[1]。尽管中国引进的MLV展现了良好的保护效果,但随着MLV的使用导致中国2型PRRSV的流行[2],已有报道证明MLV有出现毒力返强,另一方面MLV导致PRRSV与野毒株出现基因重组现象,导致出现新的亚型[3]。因此MLV逐渐减少投入使用。而在研究中发现HP-PRRSV主要结构基因ORF5编码的GP5结构蛋白存在由aa37~45和aa27~30组成的线性中和表位,能够刺激机体产生大量中和抗体[4-5],因此GP5蛋白是主要的免疫蛋白之一。

A.PRRSV-GP5 PCR+Flag鉴定结果(M.DL2000 DNA Marker;1,2.LQ-GP5+Flag);B.Pme Ⅰ单酶切结果(M.DL19000 DNA Marker;1.阴性对照;2.RL-GP5);C.NDV检测引物PCR(M.DL2000 DNA Marker;1,2.LQ-GP5+Flag)
新城疫病毒(Newcastle disease virus,NDV)为不分节段单股负链RNA病毒,属副黏病毒科(Paramyxoviridae),禽腮腺炎病毒属(Avulavirus)。随着反向遗传技术的成熟,使得NDV载体能够被定向改造,稳定表达大量的外源蛋白,而且NDV仅对禽易感,作为哺乳动物载体疫苗时安全性好[6]。与常见的灭活疫苗相比,NDV载体疫苗能够有效诱导机体的多种免疫应答,刺激机体产生大量干扰素[7]。NDV载体疫苗已应用于狂犬病毒[8]和小反刍兽疫[9]的预防与保护。本研究将HP-PRRSV的GP5蛋白基因插入NDV载体内获得重组NDV载体疫苗,开展相应的小鼠免疫试验。
1 材料与方法
1.1 实验动物SPF级0日龄鸡胚和6周龄BALB/c雌鼠购自北京维通利华实验动物技术有限公司;自行孵育鸡胚获得1日龄SPF雏鸡、6周龄SPF鸡。
1.2 试剂、毒株和细胞大肠杆菌DH10Bac感受态细胞购自北京百奥莱博科技有限公司;Q5高保真酶和PmeⅠ内切酶购自NEB公司One Step Cloning Kit购自诺唯赞公司;大量质粒提取试剂盒购自德国QIAGEN公司;磷酸钙转染试剂购自Sigma公司;ECL Western blot substrate购自Thermo fisher SCIENTIFIC公司;Flag抗体HRP标记兔抗小鼠IgG购自CST公司;FITC标记山羊抗兔IgG和IP裂解液购自碧云天公司;NDV鸡源多抗由南福龙博士制备;FITC兔抗鸡IgG购自索莱宝公司。HP-PRRSV YN-LQ株由本实验室分离并保存;BSR细胞、痘病毒、rLaSota全长cDNA质粒和P、NP、L 3个辅助质粒来自中国农业科学院哈尔滨兽医研究所步志高团队;Marc-145细胞由实验室保存。
1.3 质粒构建和鉴定通过提取YN-LQ病毒液RNA,反转录cDNA,PCR获得HP-PRRSV-LQ的GP5基因片段,使用PmeⅠ内切酶处理全长质粒,通过同源重组将带有Flag标签的GP5片段重组插入酶切位点,获得表达HP-PRRSV的GP5全长NDV质粒RL-GP5,引物设计如表1所示。在37℃水浴中用PmeⅠ单酶切鉴定质粒,对质粒进行PCR鉴定酶切位点内是否插入正确序列长度。

表1 引物设计
1.4 病毒拯救向BSR细胞内加入具有T7聚合酶的痘病毒进行感作,同时配置转染液,按照说明书所示配比,加入等体积的HBS液,混匀后加入到BSR细胞内,转染3 d后将细胞液注射入9~11日龄鸡胚内,5 d后收取鸡胚上清尿囊液。
1.5 重组病毒鉴定和毒力评价用1%鸡红细胞进行血凝试验鉴定。将尿囊液接种鸡胚获得病毒液至第3代,将F3病毒液接种至BSR细胞感染2 d,收取细胞制取蛋白样品,进行Western blot鉴定Flag标签是否成功表达。将F3代病毒液和rLaSota同剂量接种BSR细胞2 d,用4%多聚甲醛室温固定后,1∶1 000配置Flag单抗,1∶100配置NDV鸡多抗,1∶5 000配置FITC标记山羊抗兔IgG和FITC兔抗鸡IgG,做Flag和NDV间接免疫荧光试验(IFA)。分别进行平均致死时间(MDT)、脑内接种致病指数(ICPI)、静脉接种致病指数(IVPI)检测重组病毒毒力。
1.6 疫苗小鼠免疫效果评价随机将24只小鼠分为PBS、rLaSota、rL-GP5(LQ)3组,每组8只,后肢肌肉注射100 μL,第3周进行加强免疫,共免疫5周,在7,14,21,28,35 d进行眼眶采血,具体分组如表2所示。

表2 小鼠免疫分组
1.6.1小鼠血清特异性抗体水平检测 将原核表达GP5蛋白包被到ELISA板内过夜,用5%脱脂乳进行封闭2 h,加入稀释好的小鼠血清,37℃孵育1 h,加入稀释好的HRP标记的山羊抗鼠IgG抗体,37℃孵育1 h,加入TMB显色液,避光15 min后加入终止液,在酶标仪上进行读数,最后用GraphPad Prism 7.0进行数据分析。
1.6.2小鼠血清中和抗体水平检测 将待检小鼠血清样品于56℃水浴中灭活,灭活后的血清在96孔板内进行2倍倍比稀释至1∶64,每孔接入HP-PRRSV(200 TCID50),混匀后在37℃培养箱内感作1 h再加入3 000个Marc-145细胞,观察5~7 d后记录细胞病变情况。
1.6.3小鼠脾脏淋巴细胞增殖检测分析 每组随机选取3只小鼠进行解剖,取脾脏分离淋巴细胞,于96孔板内每孔加入1×105细胞,每个样本设置空白对照组、Con-A刺激组(10 mg/L)、HP-PRRSV病毒液刺激组(MOI=1),在37℃温箱内培养72 h后每孔内加入15 μL cck-8,避光孵育4 h在酶标仪内记录吸光度,最后用GraphPad Prism 7.0进行数据分析。
1.6.4统计方法 通过GraphPad Prism软件对数据进行整理并利用t检验或Two-way ANOVA进行差异统计学分析。组间比较:*表示P<0.05,**表示P<0.01,***表示P<0.001,****表示P<0.000 1。
2 结果
2.1 质粒构建和鉴定用GP5-F/R引物对PRRSV的cDNA进行PCR,得到的条带大小与预期704 bp一致,经测序验证为GP5片段。重组质粒RL-GP5经单酶切鉴定结果显示,RL-GP5质粒形成2条大小分别为20 000 bp左右和627 bp的条带。NDV检测引物PCR,结果显示RL-GP5质粒成功扩增出1 404 bp,说明质粒构建成功(图1)。
2.2 重组病毒鉴定鸡红细胞血凝试验出现明显血凝现象,rL-GP5(LQ)血凝效价为28。Flag标签的Western blot结果显示,rL-GP5(LQ)对比原始毒株rLaSota出现条带为30 kDa,与预期相符,说明GP5成功表达。IFA显示rL-GP5(LQ)和rLaSota与PBS相比出现明显特异性荧光,说明成功拯救NDV;Flag抗体结果说明rL-GP5(LQ)对比rLaSota和PBS出现特异性荧光,说明GP5成功表达(图2)。

A.Flag标签Western blot结果(M.蛋白Marker;1.rL-GP5(LQ);2.rLaSota);B.间接免疫荧光试验结果(×40)
2.3 重组病毒毒力检测结果显示,rL-GP5(LQ)与rLaSota MDT大于120 h,ICPI和IVPI的值均为0,按照OIE标准判定rL-GP5(LQ)与rLaSota均为弱毒株。
2.4 小鼠血清抗体水平GP5特异性抗体检测结果显示rL-GP5(LQ)组特异性抗体水平随时间的增长而升高,在首次免疫后35 d rL-GP5(LQ)组特异性抗体D值为0.67,是rLaSota组的1.13倍(P<0.01),为PBS组的2.06倍(P<0.01)。中和抗体检测结果显示rL-GP5(LQ)组中和抗体水平随时间的增长而升高,且远高于rLaSota和PBS组,在首次免疫后35 d rL-GP5(LQ)组中和抗体结果为1∶23,是rLaSota组的2.19倍(P<0.01),为PBS组的2.74倍(P<0.01),说明疫苗组能有效刺激机体分泌特异性抗体和中和抗体(图3)。
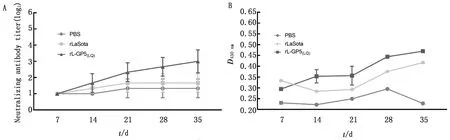
A.中和抗体检测结果;B.特异性抗体检测结果
2.5 小鼠脾淋巴细胞增殖检测通过HP-PRRSV的刺激淋巴细胞活化增殖,与Con-A对照组相比,所引起的淋巴细胞增殖更有效,且rL-GP5(LQ)组分别为PBS和rLaSota组的2.60倍和1.29倍,有显著性差异(P<0.01)(图4)。
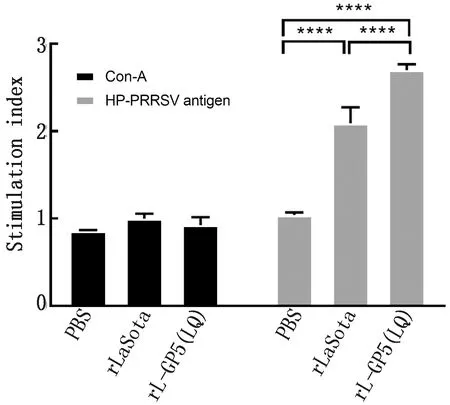
注:与对照组相比,****.P<0.000 1
3 讨论
此次研究选用为云南分离所得YN-LQ的毒株,与JXA1的同源性最高,其同源性为98.7%,通过序列对比证实为JXA1的变异株[10]。JXA1为PRRSV-2、美洲型毒株,并且JXA1为HP-PRRSV的代表毒株,在全国各地均有分布[11-12],近年来与野外毒株重组和自身氨基酸缺失产生新的变异株JXA1-like,给防治工作带来巨大困难[13]。YN-LQ作为JXA1的变异株,对于JXA1的防控能提供帮助,YN-LQ毒株虽然国内流行情况较少,但针对该毒株制备相应疫苗能作为潜在病原的一种疫苗技术储备。
在GP5序列后加入Flag标签,通过标签蛋白的鉴定情况来反应GP5蛋白是否成功表达,在计算后得出GP5蛋白大小应为30 kDa左右,通过PCR、酶切反应、Western blot和IFA试验鉴定结果说明,重组病毒已成功拯救,并能有效表达GP5蛋白,通过毒力检测显示其毒力与原始毒株相比无变化,均属弱毒株,且在小鼠免疫试验中疫苗注射后均未有不良反应和体质量减轻状况,因此安全性良好。
在小鼠免疫试验中,特异性抗体检测结果rL-GP5(LQ)组的抗体水平均有增长且高于rLaSota和PBS组,但是对比rLaSota组的抗体水平增幅比较小,原因可能为小鼠并非是PRRSV的易感动物,因此GP5抗原蛋白对于小鼠引发的特异性免疫应答不强。在中和抗体试验中,rL-GP5(LQ)组显示为持续不断的呈上升趋势,rLaSota和PBS组的中和抗体结果符合预期结果,处于较低水平,rL-GP5(LQ)与rLaSota组和PBS组相比较抗体水平呈现显著增长,进而说明rL-GP5(LQ)组不仅能成功诱导机体产生特异性和中和抗体。在脾脏淋巴细胞增殖试验中,rL-GP5(LQ)组对比PBS组有显著增长,而rLaSota组在接种病毒后增殖情况也出现升高,该情况可能与rLaSota载体本身具有很强的免疫刺激功能,也能引起小鼠机体的免疫应答有关。综上所述rL-GP5(LQ)疫苗在小鼠体内能够有效产生免疫应答,且能刺激产生较强的抗体水平。rL-GP5(LQ)重组NDV载体疫苗可作为疫苗候选,为国内对防控PRRS提供新的思路。
