鸭源新型鹅细小病毒抗体间接ELISA检测方法的建立及应用
2023-12-08汪宏才罗青平温国元
马 瑶,汪宏才,唐 晟,姚 伦,曾 哲,罗青平,5,曾 驰,商 雨*,温国元,5*
(1.湖北省农业科学院 畜牧兽医研究所,湖北 武汉 430064;2.武汉轻工业大学 生命科学与技术学院,湖北 武汉 430023;3.农业农村部畜禽细菌病防治制剂创制重点实验室,湖北 武汉 430064;4.畜禽病原微生物学湖北重点实验室,湖北 武汉 430064;5.湖北洪山实验室,湖北 武汉 430070)
新型鹅细小病毒(novel goose parvovirus,NGPV)是鹅细小病毒(goose parvovirus,GPV)的变种,属于细小病毒科(Parvoviridae)依赖病毒属(Dependoparvovirus)的雁属依赖细小病毒1群的成员[1]。NGPV主要感染30日龄以内的雏鸭,感染鸭典型的临床症状为生长缓慢、喙短舌头突出、体质量降低[2]。其发病具有明显季节性,在每年10月至次年5月多发,呈现地区散发,并且养殖场发病后再次饲养时发病率会明显增加[3]。NGPV既能水平传播,也能垂直传播[4-5],严重影响鸭出栏率,给养鸭行业带来了巨大的经济损失。1971年法国西南部的骡鸭中出现喙短、生长迟缓以及舌突出的症状,此后在波兰和匈牙利均有报道[6],2008年我国首次报道了该病例。研究表明引起短喙侏儒综合征(short beak dwarf syndrome,SBDS)的病原为GPV西欧株[7],是GPV的变种,因此被称为NGPV。2015年后,NGPV在我国鸭群中大暴发,致使大批鸭子出现SBDS症状,严重影响鸭的出栏率,其中影响最大的为樱桃谷鸭群[8]。
NGPV无囊膜,由32个衣壳粒组装而成的直径为20~22 nm的二十面体结构;其基因组是一条单链线性DNA,长度约为5.1 kb,两端具有U型发夹结构,可调控病毒的DNA复制。全基因组含有2个开放阅读框(open reading frames,ORFs),分别编码非结构蛋白(non-structural protein,NS)和结构蛋白(viral structural protein,VP)。非结构蛋白(non-structural protein,NS)是一种多效性调节蛋白包括NS1、NS2,主要参与调节病毒的复制和转录,并对宿主细胞具有一定的毒性。结构蛋白(viral structural protein,VP)主要有VP1、VP2、VP3共3种,是细小病毒组织嗜性、致病性和宿主范围的重要决定因素。它们在3′端区具有相同的基因序列和相同的终止密码子,但是它们的翻译起始密码子位于不同的位置。其中VP3占整个衣壳蛋白的80%,是主要的衣壳蛋白,包含了细小病毒主要的抗原决定簇,常以多肽的形式暴露在病毒表面,能够诱导机体产生中和抗体,是主要的免疫保护性抗原[9]。
目前,针对NGPV诊断常用的方法包括分子生物学检测和血清学诊断。分子生物学检测方法有荧光探针法[10]、环介导等温扩增法[11]、双重半巢式PCR检测法[12]、核酸探针法[13]等。血清学诊断方法有病毒中和试验、琼脂扩散抑制试验、间接免疫荧光试验、免疫印迹试验、酶联免疫吸附试验等。其中病毒中和试验重复性好、灵敏度高,还可以定性定量,但是试验周期较长不利于用于基层大批量样品的检测[14]。琼脂扩散试验不需要昂贵的仪器,试验结果肉眼可以观察到,并且操作简单便于在基层推广使用,但是灵敏度不高,需要消耗高效价抗血清和浓缩的病毒液[15]。免疫荧光技术[16]、免疫印迹试验[17]具有重复性好、灵敏度高的特点,但是成本较高,操作繁琐而且需要昂贵的仪器设备,不利于基层推广以及现场的检测,并且还会出现非特异性反应不利于结果的判断。相比这几种血清学检测方法,酶联免疫吸附试验具有较高的灵敏度、特异性,并且可以排除交叉感染的干扰,且成本不高可用于大批量样品检测,还可用于检测区分病毒感染还是疫苗免疫抗体[18-19]。本研究利用原核表达纯化的NGPV VP3截短蛋白作为包被抗原建立间接ELISA抗体检测方法,对该方法进行一系列的优化后,评估该方法的特异性、敏感性、重复性以及在临床样品检测中的应用效果,旨在为NGPV的感染情况监测以及疫苗免疫评估提供技术支撑。
1 材料与方法
1.1 菌毒种及血清感受态细胞E.coilDH5α和原核表达宿主菌E.coilBL21-Codon-Plus(DE3)购于TaKaRa公司;NGPV YICH株由本实验室分离并保存;NGPV标准阳性血清由实验室利用保存的毒株免疫GPV感染阴性鸭制备获得;鸭坦布苏病毒、新城疫病毒、禽流感病毒、鸭疫里默杆菌、E.coil阳性血清均由本实验室保存;临床血清来自哈尔滨、青岛和湖北等地。
1.2 工具酶及试剂表达质粒pET-28a为实验室保存;2×Phanta Max Master Mix购于南京诺维赞生物科技公司;DL2000 DNA Marker、限制性内切酶BamHⅠ和XhoⅠ、T4DNA连接酶购于TaKaRa公司;病毒RNA提取试剂盒购于美国Axygen公司;胶回收试剂盒和质粒提取试剂盒购于美国Omega公司;IPTG购于索莱宝公司;NTA His Bind树脂购于Millipore公司;BCA蛋白浓度测定试剂盒、HRP标记的羊抗鼠IgG多克隆抗体购于上海碧云天生物科技有限公司;鼠抗His tag 单克隆抗体购于北京博奥森生物技术有限公司;HRP标记的羊抗鸭IgG(H+L)多克隆抗体购于美国SeraCare(KPL)公司;TMB显色液、HRP稳定剂均购于科前生物公司。
1.3 VP3基因分析及截短片段克隆利用DNAStar软件对NGPV VP3蛋白二级结构进行分析,选择VP3蛋白抗原表位富集区(aa250~525),且该区域可塑性较高,形成表位的可能性较大,容易与抗体结合(图1),将该区段命名为VP3-tr。通过SnapGene5.3软件设计1对特异性扩增引物,VP3-tr-F:5′-TTGGATCCAATGAGGTAGACAGCA-ACAGAAATGCTC-3′(下划线处为BamHⅠ酶切位点),VP3-tr-R:5′-TTCTCGAGCAGATTTTGA-GTTAGATATCTGGTTCCAATC-3′ (下划线处为Xho Ⅰ酶切位点),引物由生工生物工程(上海)股份有限公司合成。
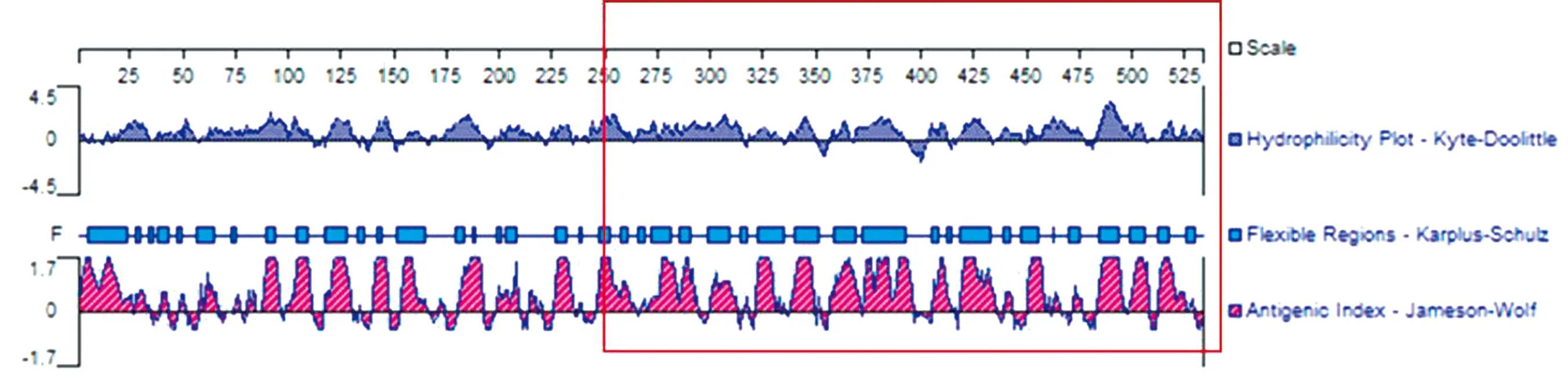
图1 蛋白亲水性、可塑性以及抗原表位分析
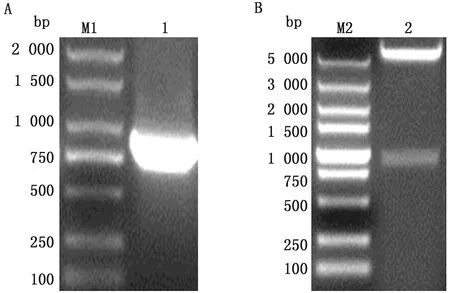
A.VP3截短基因PCR扩增(M1.DL2000 DNA Marker;1.VP3截短基因);B.重组质粒pET-VP3-tr的酶切鉴定(M2.DL5000 DNA Marker;2.重组质粒pET-VP3-tr)
1.4 重组质粒pET-VP3-tr的构建及鉴定提取NGPV YICH株的DNA,并以其作为模板,用引物VP3-tr-F和VP3-tr-R进行PCR扩增VP3-tr片段。将纯化的VP3-tr片段和原核表达载体pET-28a用Xho Ⅰ和BamHⅠ限制性内切酶进行酶切,纯化酶切后的pET-28a和VP3-tr片段,利用T4DNA连接酶将2个片段连接成质粒。连接产物转化E.coilDH5a感受态细胞后涂布Luria-Bertani(LB)平板并于37℃培养箱培养。通过PCR、双酶切以及测序鉴定筛选出构建正确质粒,并命名为pET-VP3-tr。
1.5 重组蛋白的表达与鉴定将重组质粒pET-VP3-tr转化至E.coilBL21(DE3),挑取单菌落至LB液体培养基中,37℃摇床培养至对数期,再加入1 mmol/L IPTG,16℃低温诱导表达12 h。诱导表达后,离心收集菌体,并用平衡缓冲溶液(PBS,pH=7.5)重悬,进行低温高压破碎。离心取上清和沉淀进行SDS-PAGE和Western blot检测分析。一抗为1∶2 000稀释的鼠抗His-tag单克隆抗体,二抗为HRP标记的羊抗鼠IgG多克隆抗体。
1.6 重组蛋白的纯化及鉴定收集破碎后的沉淀并置于8 mol/L尿素中进行变性,再用His-镍亲和层析柱对变性的蛋白进行纯化,纯化后的蛋白通过透析进行复性。将纯化的蛋白经SDS-PAGE后,电转至NC膜上,用5%脱脂乳室温封闭3 h,TBST洗涤3次,加入鸭源GPV阳性血清(稀释比例为1∶500)4℃过夜孵育;TBST洗涤3次,加入HRP标记的羊抗鸭IgG多克隆抗体(稀释比例为1∶2 000),室温孵育1 h;TBST洗涤3次,ECL化学发光显色。对鉴定正确的蛋白采用BCA法测定对其进行定量,并置于-80℃冰箱中保存。
1.7 间接ELISA方法反应条件的优化
1.7.1最佳抗原包被浓度和血清稀释度的确定 用方阵滴定法进行最佳抗原包被浓度和血清稀释度的确定。用包被液将纯化的VP3-tr蛋白按1∶100,1∶200,1∶400,1∶800,1∶1 600,1∶3 200,1∶6 400的比例稀释后,以100 μL/孔包被于酶标板中,4℃孵育过夜。用稀释液将阳性血清和阴性血清分别按1∶100,1∶200,1∶400,1∶800,1∶1 600,1∶3 200稀释,然后按100 μL/孔加入到酶标板中,进行间接ELISA检测,测定每孔的D630 nm值。计算相同稀释度的阴、阳血清的D630 nm的比值(P/N值),选择P/N值最大对应的稀释倍数作为抗原最佳包被浓度和血清最佳稀释度。
1.7.2最佳包被条件的确定 将加入包被蛋白的酶标板置于4种不同的条件中进行包被:① 37℃孵育2 h;② 4℃孵育过夜;③ 37℃孵育2 h,再于4℃孵育过夜;④ 4℃孵育过夜,再于37℃孵育2 h。孵育结束后加入最佳稀释度的阴、阳性血清进行ELISA检测,测定每孔的D630 nm值,计算P/N值,选择P/N值最大对应的包被条件作为最佳包被条件。
1.7.3封闭液的确定 根据前面确定的最佳抗原包被浓度、血清稀释度和最佳包被条件包被酶标板,分别用含有2% BSA、2%明胶、5%脱脂乳的磷酸盐缓冲液封闭包被的酶标板,加入最佳稀释度的阴、阳性血清进行间接ELISA检测,测定每孔的D630 nm值。计算相同稀释度的阴、阳血清的D630 nm的比值(P/N值),选择P/N值最大对应的封闭液作为最佳的封闭液。
1.7.4样品稀释液的确定 用最佳抗原包被浓度、最佳包被条件和最佳封闭液包被和封闭酶标板。然后分别以1×PBST、1%脱脂乳、1% BSA、2%脱脂乳、2%BSA、5%脱脂乳、5%BSA的磷酸盐缓冲溶液作为血清样品稀释液,将阴、阳性血清稀释至最佳浓度,进行间接ELISA检测,比较P/N值,确定最佳样品稀释液。
1.7.5血清最佳结合时间的确定 将稀释后的阴、阳性血清加入到包被并封闭好的酶标板中,置于37℃分别作用30,45,60,90 min,继续进行间接ELISA检测,测定D630 nm值,选择P/N值最大对应的作用时间作为血清最佳结合时间。
1.7.6二抗最佳稀释度及孵育时间的确定 根据已经优化好的条件,利用方阵滴定法对阴、阳性血清进行ELISA检测,并将HRP标记的羊抗鸭IgG多克隆抗体用HRP稳定剂分别按1∶2 500,1∶5 000,1∶7 500,1∶10 000的比例进行稀释,分别置于37℃孵育30,45,60 min,测定D630 nm值,选择P/N值最大对应的条件作为二抗最佳稀释度及孵育时间。
1.7.7底物最佳显色时间的确定 按照上面确定的条件对阴、阳性血清进行ELISA检测,加入TMB显色液后,分别置于37℃避光孵育5,10,15,20 min,测定D630 nm值,选择P/N值最大对应的时间作为底物最佳显色时间。
1.9 特异性试验用建立的ELISA抗体检测方法分别对鸭坦布苏病毒、新城疫病毒、禽流感病毒、鸭疫里默杆菌、E.coil阳性血清进行检测,来检验建立的方法是否与其他阳性血清存在交叉反应。
1.10 敏感性试验将实验室制备的标准阳性血清以2倍梯度稀释(按1∶200稀释至1∶102 400)后进行ELISA检测,根据确定的阴、阳临界值对试验结果进行判定,确定其敏感性。
1.11 重复性试验同一批制备的抗原包被的酶标板随机检测6份NGPV阳性血清,重复4次,进行批内重复性试验,计算变异系数(CV)。再用3个不同时间包被的酶标板检测6份NGPV阳性血清进行批间重复性试验。
1.12 间接ELISA方法的临床应用使用建立的ELISA抗体检测方法对147份来自哈尔滨、青岛和湖北等地区临床血清样品进行抗体检测,同时用Western blot方法对这些样品进行平行检测,计算符合率并计算Kappa系数分析这2种方法检测结果的一致性。
2 结果
2.1 目的片段扩增以及重组质粒pET-VP3-tr的鉴定以实验室保存的毒株提取DNA为模板,扩增VP3截短基因,扩增的条带在750~1 000 bp之间,与预期大小(876 bp)相符(图2A)。利用BamHⅠ和XhoⅠ这2个限制性内切酶对扩增的片段以及载体pET-28a分别进行酶切,然后连接转化至感受态细胞DH5α中,筛选出阳性质粒后,再通过酶切鉴定,结果与预期相符(图2B)。将酶切结果正确的质粒送至生工生物工程(上海)股份有限公司进行测序,测序结果完全正确表明重组质粒pET-VP3-tr构建成功。
2.2 重组蛋白的表达鉴定将鉴定正确的重组质粒pET-VP3-tr转化至感受态细胞BL21(DE3)中,培养至对数期加入IPTG,16℃诱导表达。用SDS-PAGE和Western blot检测蛋白表达情况,结果表明在35 kDa附近有明显条带,大小与重组蛋白VP3-tr预期(36 kDa)相符,在破碎上清和沉淀均有表达,但是沉淀中表达量较高(图3)。
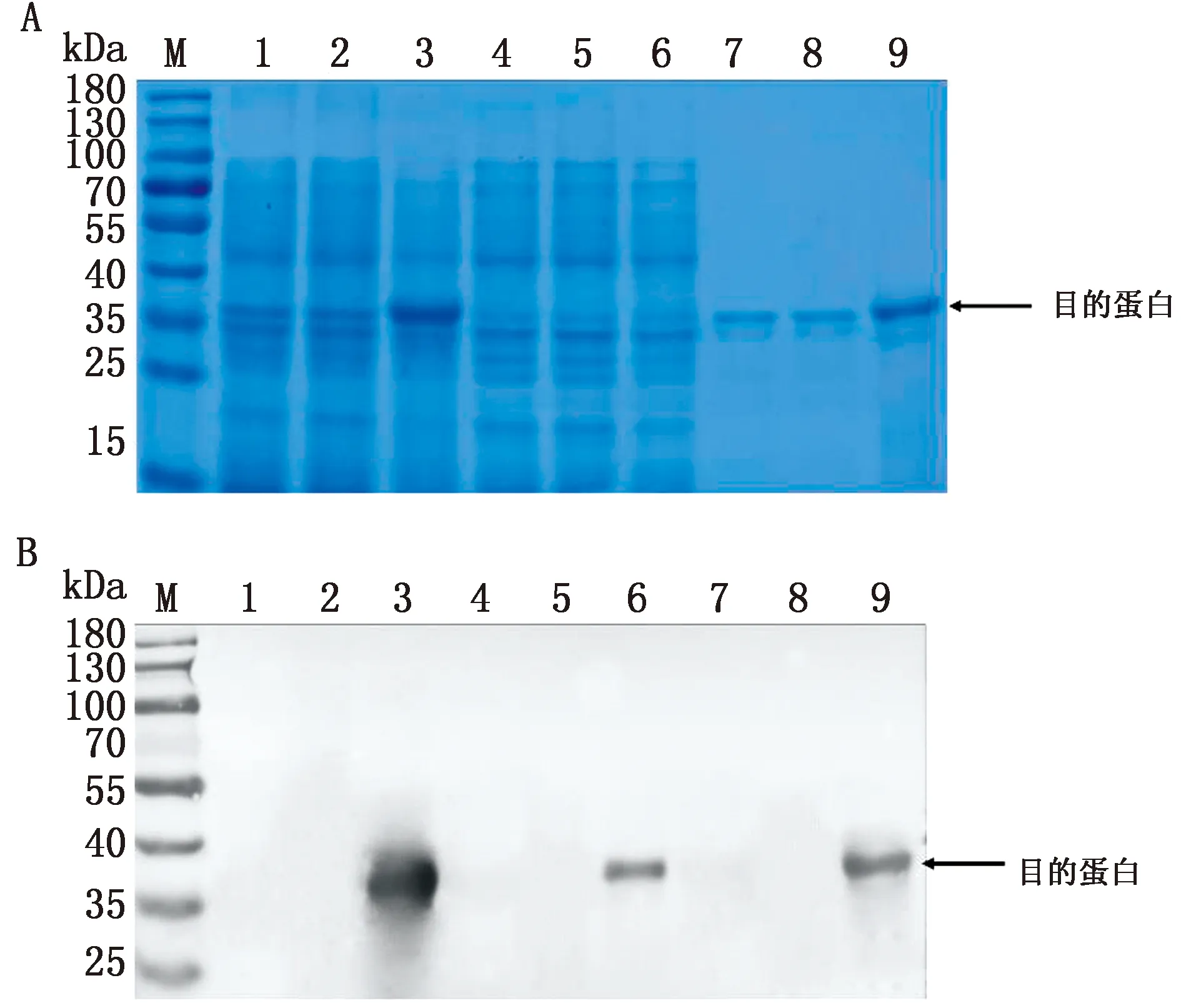
M.蛋白Marker;1.诱导后空载pET-28a全菌;2.诱导前pET-VP3-tr全菌;3.诱导后pET-VP3-tr全菌;4.诱导后空载pET-28a破碎上清;5.诱导前pET-VP3-tr破碎上清;6.诱导后pET-VP3-tr破碎上清;7.诱导后空载pET-28a破碎沉淀;8.诱导前pET-VP3-tr破碎沉淀;9.诱导后pET-VP3-tr破碎沉淀
2.3 重组蛋白的纯化及鉴定将鉴定正确的重组质粒pET-VP3-tr转化至感受态细胞BL21(DE3)中,扩大培养并加入IPTG进行低温诱导表达,12 h后收集菌体破碎沉淀。将包涵体进行变性、亲和层析纯化、复性后,进行SDS-PAGE检测,结果显示在35 kDa附近出现1条单一的蛋白条带与预期VP3-tr蛋白大小相符(图4A)。进一步进行Western blot检测,以实验室制备的GPV阳性血清作为一抗,结果显示在36 kDa处出现单一的反应条带,表明成功获得了纯度较高的VP3-tr蛋白(图4B),并用BCA法测得VP3-tr蛋白的质量浓度为0.8 g/L。

M.蛋白Marker;1.纯化的VP3-tr蛋白
2.4 间接ELISA方法最佳反应条件的确定经过系列条件优化,建立了鸭源GPV抗体间接ELISA方法,各步骤最佳条件: 重组VP3-tr蛋白包被质量浓度为0.5 mg/L,包被条件为37℃孵育2 h,封闭液为含5%脱脂乳的磷酸盐缓冲液,样品稀释液为1×PBST,检测血清的稀释度为1∶200,血清最佳的结合条件为37℃孵育30 min,二抗稀释度为1∶12 500,二抗孵育条件为37℃孵育30 min,显色条件为37℃孵育5 min。

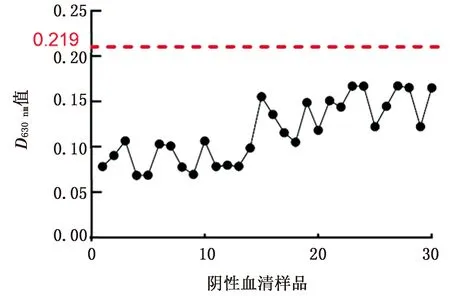
图5 NGPV抗体阴性的鸭血清的间接ELISA检测
2.6 间接ELISA方法的特异性试验用建立的ELISA抗体检测方法分别对鸭坦布苏病毒、新城疫病毒、禽流感病毒、鸭疫里默杆菌、E.coil阳性血清进行检测,结果显示建立的ELISA方法与5种病原阳性血清不发生交叉反应,表明建立的方法具有良好的特异性(表1)。

表1 间接ELISA方法的特异性试验
2.7 间接ELISA方法的敏感性试验用建立的间接ELISA抗体检测方法对2倍梯度稀释的标准阳性血清进行抗体检测,检测结果表明为当血清稀释到1∶25 600时,检测结果仍为阳性(图6),表明该方法具有较好的灵敏度。

图6 间接ELISA方法的灵敏度检测结果
2.8 间接ELISA方法的重复性试验批内重复检测结果的批内CV为4.07%~5.67%,批间重复检测结果的批间CV为4.32%~5.28%(表2),结果表明该检测方法具有良好的重复性。
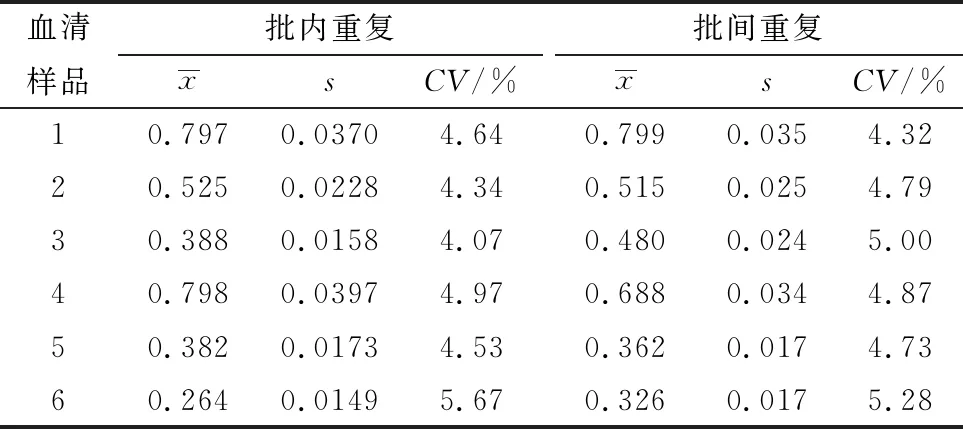
表2 重复性试验结果
2.9 间接ELISA方法的临床样品检测对147份来自哈尔滨、青岛和湖北等地临床鸭血清样品分别进行间接ELISA抗体检测和Western blot检测。结果显示,间接ELISA方法检测出阳性125份,阴性22份;Western blot检测出阳性102份,阴性45份;其中有102和22份样品分别被这2种方法检测后确定为阳性和阴性(表3)。这2种方法的符合率为84.4%,Kappa统计分析表明这2种方法的显著性一致性为0.57,表明这2种方法之间具有中等的一致性。ELISA和Western blot方法检测的阳性率分别为85%和69%,表明间接ELISA方法的灵敏度要高于Western blot检测方法。
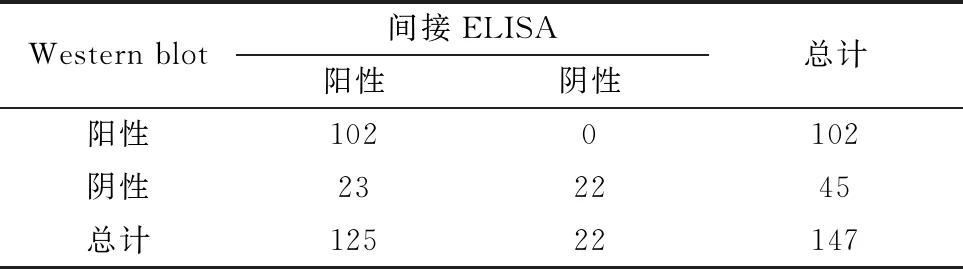
表3 间接ELISA方法和Western blot检测方法的比较 份
3 讨论
水禽是一种重要的经济动物,在中国有着悠久的商业历史。我国是水禽养殖大国,然而传染病一直威胁着水禽养殖业的健康发展。近些年,由NGPV感染引起的SBDS在江苏、安徽、山东等省的鸭群中流行,产生大批量的残次鸭,给鸭养殖行业带来巨大的经济损失。目前对这一疾病的主要防控手段就是疫苗免疫种鸭、雏鸭,但是可能由于免疫覆盖率不足以及母源抗体产生的水平不一致等原因导致NGPV时常在一定范围内流行。因此,开发快速可靠的检测方法在临床上对免疫效果以及雏鸭母源抗体水平的检测显得尤为重要[17]。有研究报道,大多数细小病毒属成员对哺乳动物的红细胞具有凝集作用,可以用血凝试验(hemagglutination assay,HA)作为病毒鉴定或血凝抑制试验(hemagglutination Inhibition assay,HI)作为血清抗体测定的常用手段。而GPV不具有使哺乳动物红细胞凝集作用,根据这一特征可以用于区分GPV与其他细小病毒属成员[20]。GPV只有一种血清型,有学者表明,GPV能使黄牛的精子凝集,为GPV的鉴定提供检测方法,但是该方法不易操作以及黄牛精子不易获得[21]。NGPV血清学检测方法主要有病毒中和试验,琼脂扩散试验、间接免疫荧光试验、免疫印迹试验、酶联免疫吸附试验等。而酶联免疫吸附试验相比其他的几种方法操作简单、快速、灵敏度高、特异性强,适合用于基层大批量样品的检测、成本低廉,因此在临床上被广泛的应用。目前临床上暂时还没有关于检测鸭血清中NGPV抗体的试剂盒出售,因此本研究拟建立鸭源NGPV抗体间接ELISA检测方法。
利用方阵滴定法优化ELISA方法的反应条件,确立了最佳的检测条件。用确定的最佳反应条件对30份阴性血清检测,计算得到阴、阳性临界值为0.219。对此方法的灵敏性、特异性、重复性进行分析,该方法表现出较高的灵敏性、特异性和重复性。用该方法与Western blot检测方法进行符合,符合率为84.4%,且阳性率比Western blot方法要高,表明该方法灵敏度更高。将本试验建立的间接ELISA方法与已有的以VP3全长作为包被抗原建立的间接ELISA方法相比,已建立的方法当阳性血清稀释至1∶10 240时,仍检测为阳性,而本试验建立的方法当阳性血清稀释至1∶25 600时,仍检测为阳性,表明我们建立的方法灵敏度更高[20]。与以往建立的NGPV间接ELISA方法相比,本试验建立的方法阳性检出率更高[20,22]。且本试验建立的间接ELISA方法与传统的血清学检测方法琼脂扩散试验以及病毒中和试验相比,更容易方便操作,并且耗时短,便于大批量样品的检测。
综上所述本研究成功建立了鸭源NGPV抗体的间接ELISA检测方法,可用于鸭感染NGPV后的感染情况监测以及免疫后的抗体水平监测,为鸭感染新型鹅细小病毒的监测预防提供了一种检测手段,具有广泛的应用前景。
