D型流感病毒NP蛋白的原核表达及多克隆抗体的制备
2023-12-08肖雨晴程娇娇孙锐瑶陈妍希谯薇美远立国李守军
肖雨晴,程娇娇,孙锐瑶,陈妍希,谯薇美,尹 鑫,远立国,李守军,卢 刚*
(1.华南农业大学 兽医学院 广东省兽医临床重大疾病综合防控重点实验室,广东 广州 510642;2.中国农业科学院 哈尔滨兽医研究所,黑龙江 哈尔滨 150069)
D型流感是由D型流感病毒(influenza D virus,IDV)引起的接触性传染病,主要引起宿主的呼吸道症状或呼吸道炎症,也可引起病毒血症。D型流感使宿主抵抗力下降,导致其他病原微生物的继发感染,给养殖业带来严重损失[1-2]。
IDV是有包膜、单股、分节段的负链RNA病毒,属于正黏属病毒科(Orthomyxouiridae),丁(D)型流感病毒属(Deltainfluenza virus)[3],但其抗体与甲(A)型流感病毒(influenza A virus,IAV)、乙(B)型流感病毒(influenza B virus,IBV)、丙(C)型流感病毒(influenza C virus,ICV)均无交叉反应[4]。其感染宿主范围较广,研究表明牛是IDV的天然宿主[5],也可感染马、野猪、水牛、骆驼甚至人[6-7]。IDV流行范围广阔,近几年有进一步发展蔓延的趋势,必须警惕其对畜牧业和公共卫生安全的威胁[8-9]。目前IDV的诊断方法主要采用病毒分离培养、血清学诊断技术(主要包括血凝试验和血凝抑制试验)和分子生物学检测技术(主要包括RT-PCR和荧光定量RT-PCR)[1]。
IDV基因组约为12 800 bp,由7个RNA片段构成,分别为PB2、PB1、P3、HEF、NP、P42(M)和NS,每个RNA片段都编码具有相应功能的蛋白[4]。NP基因长度为1 775 bp,编码大小约为61 kDa的核衣壳蛋白。该蛋白与聚合酶复合物作用形成核糖核蛋白复合体(ribonucleoprotein complex,RNP),在病毒的复制以及翻译过程中具有关键作用[10]。此外,NP通过一些其他机制在病毒复制适应性方面发挥重要作用,包括免疫逃避、细胞凋亡和自噬的调节以及与其他一些宿主因子的相互作用[11-14]。本研究对IDV NP片段进行原核表达并制备多克隆抗体,为IDV蛋白水平研究和探索奠定基础。
1 材料与方法
1.1 载体pET-B2M载体和TreliefTM5α感受态细胞(TreliefTM5α chemically competent cell)购自北京擎科新业生物技术有限公司;2株IDV毒株(D/bovine/Mississippi/c00046N/2014、D/swine/Oklahoma/1334/2011)NP蛋白的真核表达质粒pCAGGs-BovineNP、pCAGGs-SwineNP由本教研室分别构建并保存。
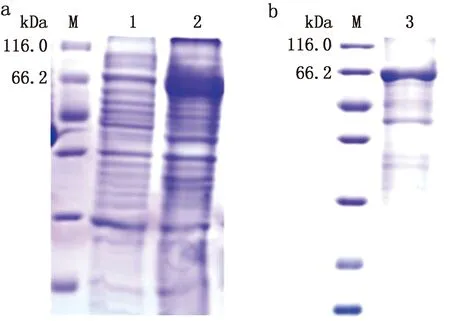
A.上清、沉淀蛋白SDS-PAGE结果(M.蛋白Marker;1.上清蛋白;2.沉淀蛋白);b.纯化后沉淀蛋白SDS-PAGE结果(M.蛋白Marker;3.纯化后沉淀蛋白)

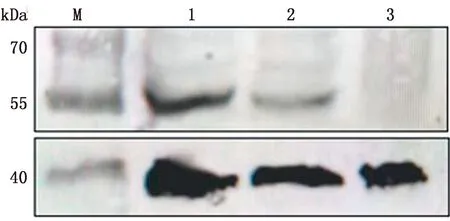
A.纯化后重组NP蛋白多克隆抗体SDS-PAGE结果(M.蛋白Marker;1.纯化后重组NP蛋白多克隆抗体);b.纯化后重组NP蛋白多克隆抗体Western blot验证结果(M.蛋白Marker;2.免前抗体孵育;3.纯化后抗体孵育)
1.2 细胞和病毒人胚肾细胞(HEK-293T)、牛肾细胞(MDBK)由本教研室保存。D/bovine/Mississippi/c00046N/2014毒株由本教研室保存。
1.3 主要试剂和仪器BsmBⅠ-v2等限制性内切酶、T4DNA 连接酶购自美国NEB公司;DL5000 DNA Marker、DL2000 DNA Marker购自广州东盛生物科技有限公司;TS-GelRed核酸凝胶染料购自北京擎科新业生物技术有限公司;亲和层析柱购自武汉汇研生物公司。本研究使用的主要仪器蛋白转印设备、SDS-PAGE设备均购自美国BIO-RAD公司。
1.4 NP原核表达系统的构建根据IDV NP编码区序列及pET-B2M质粒序列,设计引物进行PCR扩增。以公司合成的牛源(D/bovine/Mississippi/c00046N/2014)作为模板,通过PCR技术获得牛源IDV NP片段的扩增产物。
高保真PCR反应体系:模板DNA 2 μL,上、下游引物各2 μL,Phanta Max super-Fidelity 1 μL,dNTP Mix 1 μL,2×Phanta Max Buffer 25 μL,无酶水补至50 μL。高保真PCR反应程序: 96℃ 3 min预变性;96℃ 15 s变性,55℃ 15 s退火,72℃ 15~30 s/kb延伸,35个循环; 72℃延伸5 min,12℃保存。PCR产物进行核酸凝胶电泳条带大小鉴定并回收。
用BsmBⅠ-v2对PCR 产物进行酶切处理后,将其克隆至原核表达载体 pET-B2M,构建pET-B2M-NP原核表达载体。连接产物转化TreliefTM5α感受态细胞,于恒温细菌培养箱中倒置培养12 h提取重组质粒。
M.蛋白Marker;1.pCAGGs-BovineNP;2.pCAGGs-SwineNP;3.阴性对照
1.5 NP多克隆抗体的制备
1.5.1验证NP蛋白的表达及可溶性 将重组阳性质粒pET-B2M-NP转化TreliefTM5α感受态细胞,取含pET-B2M-NP的100 μL菌液加入100 mL氨苄抗性的LB培养基中,恒温摇床过夜培养至D600 nm≈0.6。加入IPTG诱导剂至终浓度0.5 mmol/L,30℃继续培养4 h。8 000 r/min离心3 min沉淀菌体,用预冷的NTA-0缓冲液重悬菌体,冰浴30 min后超声破碎,4℃ 16 000 r/min离心50 min,取少量上清、沉淀,分别进行SDS-PAGE检测,其余保存至4℃。
1.5.2NP蛋白纯化 参考1.5.1进行菌液的诱导表达,收集菌体沉淀。使用6 mol/L盐酸胍4 mL重悬包涵体,加DTT至浓度为5 mmol/L,恒温培养3 h促使包涵体完全溶解。4℃ 10 000 r/min离心10 min,取适量上清进行SDS-PAGE检测。采用镍柱亲和层析的方法纯化蛋白。
1.5.3动物免疫及效价检测 抗原乳化后进行免疫兔试验,2只实验兔,免疫流程如表1所示,免疫后进行多克隆抗体效价测定。
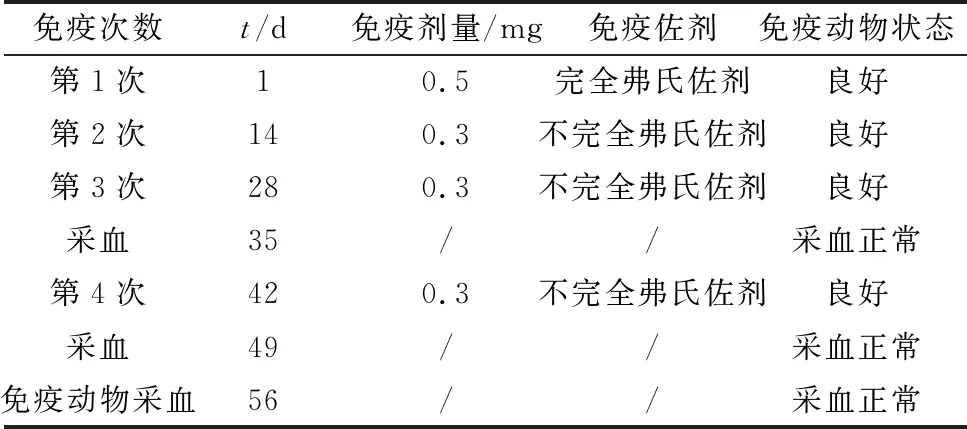
表1 NP蛋白免疫流程
1.5.4抗体纯化 使用亲和层析法纯化NP多克隆抗体,收集洗脱物至检测无蛋白流出,调节洗脱物pH至中性,经10 kDa超滤管,将洗脱物浓缩至3 mL左右。使用0.01 mol/L(pH=7.4)PBS 5 L过夜透析,次日换液1次,后透析6 h。随后进行SDS-PAGE电泳,同时测定抗体浓度。
1.6 多克隆抗体Western blot、间接免疫荧光验证试验
1.6.1Western blot验证试验 将293T细胞均匀铺至6孔细胞培养板,使用pCAGGs-BovineNP、pCAGGs-SwineNP质粒进行转染。将表达产物SDS-PAGE电泳后转至PVDF膜,使用碧云天快速封闭液,常温封闭15 min。加入适量提前稀释好的NP(NP抗体∶抗体稀释液=1∶5 000)抗体,4℃孵育16 h。PBST清洗3遍,加入二抗,避光条件常温孵育1 h。回收二抗,使用PBST避光清洗3遍,再进行扫膜观察。
1.6.2间接免疫荧光验证试验 将MDBK细胞均匀铺至6孔细胞培养板,细胞密度达60%~70%时,弃去旧培养基,使用PBS缓慢清洗1遍,然后将IDV病毒液600 μL加入到6孔板内,在37℃培养箱孵育1 h,弃去废液,无菌PBS清洗2遍,加入2 mL含有0.5 mg/L TPCK-trypsin、1% FBS培养基进行培养。在病毒感染36 h后进行间接免疫荧光试验。加入适量4%多聚甲醛进行细胞固定,固定后使用适量碧云天快速封闭液,4℃封闭15 min。加入适量稀释的NP抗体(NP抗体∶抗体稀释液=1∶500),4℃孵育12~16 h。PBST清洗3遍,加入二抗,避光条件常温孵育1 h。回收二抗,使用PBST避光清洗3遍,再加入DAPI染色液,常温下避光孵育5 min。最后使用TBST常温、避光清洗3 min,重复3遍后避光进行免疫荧光的观察。
2 结果
2.1 NP序列分析对IDV NP编码区序列进行跨膜区分析、信号肽分析、疏水性分析、抗原性分析及结构域分析,结果如图1所示。
NP基因编码552个氨基酸,无跨膜区、无信号肽序列,500~552氨基酸为连续无序性,可能会影响蛋白表达;局部亲水性较好;以免疫原分析发现全长蛋白抗原的指数得分适中,理论上可产生较好免疫;从同源性及抗体制备需求分析,发现该蛋白在IDV中保守性较好,与实验动物蛋白同源性很低,具备较高的免疫原性;综上所述,选择1~500氨基酸作为抗原区段,进行重组NP蛋白的制备。
2.2 重组NP蛋白的表达、可溶性鉴定及纯化阳性菌液经过诱导后,取部分菌液破碎、离心,对上清、沉淀进行SDS-PAGE分析。结果如图2a所示,上清和沉淀中均有目的蛋白(72 kDa)的表达,且沉淀中目的蛋白表达量高于上清。沉淀蛋白纯化结果如图2b所示。
2.3 多克隆抗体效价测定所获得多克隆抗体按照表2、3所示梯度稀释,进行间接ELISA检测。2只实验兔血清效价均超过1∶100 000,编号001实验兔血清滴度为1 024 000,编号002实验兔血清滴度为128 000,且D抗体血清/D免疫前血清都大于2.0。

表2 多克隆抗体效价检测表
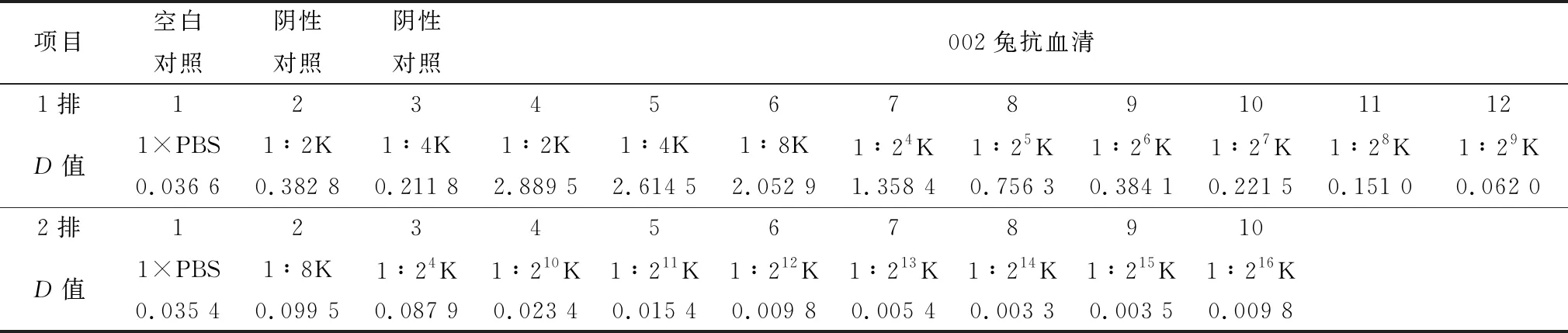
表3 多克隆抗体效价检测表
2.4 多克隆抗体纯化及Western blot、间接免疫荧光验证重组NP蛋白多克隆抗体经过纯化后,其SDS-PAGE结果如图3a,标记的1号泳道为纯化后重组NP蛋白多克隆抗体,抗体纯化质量浓度为10 g/L。纯化后的抗体与重组抗原Western blot检测(图3b),2号泳道为免疫前抗体孵育,3号泳道为纯化后抗体孵育。在约70 kDa处有特异性识别,与预期信号相符,且条带相对单一。
使用pCAGGs-BovineNP、pCAGGs-SwineNP质粒转染至293T细胞24 h后进行Western blot试验验证所制备多抗的免疫反应性,检测结果如图4所示,在61 kDa附近有单一条带。使用病毒感染MDBK细胞后进行间接免疫荧光试验,间接免疫荧光试验结果如图5所示,可以看到经病毒感染后的细胞中有明显的绿色荧光。表明本研究中制备的NP多克隆抗体能够用来检测IDV。
3 讨论
2011年,首次于美国报道从表现呼吸道症状的猪群中分离出IDV[15],随后的研究表明IDV广泛流行于牛群中[3]。除在牛群血清中检测到IDV抗体外,小型反刍动物、家禽、马、野猪等血清样品中也检测出少数IDV抗体阳性,表明IDV可感染多种动物[16-18],试验条件下,IDV还可以感染雪貂和豚鼠[4,19]。虽然目前没有IDV感染人的报道,但研究表明IDV能够在人气道上皮细胞内(human airway epithelial cells,hAECs)高效复制。IDV还能在用于研究人源流感病毒的动物模型体内复制[4,19]。此外,有研究证明在有IDV疫情牛场的工作人员中,其血清中IDV抗体阳性率比普通人群高[20]。这些研究均表明IDV具有感染人的潜在风险,必须警惕其对公共卫生安全的威胁并重视其后续研究。
IDV可引起宿主呼吸道症状甚至病毒血症,进而导致其他呼吸道疾病的严重继发感染,临床病理表现复杂,因此需要实验室检测来进行确诊。血凝抑制试验是流感病毒常用的血清学检测方法,但其针对的靶蛋白是HA;而HA蛋白时常为了逃避免疫而发生抗原漂移,导致标准抗体血清与流行株的交叉反应能力下降[21],最终造成血凝抑制试验的灵敏度下降。
与ICV一样,IDV由7个RNA片段构成,共编码PB2、PB1、P3、HEF、NP、P42(M)和NS等多个蛋白,但其与ICV的氨基酸相似性仅约50%。与IAV和IBV病毒粒子表面均有血凝素(hemagglutinin,HA)和神经氨酸酶(neuraminidase,NA)2个糖蛋白不同,IDV病毒粒子表面只含有1个糖蛋白,即HEF。根据IDV的HEF片段基因组差异可将其划分为5个谱系,即:D/OK、D/660、D/Yama/2016、D/Yama/2019、D/California/2019[22]。由于流感病毒表面糖蛋白对其致病性和宿主感染方面具有重要作用,因此目前研究较多的是IDV的HEF蛋白。
NP蛋白是IDV复制中不可或缺的蛋白,其参与RNA的包装、核转运、vRNA转录和复制以及病毒基因组的转录与复制。且与易变异的NA和HA蛋白相比,流感病毒NP蛋白具有高序列保守性[23]。NP蛋白的单克隆抗体常被用于流感病毒的血清学与分子生物学检测[24-25]。而多克隆抗体具有制备简单、耗费时间短、花费较少等优点,因此本研究旨在对IDV NP蛋白进行原核表达并制备多克隆抗体,为IDV快速诊断技术和后续蛋白水平研究奠定基础。
本研究通过对IDV N基因进行序列分析,选定无跨膜区和信号肽序列的1~500氨基酸区段为制备重组NP蛋白的最佳抗原区段;构建了pET-B2M-NP重组阳性质粒,转化后经IPTG诱导表达了相对分子质量约为72 kDa的重组NP蛋白。免疫新西兰白兔制备多克隆抗体,间接ELISA结果显示抗体效价超过1∶100 000;在Western blot与间接免疫荧光试验中均能有效检测出阳性结果,表明本研究制备了免疫原性和特异性良好的兔抗NP多克隆抗体。IDV NP蛋白多克隆抗体的制备为研究NP蛋白的结构和功能提供了条件,对于后续开展IDV研究具有重大意义。
