猪细小病毒VP2蛋白的原核表达及其免疫原性评估
2023-12-08王利霞朱利塞钟永亮林福新王贵平白挨泉贾爱卿
王利霞,朱利塞,钟永亮,田 欣,林福新,王贵平,白挨泉,贾爱卿*
(1.佛山科学技术学院,广东 佛山 528231;2.广东海大畜牧兽医研究院有限公司,广东 广州 511400;3.广东省养猪与猪病防控技术研究企业重点实验室,广东 广州 511400)
猪细小病毒病(porcine parvovirus infection,PPI)是怀孕母猪感染猪细小病毒(porcine parvovirus,PPV)导致产木乃伊胎、死胎、弱仔和分娩周期延长、重复配种和不孕等繁殖障碍疾病[1]。PPV对各种年龄、性别的猪都易感,特别对初产母猪和仔猪的危害最为严重,且母猪不表现出临床症状[2]。迄今为止,在猪身上发现了7种PPV基因型(PPV1~PPV7)。有研究调查在2016—2020年之间中国8个省份采集的435份临床样本中共有241份为PPV阳性,感染率占55.4%[3]。PPV基因组主要包含2个主要的开放阅读框,上游开放阅读框编码非结构蛋白(NS1、NS2和NS3),对病毒DNA复制和基因表达调控起重要作用[4]。下游开放阅读框编码结构蛋白(VP1、VP2和VP3),在病毒组装和感染中起主要作用,包括病毒吸附、侵入、运输及定位、自组装和释放等[5-6]。其中VP2蛋白是主要的衣壳蛋白,含有多种抗原表位,为主要中和抗体的靶蛋白并可自组装成病毒样颗粒(virus-like particles,VLPs)[7],在研发疫苗和诊断试剂中发挥重要作用。
目前国内PPV的防控和净化工作形势严峻,迫切需要PPV疫苗等防控技术与产品。现国内市场上PPV疫苗都为全病毒灭活苗,其优点是安全、产生的抗体持续时间长且储存方便,不需要低温保存,但也存在抗体产生较慢、副作用较大、不能诱导细胞免疫以及免疫效果不稳定,使用剂量大和成本较高的问题[8-9]。与此同时,多项研究已经表明基因工程亚单位疫苗不含病毒感染组分,安全无致病性,其为病毒表面的特定蛋白,经纯化后免疫针对性强,配合理想佐剂使用可产生高效特异性抗体,适合规模化生产等特点[10],如今重组亚单位疫苗被认为是开发多种病毒疫苗的候选者。目前国内已批准上市的兽药亚单位疫苗有猪圆环病毒2型亚单位疫苗,王世旗等[9]研究表明亚单位疫苗的应激率和死淘率都低于全病毒灭活苗组。因此研发一款安全高效的新型PPV疫苗至关重要。VP2蛋白与PPV的抗原性密切相关,其含有大部分B细胞活性蛋白,被认为是PPV疫苗的主要免疫保护性抗原[11]。本研究通过原核表达系统构建了与伴侣蛋白共表达,促进VP2蛋白以正确构象折叠;同时,构建了另一个冷休克表达载体,使VP2蛋白在低温条件下被特异性诱导表达,提高蛋白的溶解性和稳定性,避免以包涵体形式表达。2个重组载体都成功获得了可溶性VP2蛋白,使用MontanideTMISA 206 VG佐剂混合乳化(简称206佐剂)制备PPV VP2亚单位疫苗,将PPV VP2亚单位疫苗免疫豚鼠,分析其血凝抑制抗体效价,为研发PPV亚单位疫苗的研究奠定基础。
1 材料与方法
1.1 病毒、质粒与菌株pET28a质粒和PPV毒株由本实验室保存;pTF16分子伴侣质粒和pCold Ⅰ质粒购自武汉淼灵生物科技有限公司;感受态细胞DH5α、BL21(DE3)购自南京诺唯赞生物科技股份有限公司。
1.2 酶、试剂与实验动物蛋白Marker、DNA Ligation Kit、限制性内切酶购自宝日医生物技术有限公司;辣根过氧化物酶标记山羊抗豚鼠IgG购于碧云天生物技术有限公司;镍亲和层析柱购于Cytiva公司;其他试剂均为国产分析纯。体质量为300~400 g雌性健康豚鼠,购自南方医科大学实验动物中心。
1.3 PPV VP2基因的扩增基于GenBank(登录号:QII89074.1)已发表的PPV VP2基因序列,应用引物软件设计1对PCR扩增引物,上游引物P1:(BamHⅠ)5′-ACGCGTCGACATGGGTGGCGGA-AGTGGAATGTCAGAAAATGTAGA-3′;下游引物P2:(Sal I)5′-CGCGGATCCATAGAGCTTT-CTCGGGATCAATT-3′。以PPV毒株DNA为模板,P1、P2为上、下游引物,反应程序为:预热94℃ 5 min;变性 94℃ 30 s,退火 56℃ 30 s,延伸 72℃ 1.5 min,30个循环;72℃ 10 min。PCR产物用1%琼脂糖电泳鉴定后,回收目的片段。
1.4 原核表达载体的构建与鉴定将VP2 PCR产物与原核表达载体pET28a和pColdⅠ,分别用BamHⅠ、SalⅠ进行双酶切,回收酶切产物后,用DNA 连接酶于4℃下连接过夜,连接产物转化至感受态细胞DH5α,涂布于含有对应抗性的LA平板上,将PCR鉴定为阳性的单克隆菌液进一步提取质粒,经双酶切和测序验证。将构建成功的表达载体pET28a-VP2转化至感受态细胞BL21(DE3)中,挑取阳性单克隆菌株制成感受态细胞,并将分子伴侣质粒pTF16转化至上述感受态细胞中,37℃恒温箱培养16 h,挑取单克隆菌落摇菌培养,筛选阳性共表达重组菌。
1.5 重组蛋白的表达及鉴定
1.5.1重组蛋白表达及条件优化 将重组菌pET28a-VP2-tf16、pCold Ⅰ-VP2接种至含对应抗性的LB培养基中,以37℃、220 r/min震荡培养至D600≈0.5,进行诱导表达,添加浓度为1.0 mmol/L IPTG,另外pET28a-VP2-tf16还需添加质量浓度为2 g/LL-阿拉伯糖,15℃诱导表达24 h。离心收集菌体,用悬浮缓冲液(20 mmol/L Tris-HCl,150 mmol/L NaCl,pH=8.0)洗涤菌体,置于冰上超声破碎,离心收集上清液和沉淀SDS-PAGE验证表达形式。选择高效表达的重组菌株进行最佳诱导条件优化,固定诱导剂IPTG浓度1.0 mmol/L,时间为24 h,诱导温度设置为30,25,15℃;固定诱导剂IPTG浓度为1.0 mmol/L,重组蛋白pET28a-VP2-tf16诱导温度设定为15℃,诱导时间设置为12,16,20,24 h;固定诱导时间为24 h,重组蛋白pET28a-VP2-tf16诱导温度设定为15℃,重组蛋白pCold Ⅰ-VP2诱导温度设定为25℃,IPTG浓度设置为1.0,0.7,0.3,0.1 mmol/L。将上述蛋白样品超声破碎后SDS-PAGE,以目的条带表达量确定最优诱导条件。确定表达条件后利用镍亲和层析柱纯化重组蛋白。
1.5.2重组蛋白Western blot鉴定 将重组蛋白进行SDS-PAGE电泳,利用蛋白湿转仪将蛋白转至PVDF膜上,5%脱脂奶粉4℃封闭过夜,PBST洗涤2次,用PPV特异性血清为一抗,室温摇床孵育1 h,PBST洗涤4次,再加入相对应的HRP标记二抗,室温摇床孵育1 h,PBS洗涤4次后,用DAB法显色。
1.5.3重组蛋白VLP电镜鉴定 为确定pCold Ⅰ-VP2重组蛋白能否在体外组装成VLPs,取透析后重组蛋白照透射电镜。
1.5.4重组蛋白血凝活性鉴定 取96孔V型板,每孔加入25 μL PBS,从第2列开始等体积2倍稀释重组蛋白,最后加入25 μL 0.6% 豚鼠红细胞悬液,置室温30~45 min判定结果,以100%凝集红细胞时的最高稀释倍数为血凝效价。
1.6 免疫原性评估将30只豚鼠随机均分为3组。1组每只豚鼠免疫pCold Ⅰ-VP2蛋白和206佐剂乳化制备的VP2亚单位疫苗0.5 mL(含重组蛋白100 μg),2组免疫PPV商品化灭活苗0.5 mL,3组免疫PBS 0.5 mL。两侧腿部肌肉多点注射,间隔28 d后二次免疫。免疫前和一免后14,28,42 d心脏采血,收集血清。利用HI试验进行抗体水平的测定。
2 结果
2.1 VP2 PCR扩增以PPV病毒培养液为模板,P1、P2为引物,扩增获得条带为1 740 bp的目的片段,如图1所示,与预期结果相符。

M.DL2000 DNA Marker;1.VP2基因PCR产物
2.2 重组质粒的鉴定重组质粒pET28a-VP2-tf1和pCold Ⅰ-VP2分别经BamHⅠ和SalⅠ双酶切鉴定,分别获得1 740,5 369和4 407 bp的条带,如图2所示,表明重组质粒构建成功。
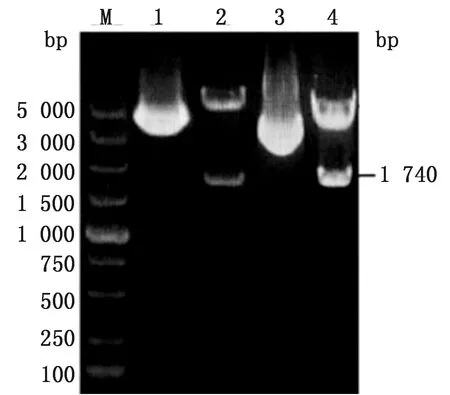
M.DL5000 DNA Marker;1.pET28a-VP2质粒对照;2.pET28a-VP2质粒双酶切;3.pCold Ⅰ-VP2质粒对照;4.pCold Ⅰ-VP2质粒双酶切
2.3 重组蛋白的表达重组质粒pET28a-VP2-tf16和pCold Ⅰ-VP2在D600≈0.5时,添加浓度为1.0 mmol/L IPTG,15℃诱导表达24 h。表达产物通过SDS-PAGE鉴定,都获得了相对分子质量大小约为66.4 kDa的目的蛋白,与预期大小一致,未诱导菌无特异性条带。超声破碎后结果显示,重组蛋白上清中有可溶性目的蛋白,部分以包涵体形式表达,如图3所示。

A.pET28a-VP2-tf16表达的SDS-PAGE结果(M.蛋白Marker;1.15℃加IPTG/L-阿拉伯糖诱导24 h全菌;2.15℃不加诱导剂24 h全菌;3.菌体破碎上清;4.菌体破碎沉淀);B.pCold Ⅰ-VP2表达的SDS-PAGE结果(M.蛋白Marker;1.15℃加IPTG诱导24 h全菌;2.15℃不加诱导剂24 h全菌;3.菌体破碎沉淀;4.菌体破碎上清)
2.4 重组蛋白表达及条件优化为筛选高效表达的重组菌株进行最佳诱导条件优化,结果显示,诱导温度分别设定为30,25,15℃时,诱导温度为25℃的重组蛋白pET28a-VP2-tf16的上清表达量最高,诱导温度为15℃的重组蛋白pCold Ⅰ-VP2的上清表达量最高(图4A);诱导时间分别设定为12,16,20,24 h时,当诱导时间为24 h,2个重组蛋白上清表达量均为最高(图4B);设定IPTG的浓度分别1.0,0.7,0.3,0.1 mmol/L,当IPTG浓度为1.0 mmol/L时,2个蛋白上清表达量均为最高(图4C)。由此得出重组蛋白pET28a-VP2-tf16可溶性目的蛋白最佳诱导表达条件为添加浓度1.0 mmol/L IPTG,25℃诱导表达24 h;重组蛋白pCold Ⅰ-VP2可溶性目的蛋白最佳诱导表达条件为添加浓度1.0 mmol/L IPTG,15℃诱导表达24 h。通过比较分析2个重组蛋白的表达效率,pCold Ⅰ-VP2重组蛋白在诱导表达时不需要额外添加L-阿拉伯糖,经SDS-PAGE灰度分析其可溶性目的蛋白表达量和纯度更高,在大批量表达过程中工艺相对简单,因此后续试验选择其进行鉴定及免疫效果评估。
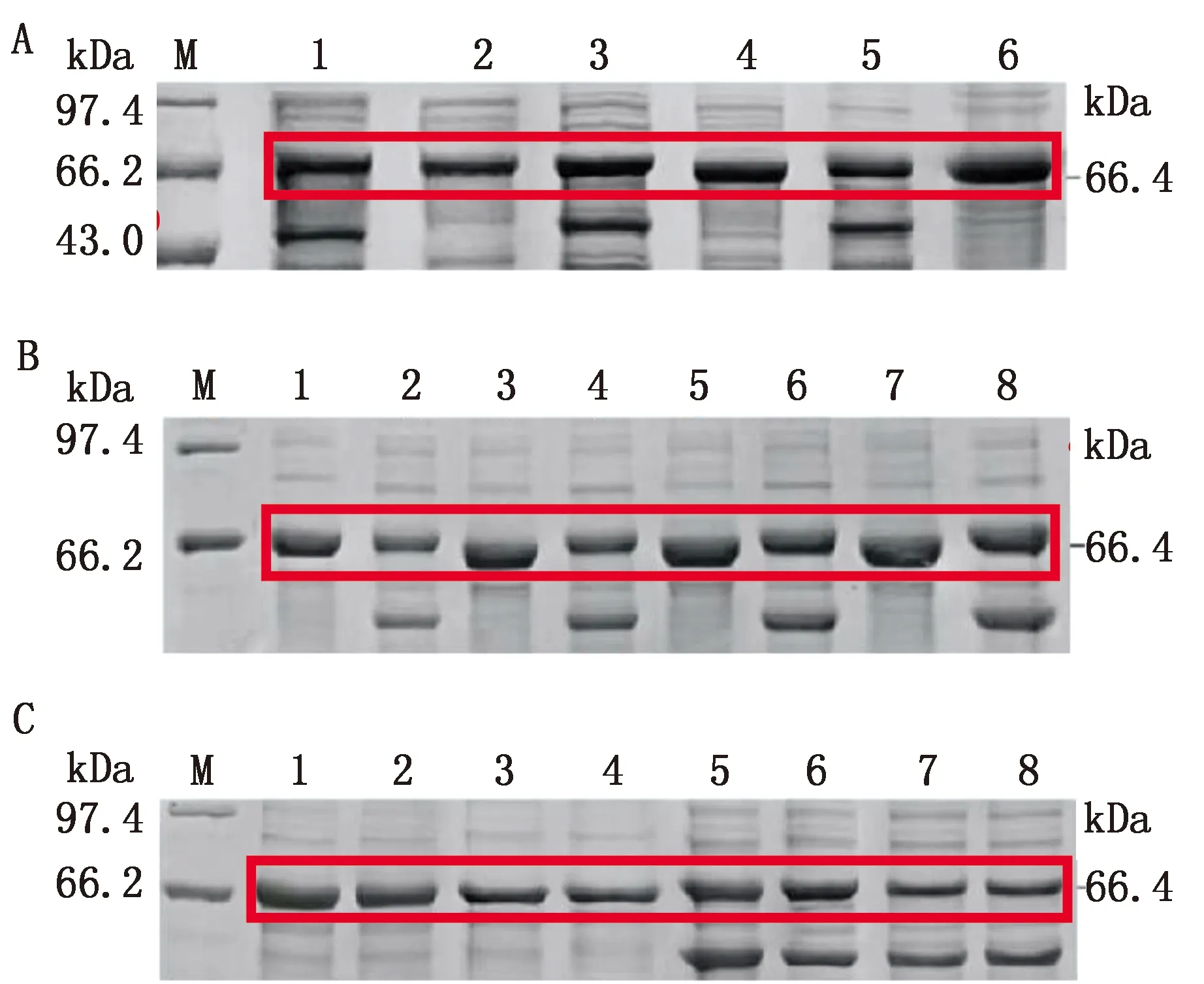
A.蛋白表达的最佳诱导温度SDS-PAGE结果(M.蛋白 Marker;1,3,5.分别为pET28a-VP2-tf16在30,25,15℃诱导表达后的超声破碎上清;2,4,6.分别为pCold Ⅰ-VP2在30,25,15℃诱导表达后的超声破碎上清);B.蛋白表达的最佳诱导时间SDS-PAGE结果(M.蛋白 Marker;1,3,5,7.分别为pCold Ⅰ-VP2诱导12,16,20,24 h诱导后的破碎上清;2,4,6,8.分别为pET28a-VP2-tf16诱导12,16,20,24 h诱导后的破碎上清);C.蛋白表达的最佳诱导剂浓度SDS-PAGE结果(M.蛋白 Marker;1~4.分别为pCold Ⅰ-VP2在IPTG终浓度为1.0,0.7,0.3,0.1 mmol/L诱导表达后的超声破碎上清;5~8.分别为pET28a-VP2-tf16在IPTG终浓度为1.0,0.7,0.3,0.1 mmol/L诱导表达后的超声破碎上清)
2.5 重组蛋白纯化及Western blot鉴定重组蛋白pCold Ⅰ-VP2诱导表达后经镍亲和层析柱纯化,SDS-PAGE结果表明(图5 A),洗脱重组蛋白条带清晰,无杂蛋白条带,纯化效果好。将重组蛋白电转印至PVDF膜上,用PPV特异性血清(图5B)进行蛋白免疫印迹鉴定,在约66.4 kDa处出现特异性的显色目的条带,空载体处无特异性条带。因此pCold Ⅰ-VP2重组蛋白能PPV特异性血清发生特异性反应,具有一定的免疫反应性。

A.重组蛋白纯化SDS-PAGE结果(M.蛋白Marker;1.pCold Ⅰ-VP2蛋白上样液;2.pCold Ⅰ-VP2蛋白洗脱液);B.Western blot鉴定结果(M.预染蛋白Marker;1.空载体;2.pCold Ⅰ-VP2表达蛋白)
2.6 重组蛋白电镜及血凝活性鉴定透射电镜结果显示pCold Ⅰ-VP2重组蛋白能自组装成VLPs,如图6 A所示。血凝试验显示重组蛋白与豚鼠红细胞反应具有血凝活性,血凝效价为1∶32,与PPV灭活病毒液效价相当,如图6 B所示。
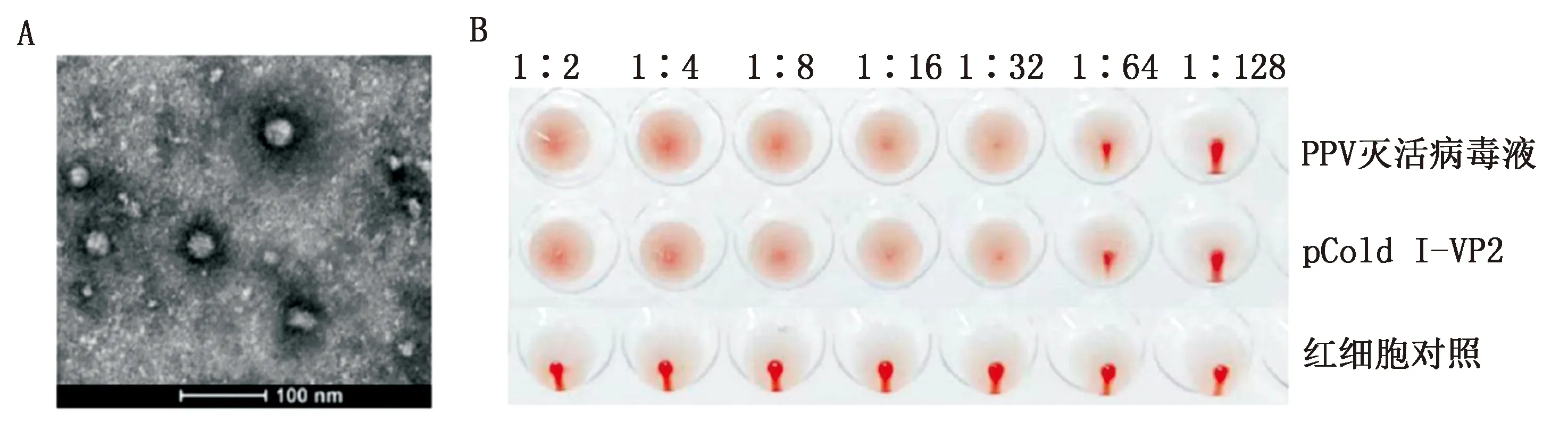
A.透射电镜结果;B.血凝试验结果
2.7 豚鼠免疫效果评估采用豚鼠红细胞血凝抑制试验检测其HI抗体水平,如图7所示,一免14 d时VP2亚单位疫苗组和商品化灭活苗组HI抗体均有上升,VP2亚单位疫苗组HI抗体效价为1∶256,商品化灭活苗组HI抗体效价为1∶256,符合PPV疫苗免疫合格标准。二免14 d时,2个疫苗免疫组的HI抗体效价整体上升,VP2亚单位疫苗组HI抗体效价达到1∶1 024,商品化灭活苗组HI抗体效价达到1∶1 024,空白组HI抗体检测为阴性(<1∶8),证明VP2亚单位疫苗组免疫豚鼠能产生高滴度的血凝抑制抗体,且与商品化灭活苗免疫效果相当。
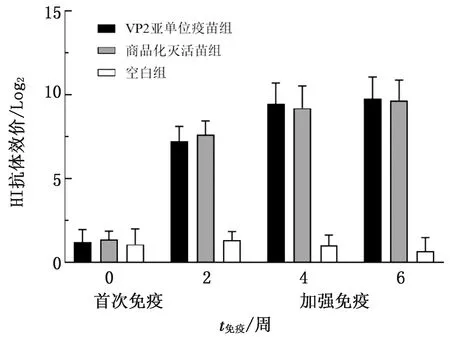
图7 豚鼠免疫血清HI抗体效价
3 讨论
国内从1983年首次发现PPV时起,各地区的猪群中都有PPI的发生,同时在散养户中长期广泛传播。PPV在外界环境中极其稳定,能够生存长达几个月之久,对大部分消毒剂都具有一定的抵抗力,生物安全风险较高[3]。目前国内外研究PPV疫苗种类有很多,基于基因工程亚单位疫苗有以下研究,1992年MARNITEZ等[7]利用重组杆状病毒表达载体pJVP10在sf9细胞中成功表达PPV主要衣壳蛋白VP2蛋白,通过硫酸铵沉淀细胞裂解物获得高纯度且能自组装成VLPs的重组蛋白,血凝滴度与PPV病毒相同甚至更高,同商品化灭活苗免疫猪所获得的抗体滴度相当。杆状病毒表达系统是真核蛋白表达最常用的系统之一,特别是需要翻译后修饰和以真核细胞环境进行适当折叠的蛋白质[12]。但由于生产重组蛋白基于杆状病毒系统在技术上要求很高,且需要使用无菌生物反应器,导致生产费用成本可能过高。司艳红等[13]2006年首次报道了VP2重组蛋白在大肠杆菌中的表达,利用PCR方法扩增出VP2完整的编码区并克隆至载体pET-32a中,诱导表达得到约为84 kDa的VP2蛋白,蛋白以包涵体形式表达,用His标签抗体和纯化后包涵体免疫家兔血清进行Western blot检测到特异性条带,证实表达蛋白具有一定的免疫原性。在2009年QI等[14]测序出VP2基因中含有大量稀有密码子,这增加了VP2表达的难度,研究选用大肠杆菌Rosetta作为表达菌株,能够提高外源基因的表达。结果也得出VP2重组蛋白能够以上清形式表达,且用PPV阳性血清对上清重组蛋白进行Western blot鉴定,具有一定的抗原性。可知外源基因在大肠杆菌中的表达因素也受到表达载体和宿主菌的影响。后JI等[15]、宋品等[16]使用分子伴侣质粒和小分子泛素相关修饰物标签与VP2蛋白共表达,获得了可自组装成VLPs的VP2重组蛋白。由此也证明基因融合标签和伴侣蛋白可被用来避免表达蛋白时的错误折叠,减少其降解和包涵体的形成,同时VLPs的组装效率与温度、pH值、离子强度等关系密切。
有研究报道,当大肠杆菌培养温度降到低温时会暂时停止生长,大部分的大肠杆菌蛋白质表达会下降,但是CpsA是一种冷休克基因,可以将蛋白质在低温时被特异性诱导表达,并且提高蛋白的溶解性和稳定性[17]。因此本研究利用原核表达载体pET28a、分子伴侣质粒pTF16与PPV VP2基因构建重组质粒pET28a-VP2-tf16;冷休克表达载体pCold Ⅰ与PPV VP2基因重组构建重组质粒pCold Ⅰ-VP2,2个重组表达载体分别转至BL21(DE3)进行诱导表达,蛋白超声破碎后上清中获得可溶性目的蛋白。通过设置不同诱导时间、温度和诱导剂浓度,确定了重组蛋白pET28a-VP2-tf16在添加浓度1.0 mmol/L IPTG,25℃诱导表达24 h可获得较高可溶性目的蛋白;重组蛋白pCold Ⅰ-VP2在添加浓度1.0 mmol/L IPTG,15℃诱导表达24 h可获得较高可溶性目的蛋白。通过比较分析2个重组蛋白的表达效率,pCold Ⅰ-VP2重组蛋白在诱导表达时不需要额外添加L-阿拉伯糖,经SDS-PAGE灰度分析其可溶性目的蛋白表达量更高且杂蛋白较少,在大批量表达过程中工艺相对简单。最终确定使用冷休克表达系统用于后续研究。将pCold Ⅰ-VP2重组蛋白进行镍亲和层析柱纯化得到高纯度目的蛋白,用Western blot鉴定蛋白能显示出特异性目的条带,具有一定的免疫反应性,其在电镜下观察能自组装成VLPs,能特异性凝集豚鼠红细胞,具有血凝活性。使用206 VG佐剂与重组蛋白液等体积混合乳化30~50 min,形成稳定的水包油包水剂型。把制备好的VP2亚单位疫苗(含重组蛋白100 μg)接种豚鼠,在一免14 d时测得血凝抑制效价达到1∶256,二免14 d时效价达到1∶1 024,与商品化灭活苗组的效价相当。证明本实验室研制的VP2亚单位疫苗免疫豚鼠后能产生高滴度的血凝抑制抗体效价,为下一步研究新型安全高效的PPV VP2亚单位疫苗奠定了基础。
