马方综合征患者术后复发巨大胸腹主动脉瘤破裂伴支架内漏的治疗策略
2023-09-16吴茂洁赵纪春
吴茂洁,赵纪春,郭 强,袁 丁
1 四川大学华西医院骨科 / 四川大学华西护理学院,四川 成都 610041
2 四川大学华西医院普外科血管外科病房,四川 成都 610041
马方综合征(Marfan syndrome,MFS)是一种累及全身多处结缔组织的遗传疾病,通常为常染色体显性遗传病,发病率约为1/5000[1]。MFS指作为细胞外基质微纤维基本组成部分和维持结缔组织弹性成分所必需的纤维蛋白原1(fibrillin-1,FBN1)发生突变,从而累及全身多个器官系统的结缔组织[1]。尽管该病累及全身多个系统,但患者发病和死亡的主要危险因素还是归因于心血管的并发症,如心脏瓣膜疾病、主动脉夹层等[2]。MFS伴腹主动脉瘤(abdominal aortic aneurysm,AAA)的病例较少,但通常起病急、病死率高[3],首选的治疗方式是手术治疗。四川大学华西医院成功治疗了1例马方综合征伴AAA腔内修复术(endovascular aneurysm repair,EVAR)后复发巨大胸腹主动脉瘤破裂伴支架内漏的患者,现报道如下。
1 病历资料
患者男性,34岁,既往有MFS病史。2014年3月因腹部包块于当地医院就诊,检查发现AAA,累及主动脉瓣,主动脉直径5 cm。根据修订版Ghent标准[4],MFS系统评分为10分,临床表现为手腕和拇指征、胸部畸形、足部畸形、二尖瓣脱垂、面部特征和肘部伸展减少。询问病史,患者无主动脉夹层家族史及吸烟史,但检查发现患者与其母亲的FBN1基因均发生突变。于当地医院行主动脉瓣置换术及腹主动脉血管内动脉瘤修复术,手术顺利,患者术后每年复查腹主动脉超声或者计算机断层扫描(computed tomography,CT),截至2018年4月未见腹动脉瘤复发。
2021年5月,患者因突发腹痛加重急诊入院。入院前3个月,患者出现腹痛及腹部包块,并自感腹部包块进行性增大,伴腹胀、恶心呕吐、食欲不振、乏力、大小便减少及体重下降10 kg,但未进行检查及治疗。入院查体:体温36.5 ℃,脉搏112次/分钟,呼吸20次/分钟,血压160/90 mmHg(1 mmHg=0.133 kPa),身高173 cm,体重50 kg;体型细长,四肢及手足细长伴蜘蛛指(趾),2001年3月因MFS 左眼晶状体脱位导致左眼失明;下腹部可扪及搏动性包块,边界不清,无明显压痛,质稍硬。入院辅助检查:主动脉计算机断层扫描血管造影(computed tomography angiography,CTA)提示原支架近端胸腹主动脉明显扩张,最大横截面积约为12.5 cm×8.9 cm;双侧髂总动脉扩张,右侧髂总动脉支架远端Ⅰb 型内漏,右髂总动脉瘤大小约为20 cm×12 cm,显示胸腹主动脉瘤(thoracoabdominal aortic aneurysm,TAAA)破裂的征象(图1A~1C)。诊断为MFS 伴AAA 术后Ⅰb 型内漏,主动脉瓣置换术后。
积极完善手术相关准备工作后急诊行经胸腹联合切口腹主动脉支架取出术、胸腹主动脉瘤切除术、人工血管置换术。术中于瘤体左前壁切开动脉瘤,可见动脉壁明显变薄,瘤体内的支架存在较多附壁血栓(图2)。选用双侧四分叉的GORE人工血管,采用3-0 Prolene线,近端与正常降主动脉联合腹腔干及肠系膜上动脉行楔形端端吻合,中间与双侧肾动脉行端端吻合,远端成形后与髂总动脉行端端吻合。吻合后远端腹主动脉、腹腔干、肠系膜上动脉及双肾动脉搏动良好,修补切开的左侧膈肌及后腹膜,安置1根胸腔引流管。整个手术过程顺利,术后胸腹主动脉CTA提示人工血管通畅,吻合口无内漏。术后转入重症监护室观察、治疗,予以镇静、镇痛、输注红细胞悬液、输注新鲜冰冻血浆、抗感染、抗凝及维持电解质平衡等对症支持治疗。患者拔除气管插管,复查动脉血气无明显异常,术后第4天转回血管外科病房继续予以抗感染、抗凝、扩血管等处理,病情稳定后出院。术后病理:动脉壁标本显示中膜变性,平滑肌细胞核和弹性纤维丢失,伴大量炎性细胞浸润(图3)。出院后1年门诊随访,患者病情稳定,无腹痛、腹胀等不适,复查胸腹主动脉CTA见人工血管的管腔通畅,未见新发动脉瘤、动脉夹层及吻合口漏(图1D)。
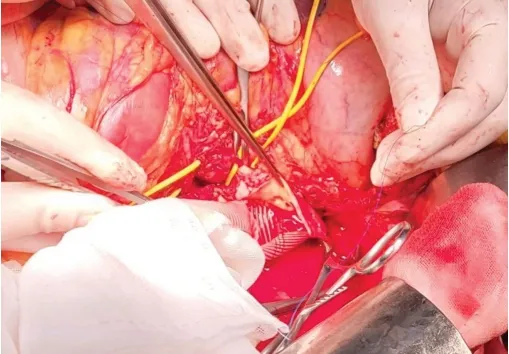
图2 手术过程

图3 术后病理图
2 讨论
MFS患者的平均生存期较健康人群明显缩短,超过90%的MFS患者的死亡是由伴发的主动脉瓣膜疾病、主动脉夹层、动脉瘤破裂而引起的[5],因此,心血管表现被认为是导致MFS患者生存期缩短的最主要原因[6],其病理机制是由于MFS患者的心血管受累,主动脉中层出现病变,弹力纤维断裂消失,瘢痕形成,平滑肌细胞过度增生,引起主动脉管壁脆性增加,从而导致动脉瘤形成[7-8]。
MFS患者伴大血管受累多发生于胸主动脉,尤其是升主动脉瘤,并伴有严重的主动脉瓣关闭不全,而单纯累及腹主动脉的病例少见[9]。研究发现,MFS主动脉受累行初次手术后容易再次出现主动脉其他部位夹层或动脉瘤,从而需要再次手术[10-11],因此,Lu等[12]的研究建议每半年进行1次影像学检查,从而监测主动脉的变化。本例患者在第一次手术后的5年内,每年都进行超声或者CT检查,未见动脉瘤复发。在未复查的近两年内,患者因动脉瘤复发而再次入院进行手术。Finkbohner等[13]的研究表明,在192例MFS 合并主动脉疾病患者中,70.3%(135/192)的患者术后再次发生主动脉夹层或者主动脉瘤,而其中的95%(128/135)累及主动脉原发病变的其他部位。本病例的病变最初也是累及了胸主动脉、主动脉瓣等好发部位,符合MFS患者常见心血管受累部位的情况,但同时累及了腹主动脉等少见的部位,而再次发病的部位是原AAA 手术部位,较为罕见。分析原因可能是由于MFS患者的主动脉壁薄弱,即使安置了血管支架,支架缝隙的血管壁仍然不能维持正常血管壁的张力,尤其该患者初次手术后血压长期偏高,更容易导致血管壁支撑不足,导致动脉瘤形成,这与董智慧等[14]的研究结果相似。此外,支架与动脉壁未完全贴合,血液经过动脉壁与支架之间的缝隙到达动脉壁的薄弱处,导致局部压力升高[15],加上MFS患者本身的主动脉壁薄弱,从而发生术后内漏。
既往研究表明,MFS合并AAA 患者经非手术治疗后的预后差,病死率高[16-17],及时进行手术治疗可有效改善患者的预后[18],因此,目前对于MFS合并AAA 的治疗以手术治疗为主。EVAR因具有创伤小、易于操作、术后恢复快、住院时间短、术后早期并发症发生率低等优点[19]已经被公认为是治疗肾下AAA的标准手术方法[20]。在2019年欧洲血管外科学会发布的相关指南中,EVAR已被推荐作为解剖条件合适的破裂AAA(ruptured abdominal aortic aneurysm,RAAA)患者的首选治疗方式[21]。Conway等[22]的研究发现,MFS患者接受了EVAR治疗,平均2年的随访期间内没有患者再次手术或者死亡,因此,EVAR在技术上是可行的,但需要长期的随访加以验证。邱家明[15]的研究发现,采用EVAR治疗AAA的术后内漏发生率为10%~44%,且Ⅰ型内漏的发生率为9.0%~12.1%。MFS合并AAA患者的主动脉壁薄弱,EVAR手术过程中常规进行腔内导丝、导管操作均可能成为诱发病变再次发生的重要因素[14]。伦语等[8]的研究表明,MFS 合并AAA 患者的动脉壁比其他AAA 患者的动脉壁更薄弱,应慎重进行腔内治疗,主张以传统的手术治疗为主,即动脉瘤切除术、人工血管移植术。吉志敏等[23]的研究认为,人工血管不仅可以为大直径的主动脉支架提供更牢固的远端锚定区,还可以减少与锚定区相关的并发症的发生。
本例患者因初次EVAR术后出现内漏,胸腹主动脉和双侧髂总动脉明显扩张,动脉壁非常薄弱,有随时破裂的迹象,再次EVAR手术容易穿破菲薄的动脉壁而导致动脉瘤破裂出血;另外,由于动脉壁薄弱,术中难以锚定动脉两端,再次发生内漏的风险较大。此外,本例患者相对年轻,一般情况良好,故选择了开放手术,术中切除了AAA并进行人工血管置换术。术后2周,患者状态良好,正常出院。
综上所述,对于MFS合并AAA 患者,开放手术和EVAR均是可行的,手术方式的选择需要根据疾病严重程度、既往治疗方式、合并症及身体健康状况综合考虑。同时,无论是否接受手术治疗,确诊后均应进行密切的随访,通过每半年进行1次影像学检查的方式监测动脉的变化,并根据随访情况及时干预,延长患者的生存期,改善患者的生存状态。
