花椒及花椒制品中羟基-α-山椒素检测方法
2022-10-21马伟钟慈平何成军温泉杜钢
马伟,钟慈平,何成军,温泉,杜钢
四川省食品检验研究院(成都 611731)
花椒为芸香科植物青椒(Zanthoxylum schinifoliumSieb.et Zucc)或花椒(Zanthoxylum bungeanumMaxim)除去种子和杂质后的干燥成熟果皮。性辛,温。归脾、胃、肾经。温中止痛,杀虫止痒。用于脘腹冷痛,呕吐泄泻,虫积腹痛;外治湿疹[1]。花椒在我国的应用已有两千余年的历史,其广泛用于调味料、香料及中药,被誉为我国传统的“八大调味品”之一[2-3]。花椒在全世界有250多种,亚洲是花椒主产区,中国约有45种,13个变种[4]。花椒在我国栽培历史悠久,范围广产量大,主要分布在陕西、四川、甘肃、云南等地,总产量居世界第一[5]。四川作为花椒的主要产区之一,研究开发、转化推广一批新品种、新技术、新产品、新模式,支撑引领全省花椒产业的创新发展[5]。
花椒的化学成分较复杂,包括生物碱、挥发油、脂肪酸、香豆素、酰胺、黄酮苷、甾醇和三萜类等,花椒中富含的挥发油是香气的主要来源[7],酰胺类物质是花椒呈麻味的主要成分,大多为链状不饱和脂肪酰胺类物质,其中以羟基-山椒素为代表,具有强烈的刺激性,是衡量花椒品质的重要指标之一[8-9]。关于麻味物质,相关研究从花椒果皮中分离出超过25种花椒麻素[10-13]。较多的有羟基-α-山椒素、羟基-β-山椒素、羟基-γ-山椒素和羟基-ε-山椒素等,其中以花椒中羟基-α-山椒素含量为最高[14-16]。羟基-α-山椒素首次由Yasuda等[17]从日本花椒中分离,是花椒果皮中最早分离出来的花椒麻素和食物中最主要诱发独特刺痛感(麻味)的化合物。
随着国内花椒产业的迅猛发展,针对花椒品质的等级分类没有形成统一量化的标准,严重制约了整个产业健康、高质的发展,而针对麻味物质作为衡量花椒品质的重要指标,至今未出台相关的检测标准。试验通过对花椒中麻味物质含量最高、最主要诱发麻味的羟基-α-山椒素检测方法进行研究,旨在为后期花椒麻素相关标准的制定提供参考依据。
1 材料与方法
1.1 材料与试剂
花椒、花椒粉、花椒油、花椒提取物(产地:四川);羟基-α-山椒素(纯度98.0%,成都普思生物科技股份有限公司);甲醇、无水乙醇、乙腈、乙酸乙酯(均为分析纯)。
1.2 仪器与设备
紫外-可见分光光度计(EVOLUTION 201,Thermo);电子天平(ME203,METTLER TOLEDO);涡旋仪(Multi Reax,Heidolph);超声仪(IDH30,IRM);离心机(ROTANTA 460R,Hettich)。
1.3 方法
1.3.1 标准品的配制
羟基-α-山椒素储备液:准确称取29.71 mg羟基-α-山椒素于5 mL棕色容量瓶中,用甲醇溶解并定容至刻度,摇匀,即得羟基-α-山椒素储备液(质量浓度5.823 2 mg/mL,有效期3个月)。
羟基-α-山椒素:准确吸取100 μL上述储备溶液置5 mL容量瓶中,用乙醇定容至刻度,摇匀,即得羟基-α-山椒素标准工作液(质量浓度116.464 μg/mL,有效期1个月)。
1.3.2 标准曲线的绘制
分别准确吸取0.05,0.10,0.20,0.30,0.40和0.50 mL上述标准工作液,置于10 mL容量瓶中,用乙醇稀释至刻度,摇匀,羟基-α-山椒素系列标准溶液质量浓度(临用现配)分别为0.582 3,1.164 6,2.329 3,3.493 9,4.658 6和5.823 2 μg/mL,用分光光度计在268 nm处,以试剂空白为参比,在1 cm比色皿测定吸光度,以羟基-α-山椒素的量(μg/mL)为横坐标,吸光度(A)为纵坐标,绘制标准曲线。
1.3.3 供试样制备方法
1.3.3.1 提取试剂选择
分别准确称取0.3 g花椒、花椒粉、花椒油和花椒提取物,置于150 mL三角瓶中,分别准确加入50 mL甲醇、乙腈、无水乙醇、乙酸乙酯、水,超声提取15 min,放冷后取适量提取液于4 500 r/min离心5 min。准确吸取0.1 mL花椒和花椒粉提取液、0.5 mL花椒油提取液、0.025 mL花椒提取物提取液分别置于25 mL容量瓶中,加相应提取试剂定容至刻度,摇匀,即得待测溶液。
1.3.3.2 提取试剂体积选择
分别准确称取0.3 g花椒、花椒粉、花椒油和花椒提取物,置于150 mL三角瓶中,分别准确加入10,25,50和100 mL无水乙醇,超声提取15 min,放冷后取适量提取液以4 500 r/min离心5 min。分别准确吸取0.02,0.05,0.10和0.20 mL花椒和花椒粉提取液,0.10,0.25,0.50和1.00 mL花椒油提取液,0.02,0.05,0.10和0.20 mL花椒提取物提取液,分别置于25mL(花椒、花椒粉、花椒油提取液)和100 mL(花椒提取物提取液)容量瓶中,加无水乙醇定容至刻度,摇匀,即得待测溶液。
1.3.3.3 提取时间选择
分别准确称取0.3 g花椒、花椒粉、花椒油和花椒提取物,置于150 mL三角瓶中,各准确加入50 mL无水乙醇,分别超声提取5,10,15,30和60 min,放冷后取适量提取液以4 500 r/min离心5 min。分别准确吸取0.1 mL花椒和花椒粉提取液、0.5 mL花椒油提取液、0.025 mL花椒提取物提取液各置于25 mL容量瓶中,加无水乙醇定容至刻度,摇匀,即得待测溶液。
1.3.3.4 提取方式选择
分别准确称取0.3 g花椒、花椒粉、花椒油和花椒提取物,置于150 mL三角瓶中,各准确加入50 mL无水乙醇,分别超声提取15 min、涡旋提取15 min、常温浸提24 h,放冷后取适量提取液以4 500 r/min离心5 min。分别准确吸取0.1 mL花椒和花椒粉提取液、0.5 mL花椒油提取液、0.025 mL花椒提取物提取液各置于25 mL容量瓶中,加无水乙醇定容至刻度,摇匀,即得待测溶液。
2 结果与分析
2.1 检测波长的选择
配制适当浓度羟基-α-山椒素对照品,与处理后样品分别放入紫外-分光光度计中进行全波长扫描,扫描结果见图1~图2。结果发现其最大吸收峰都为268±1 nm,所以选择268 nm为测定波长。

图1 羟基-α-山椒素对照品扫描图谱

图2 花椒样品扫描图谱
2.2 提取试剂的选择
甲醇、乙腈、无水乙醇、乙酸乙酯、水5种试剂提取羟基-α-山椒素结果见图3。结果发现提取试剂甲醇、乙腈、乙酸乙酯和无水乙醇在4品类样品花椒、花椒油、花椒粉、花椒提取物中提取率无显著性差异,水提取率最低,考虑成本及安全性,建议采用无水乙醇为提取试剂。
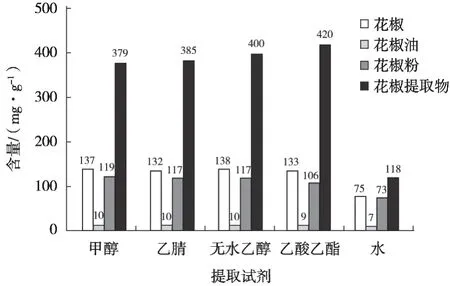
图3 5种提取试剂提取羟基-α-山椒素结果
2.3 提取体积的选择
不同提取试剂体积提取羟基-α-山椒素结果见图4~图7。结果发现提取溶剂分别为10,25,50和100 mL时,提取溶剂量对提取率无明显差异,100 mL提取率基本达到最大。由于花椒制品品类较多,为保证麻味物质能完全提取,建议提取试剂100 mL。

图4 从花椒中用不同无水乙醇体积提取羟基-α-山椒素结果
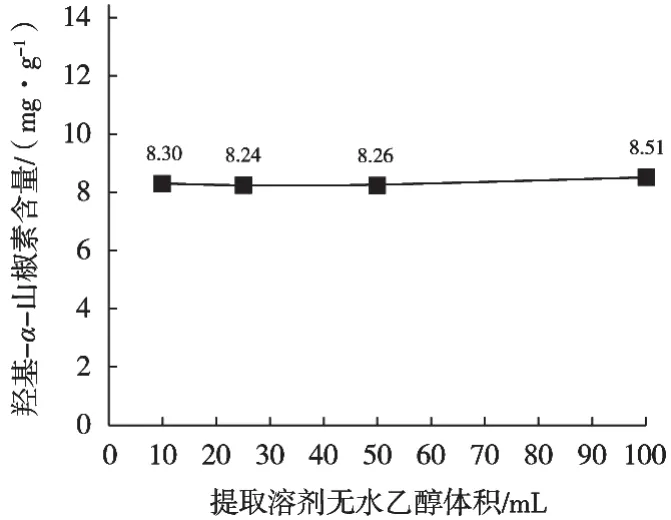
图5 从花椒油中用不同无水乙醇体积提取羟基-α-山椒素结果
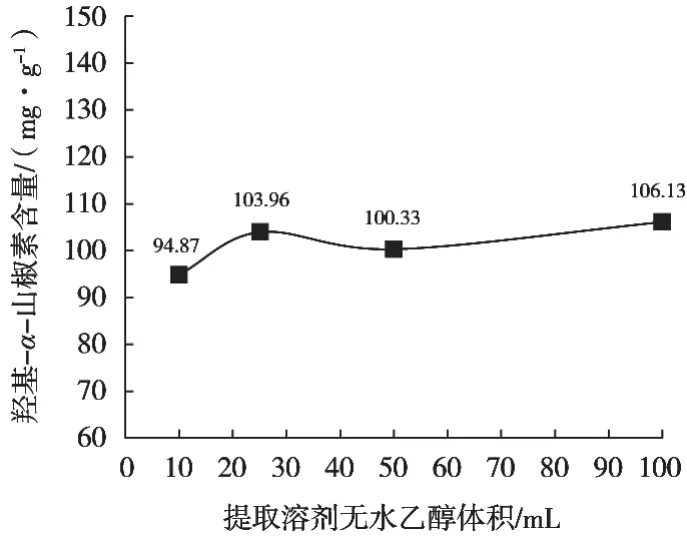
图6 从花椒粉中用不同无水乙醇体积提取羟基-α-山椒素结果
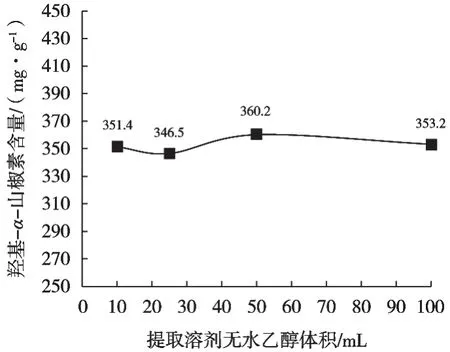
图7 从花椒提取物中用不同无水乙醇体积提取羟基-α-山椒素结果
2.4 提取时间的选择
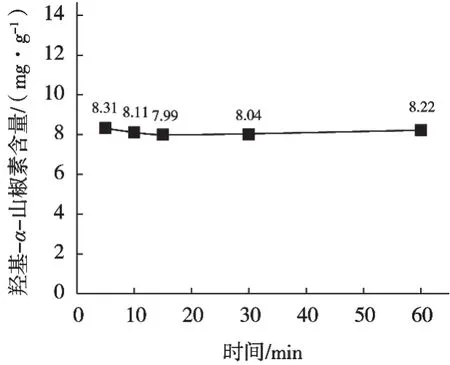
图9 从花椒油中用不同提取时间提取羟基-α-山椒素结果
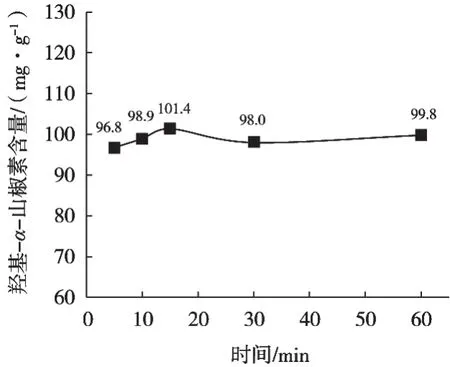
图10 从花椒粉中用不同提取时间提取羟基-α-山椒素结果
不同提取时间羟基-α-山椒素结果见图8~图11。结果发现提取时间分别为5,10,15,30和60 min时,花椒、花椒油、花椒粉、花椒提取物提取率均无明显差异,15 min提取率基本达到最大。从提取率及检测效率考虑,建议提取时间15 min。

图8 从花椒中用不同提取时间提取羟基-α-山椒素结果

图11 从花椒提取物中用不同提取时间提取羟基-α-山椒素结果
2.5 提取方式的选择
不同方式提取羟基-α-山椒素结果见图12。结果发现提取方式分别为超声提取、涡旋提取、浸泡提取时,花椒、花椒油、花椒粉、花椒提取物提取率基本相同,从检测方便性及检测效率出发考虑,建议采用超声的提取方式。

图12 3种提取方式提取羟基-α-山椒素结果
2.6 标准曲线方程
配制0.582 3~5.823 2 μg/mL质量浓度的标准系列溶液(现用现配),用分光光度计在268 nm处,以试剂空白为参比,测定吸光度,以羟基-α-山椒素的质量浓度(μg/mL)为横坐标,吸光度(A)为纵坐标,绘制标准曲线,结果如图13所示。结果表明在现有浓度范围内线性回归方程为Y=0.165 9X-0.001,r=0.999 9,线性良好。
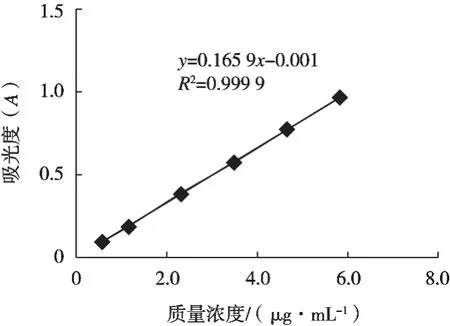
图13 羟基-α-山椒素标准曲线
2.7 回收率考察
采用优化后的条件进行方法回收率考察。由于样品的稀释倍数较大,采取增大称样量即测得已知样品含量后加入样品的加标方式考察该方法的可行性,结果见表1。结果表明平均回收率在96.8%~97.8%,SRSD<4%。
2.8 方法精密度考察
准确取花椒、花椒粉、花椒油、花椒提取物各0.3 g,各6份,置于锥形瓶中,按照优化好的方法条件进行提取和稀释,供紫外分光光度计测定,计算方法精密度,结果见表2。结果表明SRSD<3%,方法精密度良好。
2.9 方法稳定性考察
取质量浓度为2.3 μg/mL的对照品溶液和质量浓度约为2.2 μg/mL的样品溶液,分别于0,2,4,18,20和24 h在紫外分光光度计268 nm处测定吸光度,结果见表3。结果表明,对照品溶液和样品溶液在24 h内稳定。
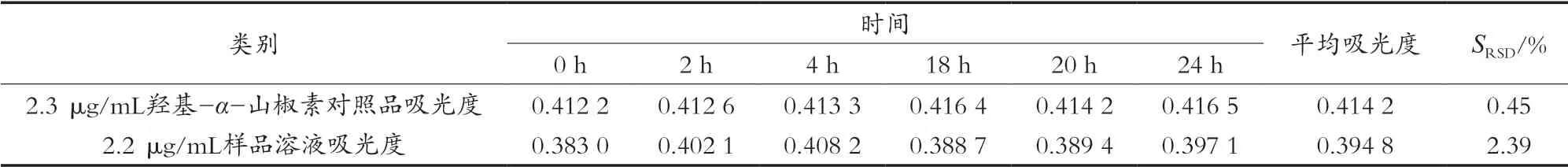
表3 对照品溶液和样品溶液紫外稳定性结果
2.10 不同产地花椒中羟基-α-山椒素成分分析
通过表4数据比对可以得出四川、甘肃和陕西3地红花椒中羟基-α-山椒素含量以四川最高101.22 mg/g,陕西最低57.76 mg/g,竹叶花椒中羟基-α-山椒素含量相比较于3地红花椒和青花椒含量最低,为46.88 mg/g。

表4 不同产地花椒样品中羟基-α-山椒素含量比对
3 结论
通过对花椒及花椒制品中羟基-α-山椒素检测方法进行研究,通过全波长扫描确定该方法的检测波长为268 nm,最终确定该方法供试品的制备以乙醇为提取试剂,提取溶剂体积100 mL,提取时间15 min,提取方式采用超声,该方法得出在质量浓度范围0.582 3~5.823 2 μg/mL时线性回归方程Y=0.165 9X-0.001,r=0.999 9,线性良好,方法精密度良好,SRSD<3%,平均加标回收率在96.8%~97.8%之间,该方法对照品溶液和样品溶液在24 h内检测稳定性良好,SRSD<3%。该方法通过对关键参数的研究,提供一种简便、快速、准确测定花椒及花椒制品中羟基-α-山椒素的检测方法,为后期麻味物质检测相关标准的出台提供参考依据。该方法可对全国范围内的花椒及其制品中羟基-α-山椒素的含量进行研究,以考察全国不同产区、品种花椒麻味物质含量分布,为花椒产业的发展奠定良性基础。
