酶法葡萄糖异构果糖的工艺
2022-10-21胡瑞云杨柳王智能杨婷尚试雄沈石妍
胡瑞云,杨柳,王智能,杨婷,尚试雄,沈石妍
云南省农业科学院甘蔗研究所,云南省甘蔗遗传改良重点实验室(开远 661699)
我国是一个人口大国,食糖需求较大,2017—2018年榨季全国共生产食糖1 031.0万 t,其中,产甘蔗糖916.07万 t,产甜菜糖114.97万 t[1]。2021年1—11月份我国成品糖产量为1 165.7万 t,较上年同期增长3%(该统计口径为我国已有甜菜制糖及甘蔗制糖、国产糖以及进口加工糖数据)[2]。2019年1—11月份中国累计进口糖527万 t,意味着2021年我国进口糖数量再创历史新高[3]。近年来果葡糖浆替代蔗糖应用于食品中的优势已逐步显露出来,由于果糖的代谢过程不依赖胰岛素,易被人体吸收利用,更适用于糖尿病和肝病患者的能量和体液的供应;果糖具有促进微量元素吸收、保护肝细胞、辅助治疗酒精中毒、预防龋齿和强化耐力等保健功能[4-5];结晶果糖由于纯度高、性质稳定的特点逐渐在食品、医药等行业得到广泛应用,市场需求量不断扩大[6-7]。随着原料玉米市场化以后,原料成本的降低使淀粉糖在多领域的替代上有增加的趋势,2017和2018年淀粉糖产量分别为1 450.8万t和1 632.7万 t,保持15%和12.5%的增长速度,2019年和2020年增速有所放缓,平均在6%左右的年增速[8]。随着市场需求增加,在国家农业政策导向及生产补贴等多项利好因素刺激下,淀粉及深加工行业整体水平都有所提升,2020年中国淀粉深加工产品总产量增加到1 874.2万 t,同比增长7.9%,其中:2020年中国液体淀粉糖产量增加到1 025.4万 t,同比增长4.1%;固体淀粉糖(结晶葡萄糖)产量增加到536.2万 t[8],以淀粉糖(葡萄糖粉)为原料生产结晶果糖可满足逐步扩大的果糖需求市场。
果糖的生产方法通常可用淀粉液化后经糖化酶转化为葡萄糖,经葡萄糖异构酶异构得到果葡糖浆,果葡糖浆分离结晶得到果糖;也可直接选用葡萄糖产品异构生成果葡糖浆,果葡糖浆分离结晶得到果糖;或者选用蔗糖水解生成果葡糖浆,果葡糖浆分离结晶得到果糖[9]。试验针对葡萄糖的异构工艺进行正交试验,并对异构过程进行实验室的模拟扩大试验,整个连续异构过程共异构20 kg葡萄糖液,同时该试验的设计过程可与蔗糖生产结晶果糖的试验[10]作为实验室小型生产果糖的生产工艺,构建一个完整的果糖生产架构体系。
1 材料与方法
1.1 主要材料与试剂
无水葡萄糖、D-果糖、蔗糖(标准品,上海源叶生物科技有限公司);乙腈(色谱纯,默克股份公司);无水乙醇(色谱纯,天津市致远化学试剂有限公司);葡萄糖异构酶(诺维信有限公司)。
1.2 主要仪器与设备
Φ40×400 mm夹套保温玻璃砂芯层析柱(康玻实验设备有限公司);WYA-2 S数字阿贝折射仪(上海仪电物理光学仪器有限公司);DDSJ-308 A电导仪(上海仪电物理光学仪器有限公司);e 2960液相色谱(美国Waters);BSA 224 S电子分析天平[赛多利斯科学仪器(北京)有限公司];UV-5800 PC紫外分光光度计(上海元析仪器有限公司);ZD-3 A自动电位测定仪(上海本昌科学仪器有限公司);BT 100 SV 2-CE蠕动泵(保定雷弗流体科技有限公司)。
1.3 试验方法
1.3.1 固定化葡萄糖异构酶活力的测定
酶活力的定义:在pH 7.5,温度70 ℃条件下,1 g异构酶1 h所生成1 mg的果糖定义为1个酶活力单位(U/g)。测定方法[11]:称取0.2 g固定化酶,加入1.5 mL pH 7.5磷酸缓冲液、0.5 mL 61 g/L硫酸镁溶液和1.6 mL 70 g/L葡萄糖溶液,用纯水定容至5 mL,于70 ℃反应1 h,加入5 mL 210 mL/L高氯酸溶液终止反应,测定其中的果糖含量,计算酶活力。
1.3.2 比对pH、Mg2+、Go2+对葡萄糖异构酶的影响
分别称取55.0 g无水葡萄糖,用纯水定容至100 g配制成4组50 °Bx的葡萄糖液,按表1调节4组样品糖液,异构前各加入10 g葡萄糖异构酶,控制糖液异构温度65 ℃,并时常搅拌,每30 min取样测定异构糖液中的果糖含量,考察pH、Mg2+、Go2+对葡萄糖异构酶的影响。
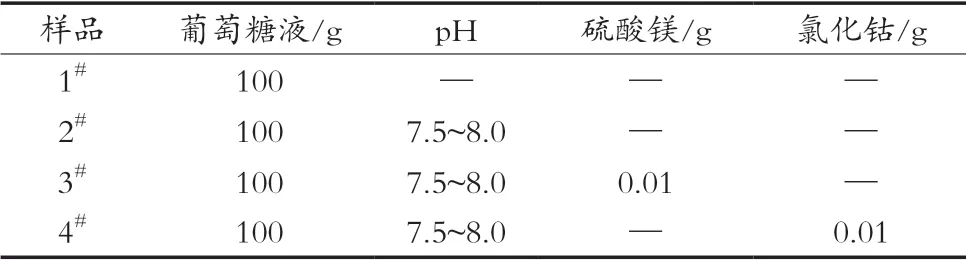
表1 葡萄糖糖液样品表
1.3.3 葡萄糖异构正交试验
分别配制100 g葡萄糖液,调节糖液pH在7.4~8.0以内,MgSO4·7H2O添加量0.01%,加入10 g葡萄糖异构酶,按照试验设定的异构温度、浓度、时间于水浴锅中进行三因素四水平正交试验(见表2),以异构生成的果糖得率为判别依据,确定葡萄糖异构的最优条件。
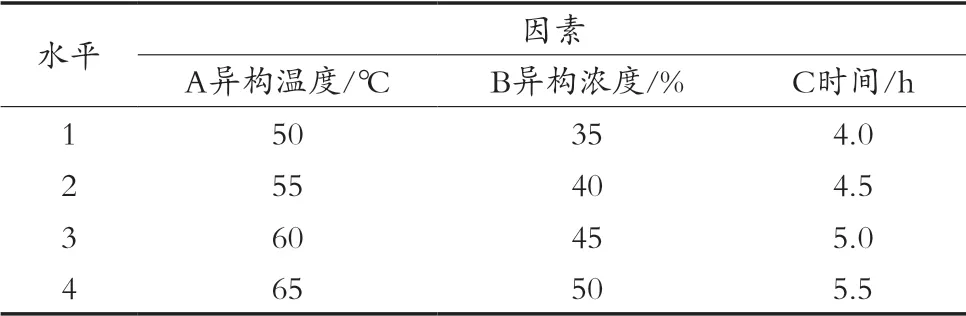
表2 葡萄糖异构正交试验设计表
1.3.4 葡萄糖的连续异构扩大试验
将固定化葡萄糖异构酶分为每组100 g,用纯水浸湿后分装入串联的5组φ40×400 mm夹套玻璃层析柱中备用。配制适量50%(w/w)葡萄糖液,添加0.01%的MgSO4·7H2O,调节糖液pH 7.4~8.0,备用。启动蠕动泵将65 ℃的热水依次通过5组异构柱预热柱内异构酶,保持异构柱夹套水温65 ℃,将预热至65 ℃的葡萄糖液依次流经各异构柱,待末组有糖液流出时,每500 mL收集样液1组,测定果糖异构得率、pH、电导率、色值等指标,比对不同流速3 BV/h(25 mL/min)和4.2 BV/h(35 mL/min)的葡萄糖异构率。
糖液连续异构速度的定义:以1 g异构酶1 h所生成异构糖液的体积为1个BV单位,即BV/h。
1.3.5 糖液固形物含量、电导率、色值的测定
方法参照制糖分析相关方法检测[12],果糖、葡萄糖、蔗糖含量的检测方法采用高效液相色谱法检测[13],各指标按式(1)和(2)计算。
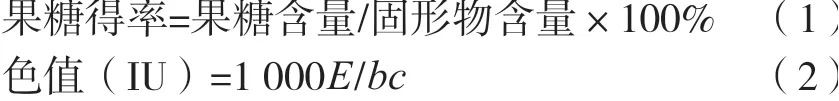
式中:E为试样在420 nm的吸光度;b为比色皿厚度,cm;c为样液浓度(由改正至20 ℃的折光锤度查表求得),g/mL。
2 结果与分析
2.1 葡萄糖异构酶活力测定结果
酶活力测定结果为483 U/g。按实测酶活指标计算,设定在异构酶10 g、pH 7.5、温度50~65 ℃条件下,异构100 g 50%(w/w)葡萄糖液至少需5.18 h。
2.2 pH、Mg2+、Go2+对葡萄糖异构酶的影响
2.2.1 pH对葡萄糖异构酶的影响
从图1和表3数据看出,在未调节pH和调节pH的葡萄糖液中,果糖异构得率在0.5 h分别上升至13.78%和10.94%,在4.5 h上升至48.26%和47.11%,5.5 h后异构趋于最大值。整个异构过程显示在未调节pH和调节pH的葡萄糖液中异构酶均有酶活力,未调节pH的糖液酶活力略高于微碱性条件下的酶活力。
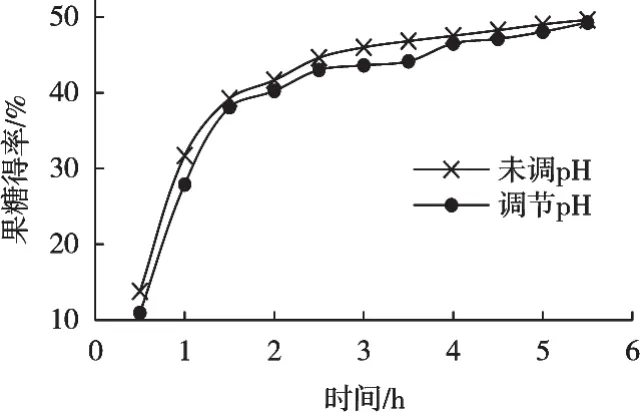
图1 pH对葡萄糖异构酶的影响
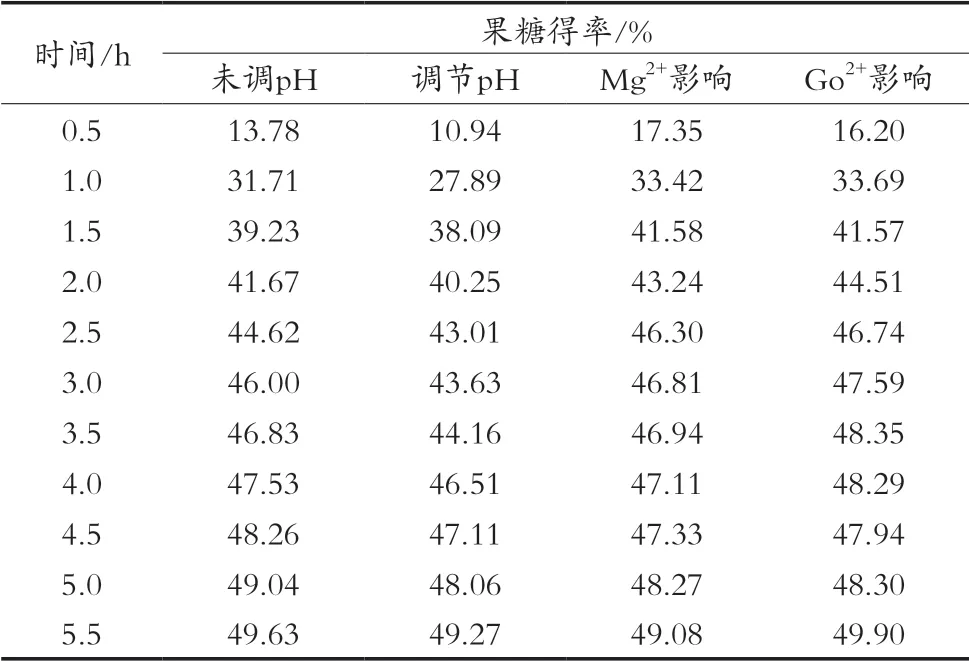
表3 葡萄糖静态异构结果
2.2.2 Mg2+、Go2+对葡萄糖异构酶的影响
从图2和表3数据看出,在Mg2+、Go2+的激活作用下,果糖异构得率在0.5 h分别上升至17.35%和16.20%,在5.0 h上升至48.27%和48.30%,5.5 h后异构趋于最大值。整个异构过程显示Mg2+、Go2+对葡萄糖异构酶的影响无明显差异,对酶的激活效率基本重合。与图1数据同比,在Mg2+、Go2+的激活作用下0.5~2.5 h内果糖异构得率明显高于未调节pH和微碱性条件下的测定数据,数据显示Mg2+、Go2+对异构酶均有一定的激活作用,以添加Mg2+和未调节pH糖液为例,在0.5 h内添加Mg2+可提高果糖得率25.94%。

图2 Mg2+、Go2+对葡萄糖异构酶的影响
2.3 正交试验结果
由表4可知,A、B、C三因素的显著水平值分别为0,0.064和0.010,A、C二因素均小于0.05,即温度、时间对葡萄糖异构结果有显著影响,影响力为温度>时间>浓度。表5同样显示,三因素影响葡萄糖异构的主次顺序为A>C>B,即葡萄糖异构影响力为温度>时间>浓度,异构温度影响力最大。各因素的最好水平是A4B4C4,即各因素的最好水平为温度65℃、浓度50%(w/w)、时间5.5 h。综合正交试验结果确定异构条件:温度65 ℃、浓度50%(w/w)、时间5.5 h。在该条件下试验结果显示果糖得率为49.11%,接近50%的葡萄糖异构的极限值。

表4 葡萄糖异构正交设计方差分析表
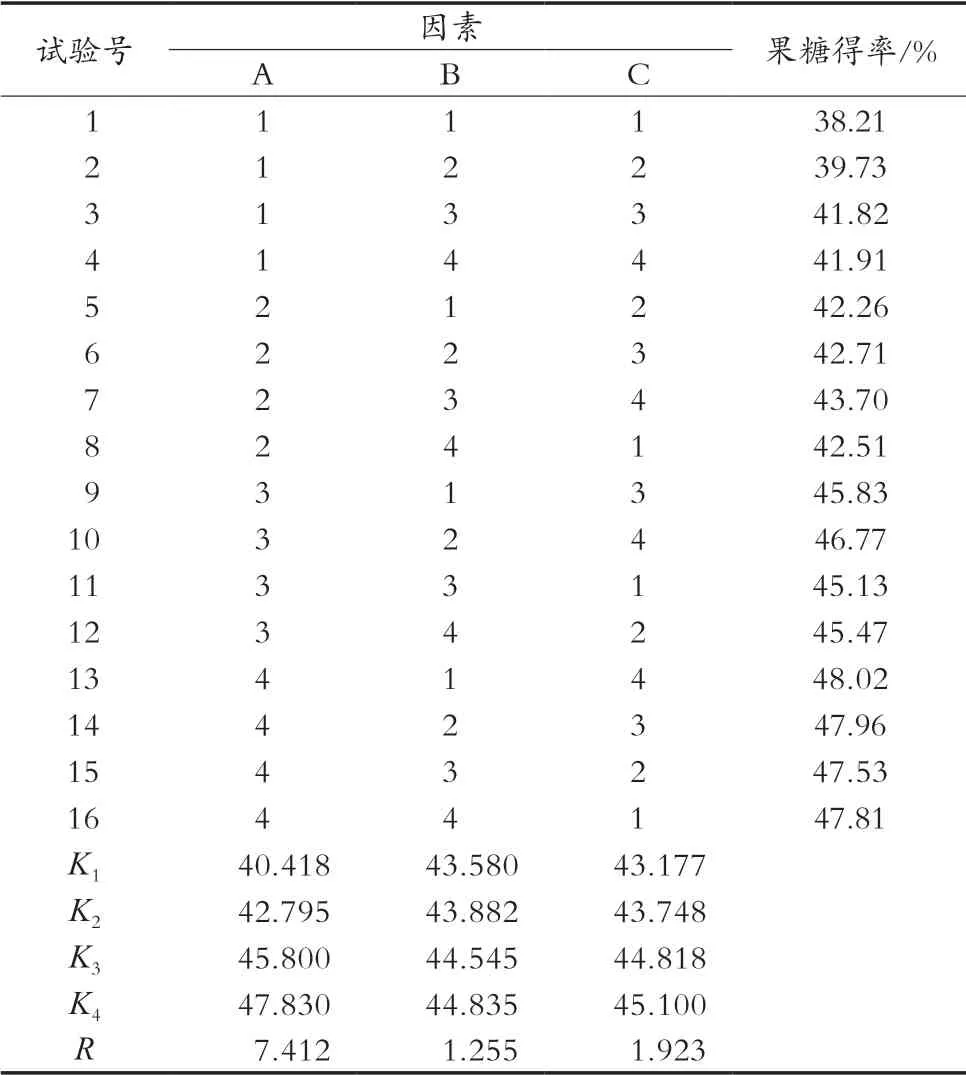
表5 葡萄糖异构正交试验结果
2.4 葡萄糖连续异构试验
2.4.1 糖液流速对异构效率的影响
从图3和表6数据看出,流速4.2 BV/h(35 mL/min)时,共收集35组样品,第5组样品开始果糖得率升至44.10%,此后在44.10%~46.58%波动,果糖平均得率为45.11%。糖液流速3 BV/h(25 mL/min)时,共收集35个样品,第5组样品开始果糖得率升至48.04%,此后在47.32%~49.47%之间波动,果糖平均得率为47.99%,最高可达49.47%,趋于葡萄糖异构的最高效率,数据显示,连续异构过程中保持相对较慢的流速,糖液与异构酶体有充分的接触时间,从而可获得较高的异构效率。

图3 葡萄糖连续异构图
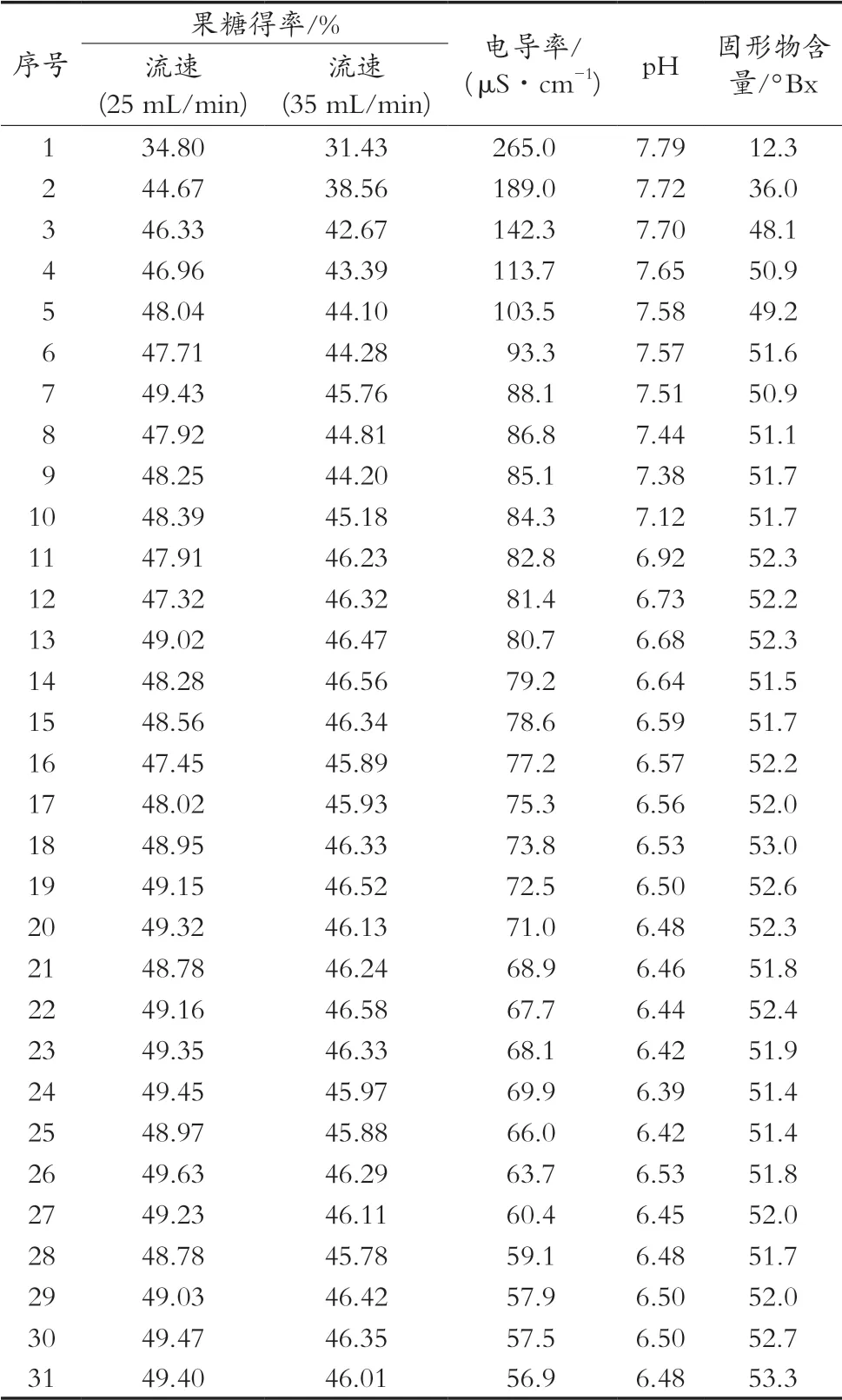
表6 葡萄糖连续异构结果
2.4.2 糖液电导率随时间变化情况
电导率指标代表糖液中含有的离子型非糖液物中的阳离子及二氧化硅等指标[12],由此数据可计算糖液中电导灰分,合理反映糖液的质量。从图4和表6数据看出,糖液流速3 BV/h(25 mL/min)时,开始的1~3个样品电导率较高,至第5组样品电导率从开始的265.0 μS/cm迅速下降至103.5 μS/cm,此后逐步降低至56.9 μS/cm,样品平均电导率为87.7 μS/cm。若继续保持糖液异构,后续样品的电导率逐步下降可趋于异构前44 μS/cm的糖液电导率。初期电导率较高的主要原因是受异构酶本体带有的红色色素和颗粒状的粉末的影响,可适当延长纯水过柱时间至电导率降低后开始流加糖液,则可排除异构初期电导率和色值较高部分的影响。因异构酶采用柱装形式,酶体颗粒堆积密实,在异构过程中酶体呈静止状态,不搅拌酶体颗粒可减少粉末导致的污染,加之试验设置的5组恒温连续异构装置中采用的是φ40×400 mm夹套保温玻璃砂芯层析柱,其中砂芯隔板起到过滤杂质的作用,因而糖液的电导率呈现逐步下降趋势。
2.4.3 糖液pH随时间变化情况
从图4和表6数据看出,糖液流速3 BV/h(25 mL/min)时,从第1组样品开始pH从7.79逐步降低,至第11组样品降至pH 6.92,此后缓慢降低至6.48。连续异构过程中糖液异构pH呈现逐步下降趋势,后期逐渐稳定在pH 6.5,说明异构酶在pH 6.5仍能保持较好酶活性,这与静态试验中未调pH状态下异构酶仍能保持活性的结论一致。

图4 糖液异构pH、电导率变化图
2.4.4 静态异构与连续异构效率的比较
从表7看出,糖液流速3 BV/h(25 mL/min)时,共收集35个样品,第5组样品开始果糖得率达到48.04%,耗时仅用1.67 h,较静态试验Mg2+影响的4.5h缩短2.83 h,异构效率明显提高。这是因为连续异构过程中酶的总用量相对于一个时间段的糖液的量显著增大,且在连续异构过程中糖液的相对运动可与酶体有充分接触,明显提高酶的异构效率,而静态异构方式酶的用量仅为糖液量的10%,且酶用量不可能无限加大。

表7 葡萄糖液异构前后结果
2.4.5 静态异构与连续异构糖液指标的比较
在静态异构过程中需对糖液搅拌,才能让颗粒酶体与糖液有充分的接触,但是搅拌易导致颗粒酶体破碎,影响糖液的色值和电导率指标,而连续异构颗粒酶体为固定方式,连续异构20 kg糖液也能保持颗粒酶体的完整性。从表7数据看出:未调pH的静态异构电导率从14.7 μS/cm升至350.0 μS/cm,电导率上升2 281%,色值从178 IU升至892 IU,色值上升401%;连续异构电导率从44.0 μS/cm升至73.3 μS/cm,电导率上升67%,色值从200 IU升至225 IU,色值上升13%,电导率指标和色值指标均显示连续异构的方式优于静态异构。从表6数据看出,连续异构20 kg糖液后,糖液的电导率指标降至56.9 μS/cm,若继续保持连续异构,电导率可趋于异构前的电导率。
3 结论与讨论
前期预备试验中购买市场上不同品牌的5种粉剂葡萄糖异构酶进行试验,试验中比对不同温度、浓度、时间、pH、异构酶添加量及Mg2+、Go2+对异构酶的影响,试验均显示果糖异构得率很低,视为异构无效。后期采购颗粒状的固定化葡萄糖异构酶,试验显示果糖异构有效。试验认为,葡萄糖异构的关键因素在于异构酶的活性,在酶活性较高的条件下,不需要调整糖液pH,也不需要加入Mg2+、Go2+激活酶体,糖液在自然状态下均可产生果糖的异构,这样可减少异构过程中加入过多的试剂导致糖液电导率和色值的升高,可减轻后期糖液脱色脱盐的负荷。而在酶活性较差的状态下,无论采用何种方式也很难激活异构酶,因此酶活性的保存显得尤为重要。
周雪艳[14]用10 g异构酶优化的连续异构柱高径比20.83,异构速度4.8 BV/h(0.8 mL/min),试验设置的5组恒温连续异构装置共填装500 g固定化异构酶,采用3 BV/h(25 mL/min)异构速度连续异构20 kg 50%(w/w)葡萄糖液,异构酶的用量下降至2.5%(对糖液总量),异构酶仍保持较优酶活性,若按异构酶的理化指标要求(酶生产能力≥5 t/kg)[7],则500 g异构酶至少可异构2.5 t葡萄糖,可满足小型的葡萄糖连续异构的生产需求。试验中连续异构柱单柱高径比7.5,连续5柱的总高径比37.5,糖液异构流速3 BV/h(25 mL/min),果糖平均转化率达48.43%,该试验设置与蔗糖生产结晶果糖的工艺[10]结合可构建一个完整的果糖生产架构体系,实现实验室小型生产结晶果糖的完整流程。
