趋化因子CXCL1在增殖期婴幼儿血管瘤组织中表达研究及外源性CXCL1对血管瘤干细胞的影响
2022-09-21翟晓玥李红红曹东升
翟晓玥,吴 瑶,娄 寅,谢 娟,李红红,曹东升
婴幼儿血管瘤(infantile hemangiomas,IH)发生在约4%~5%的婴儿中,是儿童期最常见的良性肿瘤之一[1],发病机制不明。虽然大多数IH会发生自发性消退,但根据肿瘤生长的位置不同,部分IH仍会造成功能损害甚至危及生命[2]。对于有干预指征的患儿宜行早期治疗。IH是以内皮细胞异常增生和血管结构异常为特征的病变。血管瘤干细胞(hemangioma stem cells,HemSCs)被确定为IH的细胞来源[3]。既往研究[4-5]中,通过作用于HemSCs,可减少血管生成和促进成脂分化,为IH的治疗提供了新的思路。趋化因子在肿瘤的发生发展中起着重要作用。CXCL1作为趋化因子的一种,在肿瘤(包括肝癌和结肠癌)的血管生成中发挥重要作用[6-7]。Yamashita et al[8]采用人血管生成抗体阵列膜对增殖期与非增殖期IH的血液样本研究发现两者间CXCL1具有表达差异,然而其在增殖期IH的组织中的表达尚无报道。该研究目的是探索CXCL1在增殖期IH组织中的表达情况及其对HemSCs的影响,为IH的治疗提供新思路。
1 材料与方法
1.1 材料
1.1.1血管瘤病理组织 20对瘤及瘤旁标本取自2015年1月—2021年6月在安徽医科大学第二附属医院整形外科手术切取后经病理科确诊为IH增殖期的患儿。其中男7例,女13例,年龄2~15个月。本研究获得安徽医科大学第二附属医院伦理委员会批准,征得患儿家属同意并签署知情同意书。
1.1.2主要试剂与仪器 CD133免疫磁珠试剂盒(德国Miltenyi Biotec公司),ECM培养基(美国ScienCell公司),PBS(美国Hyclone公司),胎牛血清及胰酶(美国Gibco公司),CXCL1一抗(美国Santa Cruz公司),免疫组化试剂盒(北京中杉金桥有限公司),CXCL1重组蛋白(上海生工生物工程股份有限公司),细胞培养箱和超净台(美国Thermo Fisher公司),倒置和正置显微镜(日本Olympus公司),酶标仪(上海科华生物工程股份有限公司)。
1.2 HemSCs原代细胞分选增殖期IH组织用PBS清洗去除表面血凝块,用眼科剪和小镊子去除较大脂肪、筋膜组织。然后将剩余组织放入5 ml离心管中,剪成1 mm3大小的组织块,加入等体积0.25% Ⅳ胶原酶置于37 ℃水浴箱中消化2 h。消化完全后用200目的无菌滤膜过滤,获得单细胞悬液。每1×108个细胞加入100 μl CD133免疫磁珠充分混合。将细胞悬液加入分选柱中,收集磁珠结合的CD133阳性细胞。以5×105个细胞/孔接种于500 ng/ml的纤维连接蛋白包被的6孔培养板中,置于37 ℃、5% CO2的细胞培养箱内。24 h后传代接种。
1.3 免疫组化染片前将石蜡切片脱蜡,枸橼酸钠抗原修复15 min,过氧化物酶抑制剂处理15 min,洗涤后破膜10 min,再次洗涤后用10%山羊血清室温封闭1 h,孵育一抗CXCL1后置于暗盒中4 ℃过夜。第2天洗涤后用反应增强液15 min,二抗孵育15 min后DAB显色,苏木精染色后酒精梯度脱水,自然风干后封片,于正置显微镜下观察拍照。每例组化标本在400倍镜下随机取5处完整而不重复的视野进行定量分析,测定CXCL1蛋白免疫组化反应阳性面积的百分率和平均光密度,取每张切片的均值作为该例的测量值。
1.4 CCK-8增殖实验使用CCK-8法检测HemSCs细胞增殖能力。取对数生长期HemSCs细胞,经胰酶(含0.25% EDTA)处理后用ECM(含0、10、20、50、100 ng/ml CXCL1,浓度设置参考Cui et al[9],0 ng/ml CXCL1即为对照组)培养基重悬计数,2 000个细胞/孔接种于96孔板。培养24、48、72 h后,每孔加入CCK-8 20 μl,细胞培养箱中放置2 h后,立刻在设置为450 nm波长的酶标仪上测吸光度(optical density,OD)。每组设置5个复孔,实验重复3次。
1.5 迁移实验Transwell小室用于检测CXCL1对HemSCs细胞迁移能力的影响。24孔板(Transwell下室)中每孔加入500 μl的10% FBS ECM培养基(含50 ng/ml CXCL1)。上室加入HemSCs 2.0×104个细胞/孔,每孔加入150 μl的10% FBS ECM培养基。培养24、48 h后,将24孔板从培养箱中取出。小室在4%多聚甲醛中固定20 min,棉签擦去上层细胞,PBS洗涤2次。结晶紫染色15 min后再洗涤2次,棉签擦干后在倒置显微镜下观察拍照。每组设置3个复孔,实验重复3次。每个迁移小室复孔在100倍镜下随机取3处完整而不重复的视野进行定量分析,测定迁移细胞数量,取3个复孔的均值作为该组的测量值。

2 结果
2.1 CXCL1在增殖期IH瘤内表达高于瘤旁对增殖期IH标本进行CXCL1免疫组化染色发现CXCL1在增殖期IH间质中表达,血管中无表达,见图1。总体CXCL1表达量不高,但瘤内间质中CXCL1表达量高于瘤旁。瘤内CXCL1阳性面积率为(0.773±0.101)%,而在瘤旁仅占(0.268±0.081)%,差异有统计学意义(t=7.843,P<0.001)。瘤内CXCL1平均光密度(1.238±0.099)高于瘤旁(0.835±0.150),差异有统计学意义(t=4.487,P<0.01)。

图1 增殖期IH免疫组化染色 ×400
2.2 HemSCs原代分离和培养经CD133免疫磁珠分选后,所得细胞形态均一,得到HemSCs原代细胞纯度较高。接种4 h后贴壁,细胞呈长梭形。P3代培养24 h后光镜下拍照,见图2。

图2 HemSCs原代细胞培养 ×200
2.3 CXCL1促进HemSCs增殖设置5组重组蛋白CXCL1浓度(0、10、20、50、100 ng/ml)与提取的HemSCs原代细胞进行增殖实验,实验发现使用外源性CXCL1刺激后,HemSCs细胞数相较于未刺激组增加,且24、48、72 h都有差异(F=14.610,P<0.001;F=14.430,P<0.001;F=5.388,P<0.01)。
比较3个时间点的50和100 ng/ml CXCL1刺激后的细胞增殖率,发现差异无统计学意义(t=0.261,P>0.05;t=0.785,P>0.05;t=0.098,P>0.05)。CXCL1促进HemSCs增殖,后续实验使用50 ng/ml作为CXCL1的浓度。见图3。

图3 不同浓度CXCL1对HemSCs的增殖影响
2.4 CXCL1对HemSCs迁移无影响采用50 ng/ml CXCL1浓度对HemSCs进行迁移实验,结果发现对照组和CXCL1处理组间细胞数差异无统计学意义。培养24 h后对小室细胞计数统计分析得:对照组细胞数(122.0±10.4)个,CXCL1处理组(127.8±14.9)个,两者比较差异无统计学意义(t=0.634,P>0.05)。培养48 h后对小室细胞计数统计分析得:对照组细胞数(348.8±18.9)个,CXCL1处理组(356.5±16.3)个,两者比较差异无统计学意义(t=0.622,P>0.05)。由此得出CXCL1对HemSCs迁移无影响,见图4、5。

图4 50 ng/ml CXCL1对HemSCs迁移影响 ×100
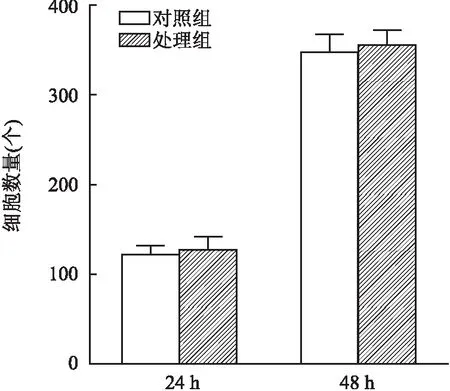
图5 CXCL1处理组与未加CXCL1对照组间迁移细胞数比较
3 讨论
在本研究中经免疫组化发现在增殖期IH组织中瘤内CXCL1蛋白阳性面积率和平均光密度高于瘤旁组织。基因在瘤内和瘤旁的差异性表达是研究疾病的重要依据。CXCL1在肝癌和乳腺癌中都具有瘤内和瘤旁的差异,研究[9-10]发现CXCL1促进乳腺癌和肝癌细胞的增殖和迁移。趋化因子CXCL1对HemSCs的作用尚无研究。通过CD133免疫磁珠法提取IH组织中的HemSCs原代细胞。当使用外源性CXCL1作用于HemSCs时,与未加CXCL1的对照组比较细胞增殖能力增强。相较于CXCL1对肿瘤的生长和转移的影响,本研究得出外源性CXCL1对HemSCs原代细胞仅有增殖的影响。能否通过抑制CXCL1从而减弱HemSCs的增殖进而抑制增殖期IH的恶性进展有待后续进一步研究。CXCL1通过一系列下游通路促进肿瘤的恶性发展。比如通过ERK/MMP2/9通路促进乳腺癌的恶性发展[10],通过CXCL1介导的Akt磷酸化促进胰腺癌的迁移和侵袭[11]。CXCL1对于HemSCs增殖作用更详细的机制有待进一步的研究。
综上所述,CXCL1在增殖期IH瘤内间质中表达高于瘤旁间质,外源性CXCL1促进HemSCs增殖但对迁移无影响。CXCL1与HemSCs间的通路联系及其对IH的治疗价值有待后续深入研究。
