Nod2基因在肺炎克雷伯菌肝脓肿中的作用研究
2022-09-21孙雅婷唐明洋郭明娟兰燕虎李家斌
孟 宝,伍 婷,苏 丛,孙雅婷,唐明洋,郭明娟,兰燕虎,李家斌,,5
化脓性肝脓肿是肝脏的占位性病变,具有高的致病率和致死率,肺炎克雷伯菌(Klebsiellapneumoniae,K.pneumoniae)是其主要的致病菌之一[1-2]。核苷酸结合寡聚化结构域2(nucleotide binding oligomerization domain 2,NOD2)是核苷酸结合寡聚化结构域样受体 (nucleotide binding oligomerization domain-like receptor,NLR) 家族的成员,参与激活NF-κB、MAPKs等促炎通路,增强炎症反应,调节机体免疫应答[3]。近期研究[3-7]表明,NOD2在肺组织防御病原菌感染过程中发挥重要保护作用。目前关于NOD2在肝组织防御病原菌感染过程的作用机制尚不明确。该研究通过繁育和鉴定Nod2基因肝组织条件性敲除小鼠[8],建立Nod2基因肝脏敲除小鼠感染K.pneumoniae诱发肝脓肿模型,初步探究Nod2基因在K.pneumoniae诱导肝脓肿发生发展中的作用及其机制。
1 材料与方法
1.1 材料
1.1.1实验动物与菌株Nod2flox/+小鼠共 3 只,雌鼠 1 只、雄鼠 2 只;Alb-Cre+工具鼠共 2 只,雌、雄各 1 只均购自赛业(广州)生物科技有限公司,20~30 g/6周龄,小鼠品系为C57BL/6J,无特殊病原体(SPF级)。K.pneumoniaeATCC13883由安徽省细菌耐药监测中心保存。所有实验操作均遵循安徽医科大学第一附属医院伦理委员会的批准,伦理审批号:LLSC20190253。
1.1.2主要试剂与仪器 主要试剂:鼠尾基因组DNA 提取试剂盒(货号:NMSC0001-50)购自上海南方模式生物科技股份有限公司;琼脂糖粉(批号:111860)购自生工生物工程(上海)股份有限公司;Trizol Reagent(货号:15596026)购自美国Invitrogen公司;RNA反转录试剂盒(货号:6210A)、DL2000 bp DNA Marker(货号:A1A0438)、TB Green Premix Ex TaqTM(货号:RR420)以及PCR Taq Mix(货号:RR901)均购自日本Takara公司;BCA蛋白浓度测定试剂盒(货号:P0010S)购自碧云天生物技术有限公司;小鼠抗β-Actin 抗体(货号:AF7018)购自江苏亲科生物研究中心有限公司;兔抗NOD2抗体(货号:abs152480)购自爱必信(上海)生物科技有限公司;山羊抗小鼠IgG-HRP(货号:ZB-2305)、山羊抗兔IgG-HRP(货号:ZB-2301)购自北京中杉金桥公司。
主要仪器:普通PCR扩增仪(德国Biometra Tone公司),核酸电泳槽(北京六一生物科技有限公司);凝胶电泳成像仪(Tanon 5200 Multi,上海天能科技有限公司),荧光定量PCR仪(罗氏LightCycler 96,瑞士),Western blot 电泳仪(美国Bio-Rad公司)。
1.2 方法
1.2.1小鼠的饲养与繁育Nod2基因条件敲除小鼠于安徽医科大学实验动物中心SPF级动物房内饲养与繁殖。饲养室温控制在20~25 ℃,湿度50%~60%,保证12 h光照,昼夜交替,自由饮食和饮水。小鼠笼盒、垫料、饲料和饮用水经过高温高压消毒灭菌处理。每周更换2次垫料,更换水和饲料,并且给予人道关怀。
1.2.2小鼠亲代及子代信息记录 在繁殖笼标签上,记录鼠号、基因型、出生日期、合笼日期、父母本的鼠号、产仔日期和数量。在离乳笼标签上,记录笼号、基因型、出生日期、离乳日期。
1.2.3小鼠基因型鉴定 小鼠出生后3~4周与母鼠分笼,使用75%乙醇溶液冲洗剪刀和镊子并剪取小鼠脚趾0.3~0.5 cm放入1.5 ml 无菌EP管中,并依据剪取的不同脚趾标记同窝小鼠。用基因组DNA提取试剂盒提取小鼠基因组DNA,所得样品置-20 ℃保存。Nod2flox/+小鼠基因型鉴定,上游引物:5′-CATCGCAGCCAGACTTGAAGTT-3′;下游引物:5′-CCTTGTTGCCCATATGATTCTGAC-3′(flox纯合子小鼠:216 bp;flox杂合子小鼠:216 bp和171 bp;flox阴性小鼠:171 bp)。Alb-Cre+小鼠基因型鉴定,上游引物:5′-GAAGCAGAAGCTTAGGAAGATGG-3′;下游引物:5′-TGCAAACATCACATGCACAC-3(Alb-Cre+小鼠:390 bp;Alb-Cre-小鼠:351 bp)。PCR反应体系为25 μl(Taq Mix 13 μl,去离子水10 μl,引物1 μl,小鼠DNA 1 μl),反应程序:95 ℃ 3 min;95 ℃ 30 s,60 ℃ 30 s,72 ℃ 30 s,共35 个循环;72 ℃ 10 min,4 ℃ 1 h。
配制2.0%的琼脂糖凝胶:称取2.0 g琼脂糖粉末溶于100 ml 1×TAE电泳缓冲液中,微波炉中高火加热4 min,冷却至60 ℃左右加入10 μl 红色荧光核酸染料,轻摇混匀,制胶。取5 μl PCR产物和3 μl DL2000 bp DNA Marker加入上样孔中进行电泳分析,恒压150 V,时间35 min;然后置于凝胶电泳成像仪中成像,观察电泳条带。
1.2.4Nod2基因敲除效果验证 取Nod2flox/flox;Alb-Cre+(实验组小鼠)和Nod2flox/flox(对照组小鼠)的肝组织,采用RT-qPCR方法检测两组肝组织Nod2基因的mRNA 的表达水平。上游引物:5′-AGAAGCTCCTCGAAGCTGTG-3′;下游引物:5′-CCTCACACTCGTACTGGCTC-3′;内参Gapdh基因上游引物为5′-GTCAAGGCCGAGAATGGGAA-3′;下游引物为5′-CTCGTGGTTCACACCCATCA-3′。Western blot检测两组肝组织NOD2 蛋白的表达水平:用 RIPA裂解液提取两组小鼠的肝组织总蛋白,BCA蛋白定量后取适量与上样缓冲液混合100 ℃水浴10 min变性。将所制蛋白样品进行SDS-PAGE电泳,恒压75 V,120 min;电泳结束后将蛋白转至PVDF膜上,5%脱脂奶粉室温封闭1 h。分别加入经一抗稀释液稀释的β-Actin抗体(1 ∶1 000)、NOD2抗体(1 ∶800),4 ℃孵育过夜;1×TBST缓冲液洗膜3 次,每次10 min;加入5%脱脂奶粉稀释的山羊抗兔或山羊抗鼠的二抗(1 ∶10 000)孵育 1.5 h,1×TBST缓冲液洗脱3 次后化学发光成像系统进行拍照,观察NOD2蛋白表达情况,进一步验证Nod2基因在肝组织中的敲除效果。
1.2.5小鼠感染K.pneumoniae诱发肝脓肿模型 将K.pneumoniaeATCC13883划线接种在MHA固体培养平板上,37 ℃过夜培养;次日,挑取单菌落于液体MHB培养基中,制备成1.5×108CFU/ml的细菌悬浮液;每只小鼠口腔灌胃0.3×108CFU肺炎克雷伯菌(体积为200 μl)诱发肝脓肿。
1.2.6小鼠肝组织病理切片制备 使用1%戊巴比妥纳腹腔麻醉小鼠取出完整肝组织,放入10%的中性福尔马林中固定;将固定好的小鼠肝脏组织依次进行脱水透明、浸蜡包埋、切片展片、脱蜡染色,最后用中性树胶封片,存放备用。
1.2.7小鼠肝组织炎症因子荧光定量PCR检测Nod2flox/flox;Alb-Cre+(实验组小鼠)和Nod2flox/flox(对照组小鼠)分别感染K.pneumoniae48 h后,取出肝组织,采用RT-qPCR方法检测两组小鼠肝脏中炎症因子肿瘤坏死因子-α (tumor necrosis factor alpha,TNF-α)、白细胞介素1β(interleukin 1β,IL-1β)和趋化因子CXC配体1(C-X-C motif chemokine ligand 1,CXCL1) 的mRNA表达量。GAPDH上下游引物见“1.2.4”;TNF-α上游引物为5′-TGACAAGCCTGTAGCCCACG-3′,下游引物为5′-TTGTCTTTGAGAT- CCATGCCG-3′。IL-1β上游引物为5′-GAAATGCCACCTTTTGACAGTG-3′,下游引物为5′-TGGATGCTCTCATCAGGACAG-3′;CXCL1上游引物为5′-ACAGGGGCGCCTATCGC-3′,下游引物为5′-ACAATTTTCTGAACCAAGGGAGC-3′。
1.3 统计学处理采用SPSS 16.0 软件进行统计学分析,每组实验重复3次,组间比较采用t检验,对于生存率曲线比较,使用Log-Rank(Mantel-Cox) 检验分析结果。P<0.05 为差异有统计学意义。
2 结果
2.1 小鼠基因型鉴定结果取幼鼠脚趾进行小鼠基因型鉴定。基因型鉴定PCR结果如图1所示,1、2、5为flox纯合子(Nod2flox/flox,216bp);3和4 为flox杂合子(Nod2flox/+,171 bp和216 bp)。Alb-Cre基因型鉴定PCR结果如图2 所示:其中1、3和4为Alb-Cre+小鼠 (390 bp),2和5为Alb-Cre-小鼠(351 bp)。选择1为实验组小鼠(基因型:Nod2flox/flox;Alb-Cre+),2、5为对照组小鼠(基因型为Nod2flox/flox)。

图1 flox基因型鉴定结果

图2 Cre基因型鉴定结果
2.2 条件性基因敲除小鼠敲除效果验证取5只实验组和5只对照组小鼠肝脏进行敲除效果验证。提取小鼠肝组织RNA,反转录为cDNA后进行荧光定量PCR鉴定。结果如图3所示,Nod2flox/flox;Alb-Cre+小鼠肝脏NOD2 mRNA的表达量小于Nod2flox/flox小鼠肝脏NOD2 mRNA 的表达量[(0.419±0.097)vs(1.030±0.320),P<0.05]。Western blot实验结果如图4所示,与Nod2flox/flox小鼠比较,Nod2flox/flox;Alb-Cre+小鼠NOD2蛋白降低。最终获得了可以用于后续实验的Nod2基因肝脏条件性敲除小鼠(Nod2flox/flox;Alb-Cre+)。

图3 两组小鼠NOD2 mRNA表达量
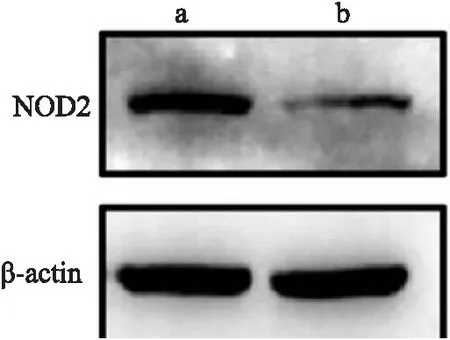
图4 两组小鼠NOD2蛋白表达水平
2.3Nod2flox/flox;Alb-Cre+小鼠感染肺炎克雷伯菌后表型变化为探究Nod2基因在小鼠肝脏感染K.pneumoniae中发挥的作用,实验组小鼠(基因型:Nod2flox/flox;Alb-Cre+)和对照组小鼠(基因型:Nod2flox/flox)各取10只,通过口腔灌胃的方法制备肝脓肿模型,检测小鼠和肝组织病理变化和72 h死亡率。结果发现,实验组小鼠和对照组小鼠感染K.pneumoniae48 h后,与对照组比较,实验组肝组织整体结构大面积受到破损,病理损伤程度严重(图5);对照组小鼠72 h死亡率为30%,实验组小鼠组72 h死亡率为70%(中位生存时间60.5 h,P=0.046 9),差异有统计学意义(图6)。

图5 两组小鼠肝组织病理学改变 HE×200
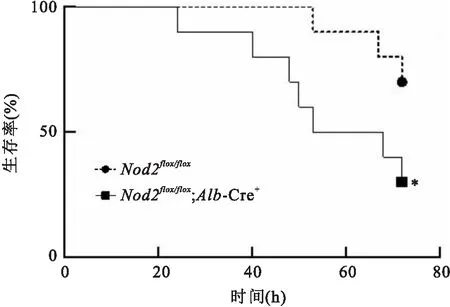
图6 两组小鼠感染肺炎克雷伯菌后生存率曲线
2.4Nod2flox/flox;Alb-Cre+小鼠感染K.pneumoniae后肝脏炎症因子表达水平改变比较实验组小鼠(基因型:Nod2flox/flox;Alb-Cre+)和对照组小鼠(基因型为Nod2flox/flox)感染K.pneumoniae48 h后肝组织炎症因子的表达水平。结果如图7所示,与对照组比较,实验组小鼠肝脏内的炎症因子TNF-α(t=3.736,P=0.020)、IL-1β(t=3.114,P=0.036)和CXCL1(t=3.264,P=0.031)的相对表达量降低,差异有统计学意义。

图7 两组小鼠感染肺炎克雷伯菌后肝脏炎症因子mRNA表达
3 讨论
K.pneumoniae是一种革兰染色阴性的条件致病菌,可引起多种感染性疾病,包括菌血症、肺炎和肝脓肿等[9]。健康人体肠道内定值的高毒力K.pneumoniae,在病理状态下可经门静脉系统进入肝脏引起肝脓肿,伴有脓毒症的K.pneumoniae肝脓肿还可以引起眼内炎、脑膜炎、坏死性筋膜炎等肝外并发症[2,10-11]。胞质内模式识别受体NOD2可识别细菌产生的肽聚糖MDP,通过招募并与接头蛋白RIP2或CARD9结合触发NF-κB、MAPKs等促炎信号通路,产生炎症因子和抗菌肽,在宿主抵御细菌感染的过程中发挥重要作用[12-14]。已有研究发现NOD2在肺炎链球菌感染的脑膜炎中通过诱导脑部炎症和自噬发挥保护作用[15];NOD2在早期鲍曼不动杆菌肺部感染中通过产生活性氧/活性氮参与肺防御[7]。目前,Nod2基因在肝脏中的功能尚不明确。
本研究利用Cre-Loxp重组酶系统敲除小鼠肝脏中Nod2基因,通过繁育和基因鉴定,成功筛选出纯合子幼鼠(Nod2flox/flox;Alb-Cre+);RT-qPCR和Western blot结果显示,NOD2 mRNA表达量降低,NOD2蛋白表达量降低,这提示小鼠肝脏Nod2基因敲除成功。
K.pneumoniae感染肝组织后,肝脏Kupffer细胞、毛细血管内皮细胞、单核细胞及巨噬细胞可以通过产生IL-1β、TNFα、CXCL1等细胞因子,产生保护性的免疫应答。本研究发现,在感染K.pneumoniae的小鼠中,肝脏Nod2基因敲除后,小鼠生存率降低且肝组织病理损伤增大,说明条件基因敲除小鼠对K.pneumoniae感染的抵抗能力减弱。此外,感染K.pneumoniae的Nod2基因条件敲除小鼠肝脏炎症因子TNF-α、IL-1β和CXCL1的mRNA相对表达量均降低,由此可见NOD2可能通过其介导的炎症反应影响肝脏抗K.pneumoniae感染的免疫应答。
