基于阿尔茨海默症模型大鼠的开心散药动学研究
2022-07-22冯晓晓王彬斌龚慕辛李朝霞
冯晓晓,王彬斌,陈 东,仇 峰,龚慕辛,李朝霞
基于阿尔茨海默症模型大鼠的开心散药动学研究
冯晓晓,王彬斌,陈 东,仇 峰,龚慕辛,李朝霞*
首都医科大学中医药学院 中医络病研究北京市重点实验室,北京 100069
表征开心散各成分在寡聚态β淀粉样蛋白1-42(β amyloid protein 1-42,Aβ1-42)诱导阿尔茨海默症(Alzheimer’s disease,AD)模型大鼠体内的药动学行为,建立并验证同时测定大鼠血浆中开心散各成分含量的超高效液相色谱-串联质谱(UPLC-MS/MS)方法。采用双侧海马注射寡聚态Aβ1-42的方法建立AD大鼠模型,开心散单次ig给药,于不同时间点取血,测定各成分的血药浓度。采用DAS 2.0软件以非房室模型拟合,计算药动学参数。建立的UPLC-MS/MS方法的精密度、准确度、提取回收率、基质效应和稳定性等方法学考察结果均符合生物样品分析的测定要求。Morris水迷宫实验证实成功构建AD大鼠模型(<0.05)。AD模型大鼠给予开心散后,按中药化学结构分类的同型化合物具有相似的药动学特征,如属于同分异构体的α-细辛醚和β-细辛醚、同属于羊毛甾-7,9(11)-二烯型三萜的去氢土莫酸与松苓新酸以及同属于3,4-开环-羊毛甾-7,9(11)-二烯型三萜的茯苓新酸A和茯苓新酸B等。α-细辛醚和β-细辛醚的达峰时间(max)和消除半衰期(1/2)均较短,表明二者在AD模型大鼠体内吸收迅速,消除也快;茯苓新酸A和茯苓新酸B的达峰时间(max)较短,但二者的半衰期(1/2)却较长,表明它们吸收迅速,但消除缓慢。去氢土莫酸和松苓新酸达峰时间(max)和半衰期(1/2)均较长,吸收和消除缓慢。此外,去氢土莫酸的药时曲线存在双峰现象,其平均滞留时间(MRT)也较长,这可能源于较强的肝肠循环,延长了其作用时间。揭示了AD疾病状态下开心散的体内药动学过程,为阐明开心散成分体内过程及其后续研究开发提供参考。
开心散;阿尔茨海默症;药动学;超高效液相色谱-串联质谱;寡聚态β淀粉样蛋白1-42;α-细辛醚;β-细辛醚;茯苓新酸A;茯苓新酸B;去氢土莫酸;松苓新酸
开心散源自唐代孙思邈所著的《备急千金要方》[1],由人参、远志、石菖蒲、茯苓4味药组成,“主好忘”,历代医家记载开心散对健忘、怔忡等病症具有良好的治疗作用[2-4]。较多现代研究证实开心散在治疗阿尔茨海默症(Alzheimer’s disease,AD)方面具有良好的应用前景[5-9],然而其体内过程、起效机制与临床合理应用尚不明确,有待深入研究。
药动学研究可揭示中药复方中有效成分的动态变化规律,为阐明复方的药效物质基础与作用机制提供依据[10]。目前开心散及其类方的药动学研究主要聚焦于源自人参和远志中的部分化学成分,如人参皂苷Rg1、人参皂苷Re、远志𠮿酮III、西伯利亚远志糖A5、西伯利亚远志糖A6等[11-18],但对方中源自石菖蒲与茯苓的成分涉及较少。究其原因,可能是因为石菖蒲与茯苓成分在药材中含量较低,且生物利用度不高,检测难度大。本课题组在前期研究中选用临床应用较多的经典开心散组方[19-23],证实其能够有效改善AD模型动物/转基因小鼠的学习记忆能力。鉴于此方重用石菖蒲和茯苓(人参、远志、石菖蒲、茯苓为1∶1∶25∶50),因此有必要在开展药动学研究时重视源自石菖蒲和茯苓2味药中的成分,以期全面表征开心散的药动学特征。
此外,AD疾病状态可能会导致开心散的体内过程发生改变,影响临床精准用药,故以AD模型动物为研究对象开展药动学研究可更好地阐明开心散各成分的体内过程[24]。因此,本研究选用双侧海马CA1区立体定位注射寡聚态β淀粉样蛋白1-42(β amyloid protein 1-42,Aβ1-42)建立AD模型大鼠,建立并验证超高效液相色谱-串联质谱(UPLC-MS/MS)方法测定开心散中待测成分的血药浓度,对开心散的体内过程进行研究,以期为开心散的临床研究和应用提供参考。
1 材料
1.1 动物
清洁级雄性SD大鼠,体质量(250±20)g,购自北京维通利华实验动物技术有限公司,许可证号SYXK(京)2016-0006。动物饲养于温度(25±2)℃、湿度(50±10)%的屏障环境内,给予标准颗粒饲养并自由饮水,每日光照12 h。实验前,适应性饲养7 d。伦理审查由首都医科大学伦理委员会批准,伦理编号AEEI-2018-101,所有动物实验均在中华人民共和国科技部颁布的实验动物护理和使用的指导下进行。
1.2 药材
开心散由人参、远志、石菖蒲和茯苓组成。人参(批号16110803)、石菖蒲(批号17110103)和茯苓(批号17111504)购自北京能济中药饮片有限公司,远志(批号16080803)购自北京明辉恒通药业有限公司,经首都医科大学中医药学院李佳副教授鉴定分别为五加科植物人参C. A. Mey.的干燥根和根茎、天南星科植物石菖蒲Schott.的干燥根茎、多孔菌科真菌茯苓(Schw.) Wolf的干燥菌核和远志科植物远志Willd.的干燥根,均符合《中国药典》规定。
1.3 试剂
开心散待测成分的化学结构见图1。对照品α-细辛醚(批号PS001187,质量分数>98%)、去氢土莫酸(批号PS011211,质量分数>98%)、茯苓新酸A(批号PS010102,质量分数>97%)、盐酸丁螺环酮(批号6-EOD-111-1,质量分数>98%)和斯皮诺素(批号PS000864,质量分数>98%)购自成都普思生物科技股份有限公司;β-细辛醚对照品(批号11208-201601,质量分数为96.8%)购自中国食品药品检定研究院;对照品松苓新酸(批号Y08J7H8750,质量分数>98%)、茯苓新酸B(批号P13J9L63651,质量分数>95%)购自上海源叶生物科技有限公司;色谱纯甲醇、色谱纯甲酸购自美国Thermo Fisher Scientific公司;娃哈哈纯净水购自杭州娃哈哈集团有限公司;Aβ1-42购自MCE公司。
1.4 仪器
QTRAP6500型UPLC-QQQ-MS/MS(美国AB Sciex公司);DV215CD型十万分之一电子天平(德国Sartorius公司);V0400型真空干燥箱(德国Memmert公司);3K15型低温高速离心机(美国Sigma公司);MG-2200型氮吹仪(日本EYELA公司);ZH-2型涡旋混合器(天津药典标准仪器厂);KQ-250型超声波清洗器(昆山市超声仪器有限公司);超低温冰箱(美国Thermo Fisher Scientific公司);68025型脑立体定位仪(深圳市瑞沃德生命科技有限公司);788130型显微注射泵(美国KDS公司);78001型颅钻(深圳市瑞沃德生命科技有限公司);63031型水迷宫实验设备(深圳市瑞沃德生命科技有限公司)。
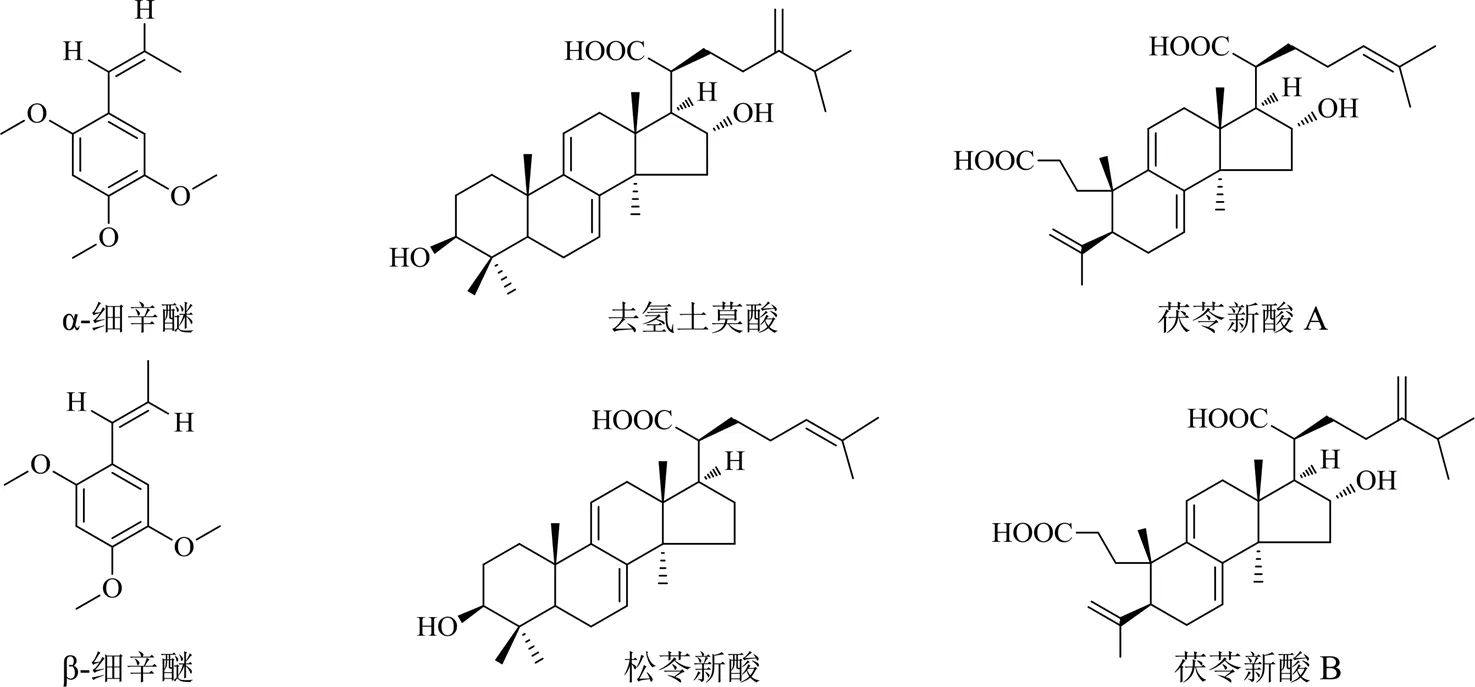
图1 开心散中待测成分的化学结构
2 方法
2.1 开心散的制备
将4味药材粉碎,过24目筛得到中药粗粉。按比例称取药材粉末,加入12倍量70%乙醇,浸泡0.5 h,回流提取2 h,滤过,滤渣用10倍量70%乙醇,回流提取1 h,滤过,合并滤液,减压回收乙醇,干燥,得开心散提取物。经检测,每克开心散复方中含β-细辛醚1194 μg、α-细辛醚125.0 μg、去氢土莫酸193.2 μg、茯苓新酸A 9.326 μg、茯苓新酸B 10.93 μg、松苓新酸12.23 μg[23]。
2.2 对照品溶液的制备
精密称取α-细辛醚、β-细辛醚、去氢土莫酸、松苓新酸、茯苓新酸A和茯苓新酸B对照品适量,以甲醇溶解,分别配制成质量浓度为1.00 mg/mL的单一对照品溶液。精密吸取上述单一对照品溶液,以甲醇稀释,配制为系列混合对照品溶液,于−20 ℃保存。
精密称取丁螺环酮和斯皮诺素对照品适量,以甲醇溶解,分别配制成质量浓度为1.00 mg/mL的单一对照品溶液。精密吸取上述对照品溶液,用甲醇-乙腈溶液(1∶1)稀释,得到内标溶液(含丁螺环酮10 ng/mL、斯皮诺素500 ng/mL),于−20 ℃保存。
2.3 色谱条件和质谱条件
2.3.1 色谱条件 安捷伦1290 Inifinity型超高效液相色谱仪,配有G4220A泵、G1316C柱温箱、G4226A进样器、G1330B恒温器。色谱柱为Agilent Poroshell 120 EC-C18色谱柱(100 mm×2.1 mm,2.7 μm)。流动相为0.1%甲酸水溶液(A)-含0.1%甲酸的甲醇溶液(B),梯度洗脱:0~1.0 min,35% B;1.0~3.0 min,35%~70% B;3.0~5.5 min,70%~73% B;5.5~5.6 min,73%~90% B;5.6~7.0 min,90% B;7.0~7.1 min,90%~100% B;7.1~9.0 min,100% B;9.0~9.1 min,100%~35% B;9.1~10.0 min,35% B。柱温30 ℃;体积流量0.3 mL/min;进样体积2.0 μL。
2.3.2 质谱条件 AB SCIEX API 4000™三重四级杆质谱仪,离子源为电喷雾离子源(ESI),采用多反应监测(multiple reaction monitoring,MRM)模式,在正负离子模式下同时检测,质谱参数如下:不同离子模式下气帘气137.90 kPa;毛细管温度500 ℃;入口电压±10 V;离子喷雾电压±4500 V;雾化器气体344.75 kPa,加热器气体344.75 kPa;碰撞池出口电压正离子模式82.74 kPa,负离子模式−13.0 V。开心散待测成分与内标的质谱参数见表1。
2.4 血浆样品的处理
取血浆样品,在室温下解冻,涡旋30 s,精密吸取血浆样品50 μL,加入10 μL甲醇溶液、150 μL含2种内标的甲醇-乙腈溶液(1∶1),涡旋30 s。4 ℃、12 000 r/min离心10 min,取上清液定量转移至离心管,氮气流下蒸干。残渣加50 μL甲醇复溶,涡旋混匀30 s,超声处理5 min,12 000 r/min离心10 min,取上清液进样分析。
表1 开心散待测成分及内标的质谱参数
Table 1 Mass spectrum conditions of analytes of Kaixin Powder and internal standard
化合物ESI模式母离子(m/z)子离子(m/z)去簇电压/V碰撞能量/eV α-细辛醚+209.2194.18021.0 β-细辛醚+209.1194.18021.0 盐酸丁螺环酮+386.0122.014537.2 去氢土莫酸−483.5483.5−220−45.8 松苓新酸−453.3453.3−220−46.7 茯苓新酸A−497.5423.2−190−40.8 茯苓新酸B−483.4465.1−200−33.5 斯皮诺素−607.3427.3−200−41.3
2.5 方法学验证
根据《中国药典》2020年版四部中的生物样品定量分析方法验证指导原则对本研究建立的定量分析方法进行系统验证。
2.5.1 选择性 比较空白血浆、空白血浆中加入定量下限(low limits of quantification,LLOQ)对照品和内标溶液以及大鼠开心散30 min后的血浆样品的MRM质谱图,考察方法的选择性。
2.5.2 线性及LLOQ 分别取大鼠空白血浆50 μL,加入10 μL系列质量浓度的混合对照品溶液,按样品测定方法处理测定。混合对照品溶液配制如下:分别定量吸取α-细辛醚、β-细辛醚、去氢土莫酸、松苓新酸、茯苓新酸A和茯苓新酸B母液,加入定量甲醇,配制成混合对照品溶液,吸取一定量的混合对照品溶液,用甲醇稀释成系列混合对照品溶液。α-细辛醚、去氢土莫酸、茯苓新酸A和茯苓新酸B的标准曲线质量浓度均为500、200、100、50.0、25.0、10.0、5.00、2.00 ng/mL;β-细辛醚的标准曲线质量浓度为1000、500、200、100、50.0、25.0、10.0、5.00、2.00、1.00 ng/mL;松苓新酸的标准曲线质量浓度为1000、500、200、100、50.0、25.0、10.0 ng/mL。以对照品质量浓度为横坐标(),以对照品峰面积与内标峰面积比值为纵坐标(),用加权最小二乘法进行线性回归,建立待测成分对照品在大鼠空白血浆中的标准曲线,确定待测成分LLOQ。
2.5.3 精密度与准确度 取一个分析批的LLOQ及低、中、高3种质量浓度质控样品(每个浓度6份样品),并制备标准曲线同批测定,计算各成分的日内精密度和准确度;连续测定3个分析批(3 d内),计算各成分的日间精密度和准确度。
2.5.4 稳定性 制备低、中、高质量浓度的质控样品,进行室温放置24 h,−80 ℃保存7 d,−80 ℃反复冻融3次实验,测定(各实验每个浓度6份样品)。
2.5.5 提取回收率 制备低、中、高质量浓度的质控样品,每个浓度6份样品,进样分析。取空白血浆,除不加混合对照品溶液之外按样品处理,氮吹后加入混合对照品溶液,进样分析。将质控样品峰面积和氮吹后加入标准溶液的样品的峰面积相比,计算各成分的提取回收率。
2.5.6 基质效应 取空白血浆,除不加混合对照品溶液之外按样品处理,氮吹后再加入混合对照品溶液,制备含有基质的低、中、高质量浓度样品,每个质量浓度6份样品。制备不含基质的样品(待测成分和内标的纯溶液),每个质量浓度6份样品。进样分析考察基质效应。
2.6 AD模型大鼠的建立
2.6.1 寡聚态Aβ1-42的制备 取Aβ1-42粉末1 mg,加入二甲基亚砜和无菌生理盐水,配制成质量浓度为1 μg/μL的Aβ1-42溶液(含5%二甲基亚砜)。37 ℃孵育3 d,于−80 ℃保存备用。
2.6.2 造模 雄性SD大鼠采用双侧海马CA1区立体定位注射寡聚态Aβ1-42造模[25-28]。大鼠麻醉去毛备皮后固定在脑立体定位仪上,消毒,切开颅骨外皮肤,去除骨膜。以前囟为原点,在前囟后−3.3 mm、左右±2.2 mm、背腹侧−2.8 mm处,使用微量注射器各注射5 μL Aβ1-42(1 μg/μL),注射速度为1 μL/min,注射结束后留针5 min。退针后缝合伤口,伤口处用碘伏消毒,并给予青霉素粉末抗菌。
2.6.3 Morris水迷宫实验 手术1周后,采用Morris水迷宫测试评价动物学习记忆能力。第1天起将平台置于某一象限,进行定位航行实验,记录逃逸潜伏期,共实验5 d,定位航行实验结束24 h后,进行空间探索实验,记录动物在120 s内的穿越平台次数、目标象限时间比以及目标象限距离比。造模成功大鼠用于药动学实验。
2.7 药动学研究
取上述经验证造模成功的AD模型大鼠6只,实验前禁食12 h,可自由饮水。大鼠ig开心散(10 g/kg),分别于给药前和给药后5、10、15、30 min及1、2、4、6、8、12、24 h时间点,取静脉血200 μL至含有肝素钠的离心管中,4 ℃、3000 r/min离心10 min,分离血浆,于−80 ℃保存。
2.8 数据处理
在Morris水迷宫实验中,定位航行实验结果使用双因素重复测量方差分析。空间探索实验中穿越平台次数采用非参数检验分析,其他数据采用单因素方差分析。数据以表示。
使用DAS 2.0软件以非房室模型计算成分的药动学参数。使用GraphPad Prism v6.0软件绘制血药浓度-时间曲线。数据以表示。
3 结果
3.1 Morris水迷宫评价AD模型大鼠
如图2所示,在定位航行实验的第1、2、3天,AD模型大鼠的逃逸潜伏期较正常大鼠更长(<0.05),说明AD模型大鼠找到水下隐藏平台需要更长的时间;在空间探索实验中,AD模型大鼠穿越平台的次数、目标象限时间比和目标象限距离比均明显低于正常大鼠(<0.05)。综上,行为学实验结果表明AD模型大鼠模型建立成功。
3.2 方法学考察
3.2.1 选择性 如图3所示,各化合物峰形良好,大鼠血浆中的内源性物质、可能的代谢产物等对待测成分和内标的测定无干扰。
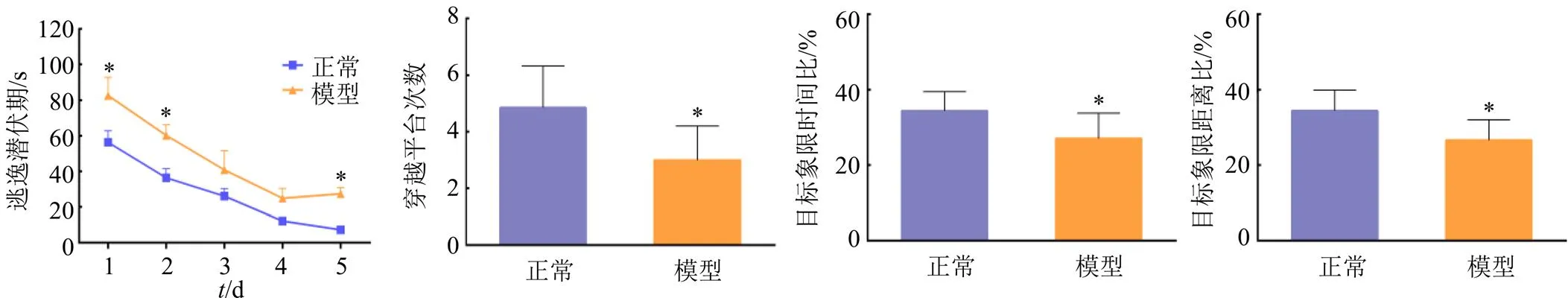
与正常组比较:*P<0.05
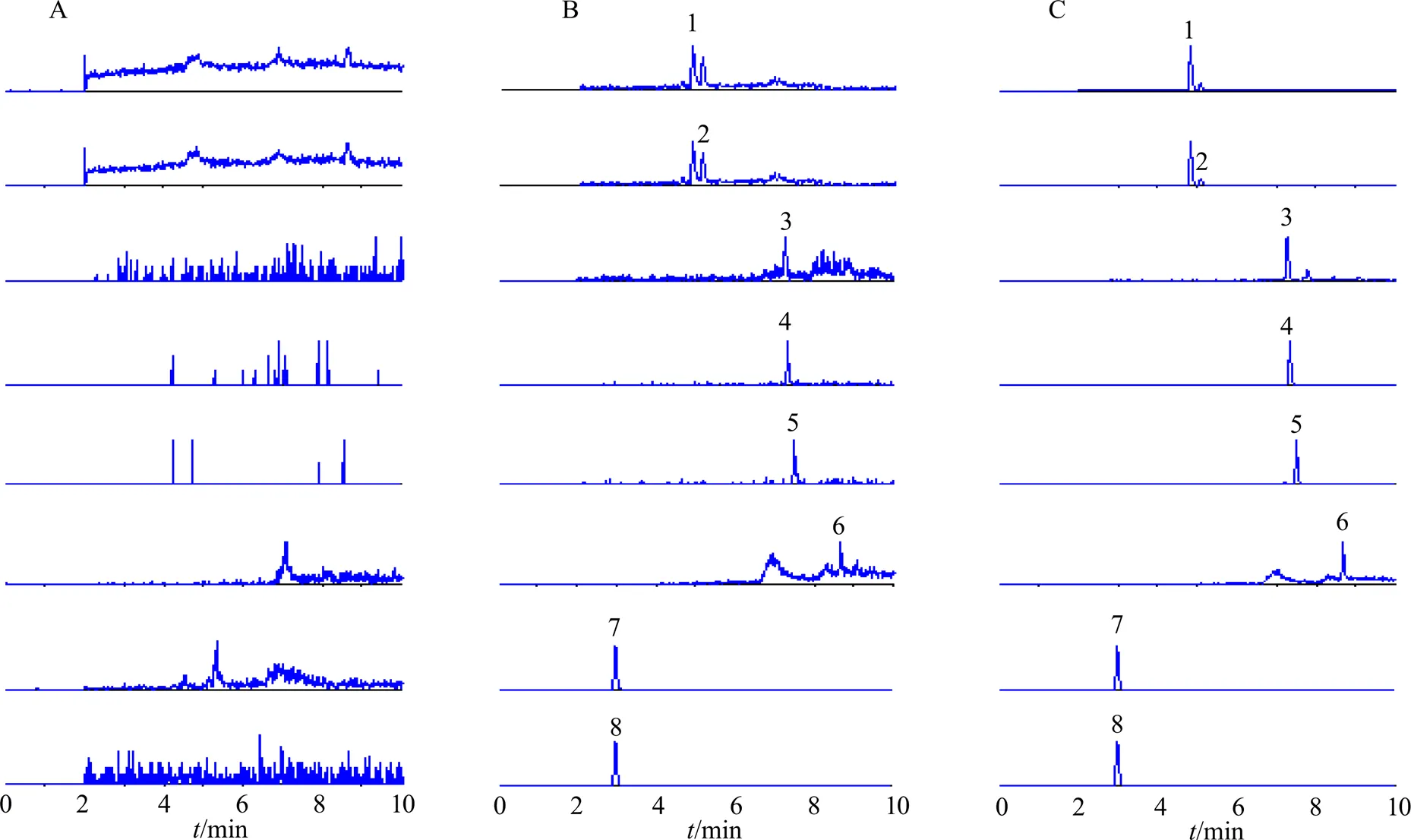
1-β-细辛醚 2-α-细辛醚 3-去氢土莫酸 4-茯苓新酸B 5-茯苓新酸A 6-松苓新酸 7-丁螺环酮 8-斯皮诺素
3.2.2 线性和LLOQ 采用UPLC-MS/MS法测定AD模型大鼠血浆中开心散待测成分的LLOQ及标准曲线的线性回归方程,如表2所示,各成分在相应质量浓度范围内显示出良好的线性。
3.2.3 精密度和准确度 如表3所示,各成分的日内精密度和日间精密度均在±15%以内,日内准确度和日间准确度均在±15%以内,符合要求。
3.2.4 稳定性 稳定性考察结果见表4。室温放置24 h,−80 ℃保存7 d,−80 ℃反复冻融3次实验样品测定结果符合要求。
3.2.5 提取回收率和基质效应 提取回收率和基质效应结果见表5,各成分提取回收率为86.36%~97.47%,RSD值为1.45%~6.60%,基质效应为80.50%~100.23%,RSD值为0.95%~6.88%,均符合要求。
3.3 药动学实验结果
采用建立的UPLC-MS/MS方法,检测AD模型大鼠给药开心散后待测成分在不同时间点的血药浓度,绘制得到平均血药浓度-时间曲线,见图4。采用DAS 2.0软件,以非房室模型计算AD模型大鼠给药开心散后待测成分的药动学参数,结果见表6。结果显示,α-细辛醚的达峰时间(max)值与半衰期(1/2)值分别为(0.26±0.12)、(0.54±0.25)h,β-细辛醚的max值与1/2值分别为(0.21±0.05)、(0.65±0.24)h,两者的达峰时间与半衰期均较短。去氢土莫酸的max值与1/2值分别为(3.92±4.11)、(3.57±1.04)h,松苓新酸的max值与1/2值分别为(1.25±0.61)、(5.43±2.25)h,两者的达峰时间与半衰期均较长。茯苓新酸A和茯苓新酸B的max值分别为(0.28±0.11)、(0.24±0.03)h,两者的1/2值分别为(3.90±1.67)、(7.99±2.88)h,成分达峰时间较短但半衰期较长。
表2 开心散待测成分的线性回归方程及LLOQ
Table 2 Calibration curves and LLOQ of analytes of Kaixin Powder
化合物线性方程r线性范围/(ng·mL−1)LLOQ/(ng·mL−1) α-细辛醚y=8.383×10−4 x+5.130×10−40.998 32.0~500.02.0 β-细辛醚y=5.768×10−4 x-2.469×10−20.995 91.0~1 000.01.0 去氢土莫酸y=1.925×10−4 x+2.563×10−40.995 72.0~500.02.0 松苓新酸y=1.250×10−5 x+4.300×10−40.999 610.0~500.010.0 茯苓新酸Ay=9.476×10−5 x-1.191×10−40.997 12.0~500.02.0 茯苓新酸By=1.250×10−5 x+1.410×10−40.996 82.0~500.02.0
表3 开心散待测成分的精密度和准确度(, n = 6)
Table 3 Accuracy and precision of analytes of Kaixin Powder (, n = 6)
化合物质量浓度/(ng·mL−1)日内日间 实测值/(ng·mL−1)准确度/%精密度/%实测值/(ng·mL−1)准确度/%精密度/% α-细辛醚2.02.11±0.08105.583.852.06±0.02103.091.17 5.05.06±0.12101.302.445.13±0.04102.580.72 50.052.10±2.60104.204.9952.25±1.96104.503.75 400.0400.92±12.03100.233.00411.56±18.68102.894.54 β-细辛醚1.01.00±0.07100.177.271.01±0.02101.392.23 2.01.94±0.1496.927.121.99±0.0699.923.18 50.051.13±1.14102.262.2250.96±0.64101.911.25 800.0775.60±26.1496.953.37771.92±28.0296.493.63 去氢土莫酸2.02.07±0.10103.334.952.04±0.03101.751.60 5.05.03±0.08100.631.505.03±0.03100.580.55 50.051.32±1.62102.633.1653.71±2.73107.425.08 400.0389.56±6.5897.391.69389.68±12.4797.423.20 松苓新酸10.010.46±0.61104.625.8410.44±0.42104.394.02 20.020.47±0.73102.343.5720.44±0.08102.210.39 100.0103.95±1.37103.951.32104.21±1.32104.211.27 400.0407.16±7.25101.791.78398.52±7.6999.631.93 茯苓新酸A2.02.06±0.08103.254.072.09±0.04104.531.72 5.05.26±0.27105.105.135.16±0.19103.273.68 50.051.42±1.90102.843.7054.22±2.67108.444.93 400.0414.00±11.84103.502.86395.92±21.5898.985.45 茯苓新酸B2.02.04±0.12101.836.042.22±0.21111.199.27 5.05.06±0.16101.203.225.14±0.10102.721.98 50.051.67±1.66103.343.2253.60±1.70107.203.18 400.0396.72±10.9099.182.77385.00±16.7996.254.36
表4 开心散待测成分的稳定性(, n = 6)
Table 4 Stability of analytes of Kaixin Powder (, n = 6)
化合物质量浓度/(ng·mL−1)室温放置24 h−80 ℃冻存7 d反复冻融3次 实测值/(ng·mL−1)准确度/%精密度/%实测值/(ng·mL−1)准确度/%精密度/%实测值/(ng·mL−1)准确度/%精密度/% α-细辛醚5.05.16±0.01103.200.195.04±0.05100.870.985.10±0.16101.933.05 50.051.92±0.89103.831.7150.44±2.07100.874.1049.48±2.2798.964.58 400.0396.56±10.1999.142.57395.56±16.2298.894.10370.96±2.5692.740.69 β-细辛醚2.01.97±0.2198.3310.472.02±0.08101.174.142.02±0.10100.834.89 50.051.22±1.15102.432.2451.15±1.87102.313.6651.80±1.32103.612.55 800.0787.84±11.2798.481.43749.68±18.1493.712.42860.80±29.18107.603.39 去氢土莫酸5.05.06±0.04101.270.755.04±0.05100.871.025.01±0.13100.132.53 50.052.94±0.98105.871.8552.00±1.59104.013.0551.46±1.38102.932.68 400.0405.76±4.75101.441.17382.00±9.3695.502.45402.04±12.10100.513.01 松苓新酸20.020.81±0.35104.051.6920.18±0.14100.900.6719.76±0.1298.780.59 100.0105.66±2.74105.662.59105.30±3.34105.303.1799.79±2.9499.792.95 400.0393.88±3.2798.470.83395.88±7.3298.971.85394.48±7.3498.621.86 茯苓新酸A5.05.12±0.13102.472.525.44±0.15108.802.715.31±0.34106.136.44 50.050.10±2.24100.204.9452.74±1.92105.493.6451.14±3.97102.287.77 400.0401.48±13.53100.373.37383.00±13.7195.753.58402.04±12.10100.513.01 茯苓新酸B5.05.03±0.15100.602.945.15±0.05103.000.895.31±0.05106.201.00 50.053.02±1.74106.033.2949.22±0.3698.450.7351.36±3.10102.736.03 400.0389.68±10.1797.422.61381.32±8.7795.332.30 388.23±6.1397.071.58
表5 开心散待测成分的提取回收率和基质效应(, n = 6)
Table 5 Recovery and matrix effect of analytes of Kaixin Powder (, n = 6)
化合物质量浓度/(ng·mL−1)提取回收率/%基质效应/% α-细辛醚5.095.07±3.0893.39±6.35 50.088.12±2.5984.37±2.88 400.086.72±3.1080.50±1.27 β-细辛醚2.090.81±2.1498.01±6.88 50.090.86±1.5887.54±1.91 800.089.46±2.3584.87±2.11 去氢土莫酸5.097.47±6.60100.28±1.24 50.094.31±3.3996.95±2.57 400.096.83±1.6499.69±2.51 松苓新酸20.087.50±2.5690.41±2.48 100.090.85±1.4580.88±1.27 400.097.08±2.5692.69±0.95 茯苓新酸A5.086.50±3.1491.54±4.17 50.090.71±4.0791.19±4.47 400.095.95±5.6296.65±2.20 茯苓新酸B5.086.36±2.1192.16±6.08 50.092.85±4.6493.93±5.58 400.096.29±4.7498.00±3.99
4 讨论
4.1 目标成分选择
基于复方配伍药味相关文献参考分析[29-30],本研究在初期选择开心散中人参皂苷类成分(人参皂苷Rg1、人参皂苷Rb1和人参皂苷Re)、远志𠮿酮类成分(远志𠮿酮III)、寡糖酯类成分(3,6′-二芥子酰基蔗糖)、细辛醚类成分(α-细辛醚和β-细辛醚)、茯苓三萜酸类成分(去氢土莫酸、松苓新酸、茯苓新酸A和茯苓新酸B)作为药动学检测的目标成分,但由于开心散中人参和远志的配伍比例比较低,导致人参皂苷Rg1、人参皂苷Rb1、人参皂苷Re、3,6′-二芥子酰基蔗糖和远志𠮿酮III等在复方中的含量较低,因此在血浆样品中其含量低于LLOQ,未能被准确定量。本研究最终以α-细辛醚、β-细辛醚、去氢土莫酸、松苓新酸、茯苓新酸A和茯苓新酸B为检测成分进行开心散的药动学表征。
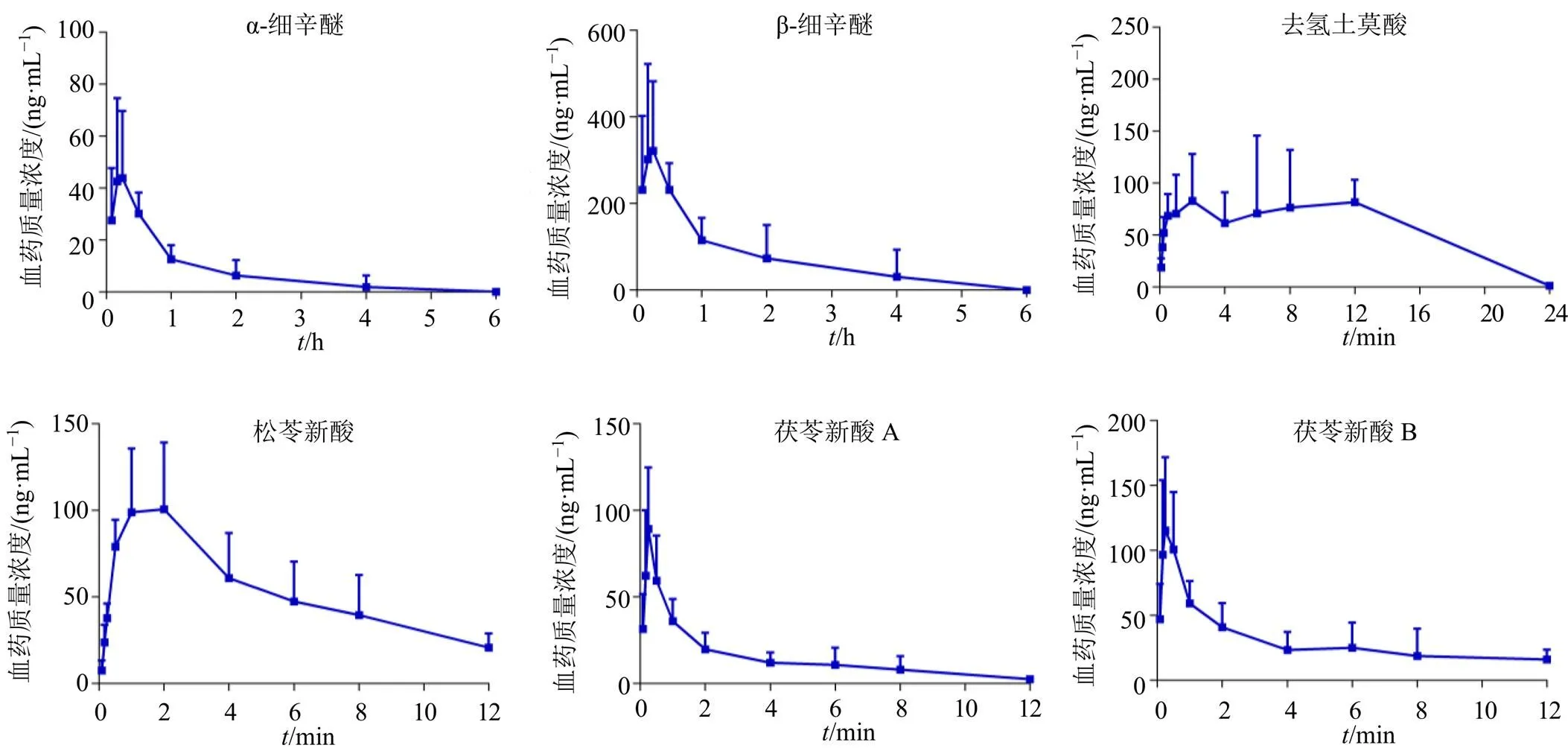
图4 AD模型大鼠ig开心散后待测成分的平均血药浓度-时间曲线(, n = 6)
表6 AD模型大鼠ig开心散后待测成分的药动学参数(, n = 6)
Table 6 Pharmacokinetic parameters of analytes in AD rats after ig Kaixin Powder (, n = 6)
参数单位α-细辛醚β-细辛醚去氢土莫酸松苓新酸茯苓新酸A茯苓新酸B tmaxh0.26±0.120.21±0.053.92±4.411.25±0.610.28±0.110.24±0.03 Cmaxng·mL−135.88±5.81269.00±45.30120.38±53.68114.88±37.1991.56±36.28117.30±54.65 AUC0~tng·mL−1·h38.52±13.01329.20±106.131 373.54±530.78640.55±187.42193.15±59.51398.54±137.70 AUC0~∞ng·mL−1·h39.92±13.19354.17±111.261 381.30±530.43795.20±208.57213.27±49.45498.05±210.28 t1/2h0.54±0.250.65±0.243.57±1.045.43±2.253.90±1.677.99±2.88 MRT0~th0.91±0.580.77±0.308.53±1.014.49±0.783.19±0.865.18±0.49 MRT0~∞h0.99±0.570.97±0.378.67±1.047.88±2.494.14±1.0110.92±6.04 CLz/FL·h−1·kg−132.63±18.7038.87±20.721.55±0.490.16±0.050.46±0.130.25±0.11 Vz/FL·kg−121.73±7.0535.00±15.918.43±4.651.35±0.913.26±2.212.21±1.63
4.2 检测条件优化与样品处理优化
通过比较正负离子模式下各成分的响应,本研究选择了响应更高的离子模式进行检测:α-细辛醚和β-细辛醚在正离子模式下检测;去氢土莫酸、松苓新酸、茯苓新酸A和茯苓新酸B在负离子模式下进行检测。不同检测离子模式下需要选用不同的内标成分,本研究选择盐酸丁螺环酮作为正离子模式下的内标成分,选择斯皮诺素作为负离子模式下的内标成分。
通过对比使用水-甲醇、水-乙腈作为流动相时各成分的响应,发现各成分在甲醇作为有机相时响应更高;在流动相中加入0.1%甲酸水溶液后成分峰形有所优化,最终选定以0.1%甲酸水溶液和0.1%甲酸甲醇溶液为流动相。
处理血浆样品处理时,为保证蛋白沉淀完全,本研究选择50 μL血浆中加入150 μL甲醇-乙腈混合溶液(1∶1)进行样品处理。此外,由于血浆样品中成分含量较低,本研究取沉淀蛋白所得上清液定量,氮吹浓缩,残渣用50 μL甲醇复溶,离心取上清液进样测定。
4.3 AD大鼠模型的建立与评价
AD是一种以β淀粉样蛋白沉积形成的“老年斑”与Tau蛋白磷酸化形成的神经纤维缠结为主要特征的神经退行性疾病,其发病机制较为复杂,目前相关假说多样包括有Aβ沉积学说、胆碱能学说、Tau蛋白假说、氧化应激学说、神经血管学说等[31-33],其中Aβ沉积学说占据主要地位。本课题组前期研究表明,开心散可在一定程度上改善AD模型动物(/转基因小鼠)的Aβ沉积,因此,本研究选择基于Aβ沉积相关的AD大鼠模型进行药动学研究。目前研究表明,采用Aβ1-42脑内定位注射方法建立的AD大鼠模型稳定,可重复且操作简便[23,33]。因此,本研究选用该方法进行AD大鼠模型建立,并采用AD动物模型的经典评价指标Morris水迷宫实验[31-32]进行AD大鼠模型的评价。
4.4 开心散各成分的药动学特征分析
α-细辛醚和β-细辛醚互为同分异构体,化学结构相似,因而两者体内过程相似,多个药动学参数值相近,药动学参数表明ig开心散后α-细辛醚和β-细辛醚均迅速吸收进入体内并且消除较快,成分的体内变化趋势与文献报道相近[34-35]。在本研究中,两者在达峰浓度(max)和曲线下面积(AUC)值的差异较大,推测其主要原因为复方中成分含量差异较大。文献报道[34]大鼠ig石菖蒲挥发油提取物后α-细辛醚和β-细辛醚的max分别为(1.42±0.18)、(1.58±0.18)h,而本研究中大鼠ig开心散后α-细辛醚和β-细辛醚的max分别为(0.26±0.12)、(0.21±0.05)h,这提示开心散配伍可能促进α-细辛醚和β-细辛醚吸收。
去氢土莫酸与松苓新酸均为羊毛甾-7,9(11)-二烯型三萜,其药动学过程存在相似性,即呈现消除缓慢的现象。Zhang等[36]进行了茯苓醇提物的成分药动学研究,结果显示去氢土莫酸为单峰吸收,而本研究中去氢土莫酸体内过程呈现双峰现象,这与Xiao等[37]研究中显示去氢土莫酸在茯苓提取物给药后单峰吸收、制剂给药后呈现双峰吸收结果相近,推测这一结果可能是由于肝肠循环[38]。本研究中松苓新酸的体内过程呈现单峰吸收、消除缓慢的现象,与文献报道[36,38]相近。另外,开心散中去氢土莫酸的含量是松苓新酸的15.8倍,但是去氢土莫酸和松苓新酸的max值接近,这一结果提示松苓新酸可能为更易被吸收的成分,值得关注。
茯苓新酸A和茯苓新酸B均为3,4-开环-羊毛甾-7,9(11)-二烯型三萜,ig开心散后,2成分均被迅速吸收入血并且消除较慢,与文献报道[36,38]相近。复方中,这2种成分的含量相近,但茯苓新酸B的max值、AUC值、平均滞留时间(MRT)值等参数均高于茯苓新酸A,这一结果提示茯苓新酸B可能更易被吸收入血,从而在体内发挥作用。另外,本研究结果显示给药开心散后松苓新酸、茯苓新酸A和茯苓新酸B的达峰时间均低于文献报道[36]中给予茯苓醇提物后各成分达峰时间,这提示开心散复方可能促进茯苓三萜酸类成分吸收。
综上所述,本研究建立了同时测定大鼠血浆中开心散主要成分含量的UPLC-MS/MS方法,并将该方法成功地应用于开心散在AD模型大鼠体内的药动学研究。本研究明确了AD疾病状态下开心散中α-细辛醚、β-细辛醚、去氢土莫酸、松苓新酸、茯苓新酸A和茯苓新酸B这6种成分的体内药动学特征,为明确开心散的体内物质基础提供参考,并为开心散的临床应用以及后续研究提供借鉴。
利益冲突 所有作者均声明不存在利益冲突
[1] 唐·孙思邈著, 冯文全审校. 备急千金要方[M]. 太原: 山西科学技术出版社, 2019: 275.
[2] 日·丹波康赖撰, 高文柱校注. 医心方 [M]. 北京: 华夏出版社, 2011: 552.
[3] 明·许浚. 东医宝鉴 [M]. 太原: 山西科学技术出版社, 2014: 36.
[4] 明·张介宾著. 景岳全书(下) [M]. 上海: 第二军医大学出版社, 2006: 1251.
[5] Cao C, Xiao J Y, Liu M Q,. Active components, derived from Kai-Xin-San, a herbal formula, increase the expressions of neurotrophic factor NGF and BDNF on mouse astrocyte primary cultures via cAMP-dependent signaling pathway [J]., 2018, 224: 554-562.
[6] Wang N, Jia Y M, Zhang B,. Kai-Xin-San, a Chinese herbal decoction, accelerates the degradation of β-amyloid by enhancing the expression of neprilysin in rats [J]., 2020, 2020: 3862342.
[7] Yi P J, Zhang Z Y, Huang S Q,. Integrated meta-analysis, network pharmacology, and molecular docking to investigate the efficacy and potential pharmacological mechanism of Kai-Xin-San on Alzheimer’s disease [J]., 2020, 58(1): 932-943.
[8] Nishiyama N, Zhou Y, Takashina K,. Effects of DX-9386, a traditional Chinese preparation, on passive and active avoidance performances in mice [J]., 1994, 17(11): 1472-1476.
[9] 王彬斌, 冯晓晓, 恩特扎尔·别尔克, 等. 开心散对APP/PS1小鼠神经炎症和Aβ沉积的作用研究[J]. 中草药, 2021, 52(24): 7511-7519.
[10] 韩国柱. 中草药药代动力学 [M]. 北京: 中国医药科技出版社, 1999: 3-7.
[11] Wang W, Liao Q P, Quan L H,. The effect ofon the bioavailabilities and brain concentrations of ginsenosides Rg1, Re and Rb1after oral administration of Kai-Xin-San preparations in rats [J]., 2010, 131(2): 313-320.
[12] Wang X T, Zhang Y, Niu H B,. Ultra-fast liquid chromatography with tandem mass spectrometry determination of eight bioactive components of Kai-Xin-San in rat plasma and its application to a comparative pharmacokinetic study in normal and Alzheimer’s disease rats [J]., 2017, 40(10): 2131-2140.
[13] Zhang X W, Li Q, Lv C X,. Characterization of multiple constituents in Kai-Xin-San prescription and rat plasma after oral administration by liquid chromatography with quadrupole time-of-flight tandem mass spectrometry [J]., 2015, 38(12): 2068-2075.
[14] Lv C X, Li Q, Zhang X W,. Simultaneous quantitation of polygalaxanthone III and four ginsenosides by ultra-fast liquid chromatography with tandem mass spectrometry in rat and beagle dog plasma after oral administration of Kai-Xin-San: Application to a comparative pharmacokinetic study [J]., 2014, 37(9/10): 1103-1110.
[15] Lv C X, Li Q, Zhang Y W,. A UFLC-MS/MS method with a switching ionization mode for simultaneous quantitation of polygalaxanthone III, four ginsenosides and tumulosic acid in rat plasma: Application to a comparative pharmacokinetic study in normal and Alzheimer’s disease rats [J]., 2013, 48(8): 904-913.
[16] 巴寅颖, 姜艳艳, 刘洋, 等. 基于远志酮在记忆障碍模型大鼠体内药代动力学特性的远志及开心散药物属性研究 [J]. 北京中医药大学学报, 2012, 35(8): 549-553.
[17] 巴寅颖, 姜艳艳, 刘洋, 等. 基于3,6′-二芥子酰基蔗糖在记忆障碍模型大鼠体内表征的单体、远志及其经典方开心散药代动力学 [J]. 中国实验方剂学杂志, 2012, 18(14): 138-142.
[18] 巴寅颖, 姜艳艳, 吴霞, 等. 基于西伯利亚远志糖A5、A6体内表征的开心散与远志及单体药代动力学关联分析 [J]. 北京中医药大学学报, 2015, 38(10): 703-708.
[19] Cao C, Xiao J Y, Liu M Q,. Active components, derived from Kai-Xin-San, a herbal formula, increase the expressions of neurotrophic factor NGF and BDNF on mouse astrocyte primary cultures via cAMP-dependent signaling pathway [J]., 2018, 224: 554-562.
[20] Zhu Y, Chao C, Duan X Z,. Kai-Xin-San series formulae alleviate depressive-like behaviors on chronic mild stressed mice via regulating neurotrophic factor system on hippocampus [J]., 2017, 7(1): 1467.
[21] Zhu Y, Duan X Z, Cheng X X,. Kai-Xin-San, a standardized traditional Chinese medicine formula, up-regulates the expressions of synaptic proteins on hippocampus of chronic mild stress induced depressive rats and primary cultured rat hippocampal neuron [J]., 2016, 193: 423-432.
[22] Smriga M, Saito H, Nishiyama N. Hoelen (Wolf) and ginseng (C. A. Meyer), the ingredients of a Chinese prescription DX-9386, individually promote hippocampal long-term potentiation[J]., 1995, 18(4): 518-522.
[23] Wang B B, Feng X X, Liu S H,. Comprehensive quality assessment of Kaixin Powder by HPLC-DAD quantification and HPLC-QTOF-MS/MS confirmation [J]., 2021, 6(17): 11319-11326.
[24] Wang X Y, Sun G Q, Feng T,. Sodium oligomannate therapeutically remodels gut microbiota and suppresses gut bacterial amino acids-shaped neuroinflammation to inhibit Alzheimer’s disease progression [J]., 2019, 29(10): 787-803.
[25] Zhao N N, Sun C X, Zheng M,. Amentoflavone suppresses amyloid β1-42neurotoxicity in Alzheimer’s disease through the inhibition of pyroptosis [J]., 2019, 239: 117043.
[26] George Paxinos, Charles Watson. 大鼠脑立体定位图谱 [M]. 诸葛启钏主译. 北京: 人民卫生出版社, 2005: 2-9.
[27] Facchinetti R, Bronzuoli M R, Scuderi C. An animal model of Alzheimer disease based on the intrahippocampal injection of amyloid β-peptide(1-42) [J]., 2018, 1727: 343-352.
[28] Xiong W, Zhao X Q, Xu Q,. Qisheng Wan Formula ameliorates cognitive impairment of Alzheimer’s disease rat via inflammation inhibition and intestinal microbiota regulation [J]., 2022, 282: 114598.
[29] Yi P J, Zhang Z Y, Huang S Q,. Integrated meta-analysis, network pharmacology, and molecular docking to investigate the efficacy and potential pharmacological mechanism of Kai-Xin-San on Alzheimer’s disease [J]., 2020, 58(1): 932-943.
[30] 毕婷婷, 战丽彬, 张栎婧. 基于中药整合药理学平台探究开心散治疗AD的物质基础与作用机制 [J]. 中国实验方剂学杂志, 2019, 25(16): 135-141.
[31] Scheltens P, de Strooper B, Kivipelto M,. Alzheimer’s disease [J]., 2021, 397(10284): 1577-1590.
[32] Hodson R. Alzheimer’s disease [J]., 2018, 559(7715): S1.
[33] Faborode O S, Dalle E, Mabandla M V. Exposure to footshock stress downregulates antioxidant genes and increases neuronal apoptosis in an Aβ(1-42) rat model of Alzheimer’s disease [J]., 2021, 150: 105170.
[34] Wang Z B, Wang Q H, Yang B Y,. GC-MS method for determination and pharmacokinetic study of four phenylpropanoids in rat plasma after oral administration of the essential oil ofSchott rhizomes [J]., 2014, 155(2): 1134-1140.
[35] 胡奎, 苏梦, 徐鑫, 等. 石菖蒲挥发油β-环糊精、羟丙基-β-环糊精包合物在大鼠体内药代动力学研究 [J]. 中药新药与临床药理, 2017, 28(2): 187-190.
[36] Zhang J, Guo H M, Yan F L,. An UPLC-Q-Orbitrap method for pharmacokinetics and tissue distribution of four triterpenoids in rats after oral administration ofethanol extracts [J]., 2021, 203: 114237.
[37] Xiao F, Li Q, Liang K,. Comparative pharmacokinetics of three triterpene acids in rat plasma after oral administration ofextract and its formulated herbal preparation: GuiZhi-FuLing Capsule [J]., 2012, 83(1): 117-124.
[38] Qian Q, Zhou N, Qi P C,. A UHPLC-QTOF-MS/MS method for the simultaneous determination of eight triterpene compounds from(Schw.) Wolf extract in rat plasma: Application to a comparative pharmacokinetic study [J]., 2018, 1102-1103: 34-44.
Pharmacokinetic study of Kaixin Powder in rats with Alzheimer’s disease
FENG Xiao-xiao, WANG Bin-bin, CHEN Dong, QIU Feng, GONG Mu-xin, LI Zhao-xia
Beijing Key Laboratory of TCM Collateral Disease Theory Research, School of Traditional Chinese Medicine, Capital Medical University, Beijing 100069, China
To characterize the pharmacokinetic behavior of the analytes of Kaixin Powder (开心散) in Alzheimer’s disease (AD) rats induced by oligomeric β amyloid protein 1-42 (Aβ1-42), and establish and verify an ultra-high performance liquid chromatography-tandem mass spectrometry (UPLC-MS/MS) method for simultaneous determination of components of Kaixin Powder in rat plasma.Rats model of AD was established by bilateral hippocampal injection of oligomeric Aβ1-42. Kaixin Powder was administered by single ig, blood was collected at different time points, and plasma concentrations of ingredients were determined. DAS 2.0 software was used to fit non-compartmental models to calculate pharmacokinetic parameters.The established UPLC-MS/MS method in terms of precision, accuracy, extraction recovery, matrix effect and stability and other methodological investigation results all met the determination requirements of biological sample analysis. The results of Morris water maze test confirmed that AD rats model was successfully constructed (< 0.05). After administration of Kaixin Powder, pharmacokinetic parameters of analytes with similar structure were similar, such as α-asarone and β-asarone belonging to isomers, dehydrotumulosic acid and dehydrotrametenolic acid belonging to lanosta-7,9(11)-diene type triterpenes, poricoic acid A and poricoic acid B belonging to 3,4-seco-lanostan-7,9(11)- diene type triterpenes.maxand1/2of α-asarone and β-asarone were short which showed a rapid absorption and elimination.maxof poricoic acid A and poricoic acid B were short but1/2of them were long, suggesting a rapid absorption and slow elimination;maxand1/2of dehydrotumulosic acid and dehydrotrametenolic acid were long, so the absorption and elimination rates of these compounds were slow. Moreover, dehydrotumulosic acid played a double-peak phenomenon and MRT of it was long. This might be caused by the enterohepatic circulation, and time of dehydrotumulosic acidcould be prolonged.Thepharmacokinetic process of the analytes of Kaixin Powder in AD rats is revealed, which can provide reference for clarifying theprocess of Kaixin Powder and its subsequent research and development.
Kaixin Powder; Alzheimer’s disease; pharmacokinetics; UPLC-MS/MS; oligomeric Aβ1-42; α-asarone; β-asarone; poricoic acid A; poricoic acid B; dehydrotumulosic acid; dehydrotrametenolic acid
R285.61
A
0253 - 2670(2022)14 - 4388 - 11
10.7501/j.issn.0253-2670.2022.14.018
2022-03-07
北京市自然科学基金面上项目(7182019);北京市青年拔尖人才培育计划项目(CIT&TCD201504098)
冯晓晓,硕士研究生,研究方向为中药体内过程和作用机制研究。E-mail: ccmufxx@163.com
李朝霞,副教授,研究方向为中药体内过程和作用机制研究。E-mail: gmacli@ccmu.edu.cn
[责任编辑 李亚楠]
