珍稀中药资源金平人参的研究与利用
2022-07-22李晓波姜薇薇张广辉邓自有田兴智郭巧生杨生超
李晓波 ,姜薇薇 ,张广辉,邓自有,王 淞,田兴智,郭巧生,杨生超*
1. 云南农业大学 云南省药用植物生物学重点实验室/西南中药材种质创新与利用国家地方联合工程研究中心,云南 昆明 650201 2. 云南农业大学农学与生物技术学院,云南 昆明 650201 3. 云南农业大学理学院,云南 昆明 650201 4. 金平苗族瑶族傣族自治县人民政府,云南 红河 661599 5. 金平大健康药材有限公司,云南 红河 661599 6. 南京农业大学中药材研究所,江苏 南京 210095
珍稀中药资源金平人参的研究与利用
李晓波1,2,姜薇薇1,3,张广辉1,邓自有4,王 淞5,田兴智5,郭巧生6,杨生超1*
1. 云南农业大学 云南省药用植物生物学重点实验室/西南中药材种质创新与利用国家地方联合工程研究中心,云南 昆明 650201 2. 云南农业大学农学与生物技术学院,云南 昆明 650201 3. 云南农业大学理学院,云南 昆明 650201 4. 金平苗族瑶族傣族自治县人民政府,云南 红河 661599 5. 金平大健康药材有限公司,云南 红河 661599 6. 南京农业大学中药材研究所,江苏 南京 210095
金平人参Panax vietnamensis是一种珍贵的药用资源植物,分布于我国云南金平县一带以及越南的玉玲山和黄连山地区,野生资源稀缺,人工栽培初具规模。金平人参的化学成分主要为三萜皂苷类,目前已报道的皂苷类成分涉及奥克梯隆醇型、原人参二醇型、原人参三醇型、齐墩果酸型、C-17侧链变化型等共63个结构,其中奥克梯隆醇型皂苷珠子参苷R2含量最高,达5.3%。除此之外还有甾体皂苷、聚炔类、脂肪酸和氨基酸等成分。药理活性研究表明金平人参具有抗炎、抗肿瘤、抑制黑色素生成、肝肾保护、镇静安神等作用。对金平人参的资源现状、化学成分以及药理活性研究进行综述,以期为该植物的进一步开发利用提供依据。
金平人参;资源;三萜皂苷;珠子参苷R2;抗炎;抗肿瘤;抑制黑色素生成
五加科人参属植物Panax vietnamensisHa et Grushv.于1973年在越南中部的昆嵩省玉玲山被发现[1],在越南语中,它被称为sâm Ngọc Linh或Ngọc Linh ginseng或Vietnamese Ginseng,直译为玉玲人参或越南人参。我国的文献记载和资源调查显示,在云南省金平苗族瑶族傣族自治县、元阳县、绿春县等地天然分布着一种俗称“野三七”或“金平人参”的人参属植物[2-3],在民间医药中作为一种滋补上品,用于强身健体和多种疾病的治疗。现代植物分类研究表明,“金平人参”和越南人参为同一种植物[4]。在越南境内,该植物仅分布在玉玲山和黄连山海拔1700~2000 m的地区,分布区域狭小,加上过度采挖等破坏行为,它的野生资源逐年递减,在越南已经成为极度濒危的物种之一[5-6]。而中国已然是该种植物野生资源分布的中心和栽培的主产区,在资源供给中发挥重要作用。
现代研究表明,金平人参与人参属其他植物一样,都含有丰富的皂苷类成分,尤其以独特的奥克梯隆醇型皂苷最为主要,其中多个化合物表现出抗肿瘤、抗炎、保肝等多种多样的药理作用[7-9]。本文系统梳理金平人参的名称沿革以及资源状况,并综述该植物的化学成分和药理活性方面的研究进展,以期为该植物的进一步开发利用提供参考。
1 金平人参的名称沿革和资源状况
1.1 名称沿革
《蔡希陶传略》中记载:“1951年蔡希陶先生三次去金平进行资源调研,金平一带有野生三七,鲜品五角一篓,三斤左右。金平一带的野生三七同文山、西畴各县栽培的三七不一样,只是消费者很难辨别得出来,它们都以三七之名进行售卖”[10]。三七P. notoginseng(Burk.) F. H. Chen已有400多年的栽培历史,并且三七野生种早已灭绝,笔者推测蔡希陶先生在金平考察所见的“野生三七”应为三七的同属近源种“金平人参”而非它的野生种,这也与如今栽培的金平人参由“野生三七”仿野生栽培和驯化种植而来的现实相吻合。在《金平医药志》对1986年的中草药普查中,对金平县一般习用的4个三七混乱品种予以澄清,其中对“野三七”的描述为全国正品为人参科三七属的干燥块根,金平县习用同科植物珠子参的块根。而珠子参在云南省主要分布于滇西北部和滇东北海拔达3000~4000 m亚高山针叶林及阔叶林下,很少有海拔3000 m以下的分布[11-12]。另外金平县并没有三七的资源分布,根据珠子参和三七的地理分布,推测《金平医药志》(1991年)中描述的“野三七”则不应为“珠子参”或“三七”,而应为金平人参。1973年在越南中部昆嵩省玉玲山发现人参属的1个新种,1985年其拉丁学名被定名为P. vietnamensisHa et Grushv.,在越南语中,它被称为sâm Ngọc Linh或Vietnamese Ginseng,直译为玉玲人参或越南人参。Zhu等[2]2003年对采自云南金平县三棵树村的“野三七”模式标本鉴定为P. vietnamensisvar.fuscidiscusK. Komatsu,S. Zhu amp; S. Q. Cai,但该模式标本于2012年被修订为P. vietnamensis的同物异名[4]。
通过上述文献调研,发现“野三七”的名称在中国由来已久,并且分布在金平的“野三七”与“越南人参”是同一物种。为更直接地与三七相区别,凸显其地域分布特点,同时“保护并利用”本国的植物资源,将P. vietnamensisHa et Grushv.的中文名称拟为“金平人参”。
1.2 资源状况
金平人参具有很高药用价值和经济价值,而其资源现状却不容乐观。
在越南,金平人参作为国家民族品牌被广泛认可,对它的资源保护却面临重重危机。早在1980年起,越南就兴建了国家自然保护区来保存金平人参的野生种质资源。但保护区并未真正发挥保护的作用,金平人参野生资源仍然快速减少,并于1996年作为濒危种列入越南红皮书,到2006年更是恶化为极度濒危种,是越南250种珍稀、濒危或濒临灭绝的物种之一[5-6]。在规模化种植方面,尽管2011年越南已经解决了金平人参组织培养扩繁技术,并进行了移栽实验,但是在愈伤组织分化、外植体制备以及在最佳培养条件等方面依然存在困难,此外其不定根中皂苷成分积累少,限制了组织培养扩繁技术的推广示范[13-14]。
在我国,金平人参主要分布于云南红河州南部的金平苗族瑶族傣族自治县、元阳县、绿春县等地[3]。它喜在林下阴湿处生长,常沿山林小溪背阴面聚生。本研究团队于2010~2011年多次在金平县开展资源调查,在金平县铜厂乡铜厂村委会炭山村林下草果地旁、阿得博乡阿得博村委会雷打树村山林等地均发现野生金平人参的分布。
在对金平人参资源调研过程中还了解到,当地长久以来一直有村民以采挖金平人参为副业。金平县铜厂乡村民从1993年就开始进行金平人参的野生抚育和仿生栽培。2005年起金平县各乡镇掀起种植金平人参的热潮,但因销路、偷盗及技术不成熟种种原因,当时仅有少量散户以小面积种植。越南对金平人参有很大的需求,但越南尚不能实现对金平人参的规模化种植,资源瓶颈问题难以解决,对金平人参的需求依赖于从我国进口。2010年,随着中越互市流通的加强,越南药商对金平人参每公斤的收购价突破千元;2017年,交易价格上涨到1000~3000美元/kg[15]。需求和价值的不断上涨极大地刺激了金平人参的产业发展。截至2020年年底,金平县境内种植面积约53 hm2,其中金平县铜厂乡种植面积约33 hm2,是金平人参的核心种植区。
遗憾的是,金平人参未被收录到《中国植物志》及《中国药典》各版中。金平人参在我国国内有不同的名称,如金平人参、野三七、越南人参、野生三七、越南三七、金平黑人参。为了使金平人参更好的有序健康发展,需要进一步统一其中文俗名,并确认、宣传与推广。将P. vietnamensisHa et Grushv.的中文名称拟为“金平人参”,并且金平县以该名称成功申报了2020年国家地理标志“金平人参”。
国内金平人参当前主要通过中越边境的边民互市销往越南,人工种植鲜品收购价格高达8000元/kg,野生金平人参价格更是超过万元,但在国内市场却一片空白,尚未引起重视和采取有效的保护措施,仅在越南对金平人参需求以及高价利润的驱使下,金平人参的野生资源遭到肆虐采挖,野生资源堪忧,迫切需要采取一定措施来保护这一重要的野生资源并发展其规模化、规范化的种植以及更深入的研究与开发工作。
2 金平人参的化学成分
2.1 皂苷类成分
金平人参与人参、三七、西洋参一样,含有人参皂苷Rb1、Rb2、Rc、Rd、Re、Rg1、Rh1、三七皂苷R1、R2和西洋参皂苷R1等成分[16-19]。从含量上看,金平人参中总皂苷的含量显著高于人参属其它植物,其中以奥克梯隆醇型皂苷最为主要,质量分数高达5.6%,占总皂苷的一半以上[7,20-22]。人参、三七、西洋参和金平人参根茎部位的原人参二醇型、原人参三醇型和奥克梯隆醇型、齐墩果酸型皂苷的含量比较见表1[8]。
根据皂苷母核结构类型及其R1、R2、R3取代基团的不同可将金平人参中三萜皂苷化合物分为奥克梯隆醇型(ocotillol type,OT)、原人参二醇型(protopanaxadiol type,PPD)、原人参三醇型(protopanaxatriol type,PPT)、齐墩果酸型(oleanolic acid type,OA)、C-17侧链变化型(C-17 side-chain varied type)以及其他类型等。目前对金平人参的化学成分研究,主要在根茎中部位,对其地上部分研究未见报道。从金平人参中分离得到的63个三萜化合物见表2[7,9,23-28]。本研究团队也开展了金平人参根茎中化学成分的分离,鉴定了13个人参皂苷类成分,并首次从中获得人参皂苷Rs3、20(R)-人参皂苷Rh1、三七皂苷R2、floralginsenoside A[28]。三萜皂苷类的结构母核及糖苷配基见图1。
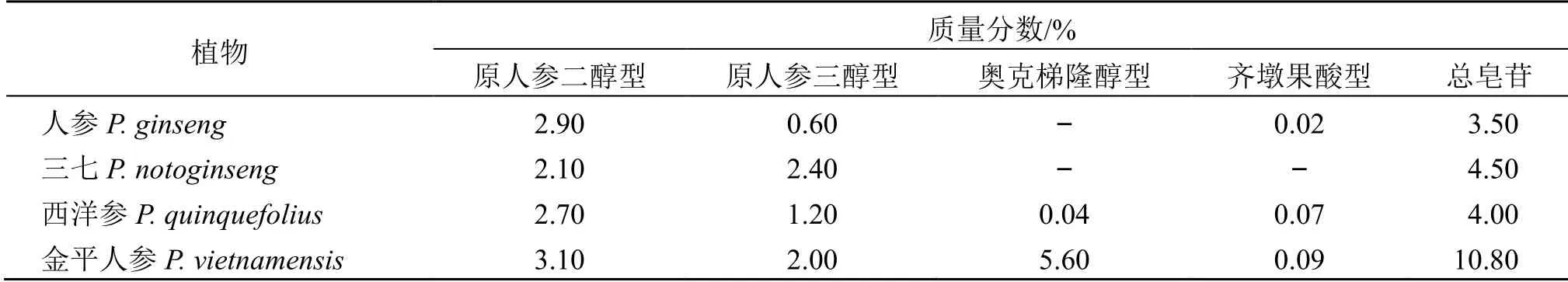
表1 金平人参与人参、三七、西洋参中皂苷含量比较Table 1 Comparison of the saponin content of P. vietnamensis and P. ginseng, P. notoginseng, P. quinquefolius

表2 金平人参中皂苷类化合物Table 2 Saponins from P. vietnamensis

续表2
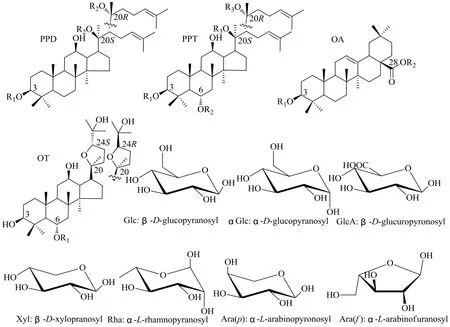
图1 金平人参中4种常见皂苷元及糖苷配基Fig. 1 Structures of four most common sapogenins and monosugars in the saponins isolated from P. vietnamensis
从金平人参中分离的、命名被冠以vina-前缀的新颖皂苷vinaginsenoside R1~R25是金平人参中特有的成分。其中vinaginsenoside R3(61)在C-12位去羟基化,是自然界罕见的达玛烯二醇糖苷化合物;vinaginsenoside R4(37)是为数不多的在C-3位具有糖基取代的原人参三醇型皂苷;vinaginsenoside R5(7)和vinaginsenoside R6(8)是为数不多的具有α-糖苷键的皂苷的新例,化合物8的初级葡萄糖呈现1个分支的三糖基糖链,初级葡萄糖的C-2′和C-6′位点有分别有2个糖基取代[23];vinaginsenoside R23(62)在C-5和C-6位之间脱水形成双键,C-7位进一步羟基化,形成新的皂苷元结构[25]。关于这些新皂苷的药理活性需要进一步的研究。
2.1.1 OT OT型皂苷是一类侧链具有四氢呋喃环的四环三萜类皂苷,属于稀有人参皂苷,目前从人参属植物共鉴定出16个奥克梯隆醇型皂苷[19,28],其中从金平人参中鉴定出9个该类型化合物,见图2。拟人参皂苷Rt4(1)最早从羽叶三七中分离得到[29];拟人参皂苷F11(2)在西洋参全株中均含有,其中花蕾部位含量最高[30];珠子参苷R1(3)、珠子参苷R2(4)最早从珠子参中分离得到[31];vinaginsenosides R1(5)、vinaginsenosides R2(6)、vinaginsenosides R5(7)、vinaginsenosides R6(8)仅从金平人参中分离得到。到目前为止,人参中仅从其茎叶部位分离得到1个OT型皂苷——拟人参皂苷Rt5[32];三七中未见OT型皂苷的报道。
OT型皂苷是金平人参的主要成分,特别是珠子参苷R2(4),含量高达5.3%,占总皂苷含量的一半以上[7,20-22]。本课题组前期使用Illumina HiSeqTM2000平台进行了金平人参的转录组测序分析[33],并对珠子参苷R2(4)的生物合成途径进行了预测,鲨烯环氧酶和氧化鲨烯环化酶可能具有“新功能”参与奥克梯隆醇苷元的合成,后经细胞色素氧化酶和糖基转移酶修饰生成化合物4,其合成代谢途径解析工作正在进行。
近年来关于C-20位不连糖基的人参皂苷(如人参皂苷Rg3、Rh2、Rg2和Rh1)体外代谢的研究表明,这些人参皂苷及其苷元在动物肝脏微粒体酶的作用下其C-24和C-25之间的双键易被氧化,从而生成C-20和C-24环氧的奥克梯隆型代谢产物[34-35]。据此,有学者认为C-20位不连糖基的人参皂苷及其苷元(PPD和PPT)在体内代谢成相应的奥克梯隆型人参皂苷或苷元,推测这些奥克梯隆型人参皂苷才是在体内发挥作用的真正有效成分。体内的代谢结果显示,大鼠口服20(S)-原人参二醇后在血浆中检测到其相应的奥克梯隆型苷元[36]。因此需要对该类成分进行更全面深入地研究。
2.1.2 PPD 金平人参中PPD型皂苷的结构具有3个明显的特征:(1)C-3和/或C-20的糖基化位点;(2)糖基链呈线性连接;(3)在3-糖链的末端葡萄糖的6-OH发生酰化反应。目前已报道的金平人参中原人参二醇型皂苷见图2,其中大部分具有20(S)构型。绞股蓝皂苷IX和绞股蓝皂苷XVII则是由葫芦科的绞股蓝Gymnostemma pentaphyllumMakino中首次分离得到[37-38]。
2.1.3 PPT 金平人参PPT型皂苷的结构具有3个明显的特征:(1)常见于C-6和/或C-20的糖基化修饰;(2)最多两个糖基链;(3)糖基链的线性连接。但也有例外,vinaginsenoside R4(37)是为数不多的在C-3处具有糖取代的PPT型皂苷。目前已报道的金平人参中PPT型皂苷见图2,其中大部分具有20(S)构型。
2.1.4 齐墩果酸型(oleanolic acid type,OA) 目前从金平人参中得到人参皂苷R0(39)和雪胆皂苷Ma3(40)2种OA型皂苷,见图3。其中雪胆皂苷Ma3最先是从葫芦科植物罗锅底Hemsleya macrospermaC. Y. Wu中分离得到[39],它从金平人参中被分离尚属人参植物中的首例。
2.1.5 C-17侧链变化型(C-17 side-chain varied type) C-17侧链不同的皂苷是新分离皂苷的另一重要的亚型。侧链的变化主要包括羟化、过氧化、羰基化、脱氢、环化、氧化(在双键位置)、重排、或2个及以上的上述反应,其中羟化、环化是最常见的衍生类型。另外,对于经热处理的金平人参,C-20的OH容易发生脱水反应,产生稀有人参皂苷Rk1、Rg5、Rk3、Rh4[26-27]。C-17侧链变化型皂苷的结构见图4。
2.1.6 其他类型 除了上述5个亚型外,从金平人参植物中还发现了由不同寻常的皂苷元组成的皂苷。vinaginsenoside R3(61)在C-12去羟基化,是自然界很罕见的达玛烯二醇糖苷化合物[23]。vinaginsenoside R23(62)在C-5和C-6之间的脱水形成双键,进一步的C-7羟基化,形成新的皂苷元结构[25]。β-胡萝卜苷(63)是从金平人参中发现的甾体类化合物。结构见图5。
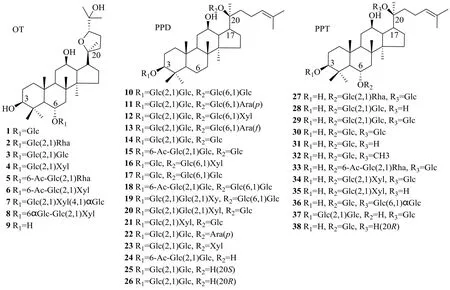
图2 奥克梯隆醇 (OT)、原人参二醇 (PPD)、原人参三醇 (PPT) 型化合物(1~38)的结构Fig. 2 Structures for compounds 1–38 classified into the ocotillol (OT), protopanaxadiol (PPD), protopanaxatriol (PPT)subtypes
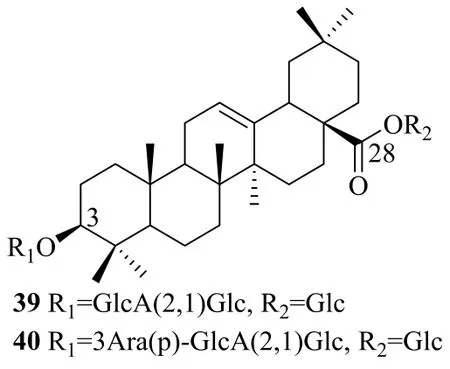
图3 金平人参中齐墩果酸型皂苷类化合物Fig. 3 Oleanolic acid type saponins isolated from P.vietnamensis
2.2 聚炔类化合物
从金平人参的地下部分分离到镰叶芹醇、10-乙酰基-十七烷-1,8(E)-二烯-4,6-二炔-3-醇、十七烷-1,8(E),10(E)-三烯-4,6-二炔-3,12-二醇、十七烷-1,8(E)-二烯-4,6-二炔-3,10-二醇及其3种衍生物异构体等聚炔类化合物[40-41],结构见图6。由于对体外培养的癌细胞具有细胞毒性,聚炔类化合物已经引起更多科学家的注意。
2.3 其他成分
金平人参正已烷提取物中的脂肪酸经气相色谱分析,鉴定有棕榈酸、硬脂酸、油酸、亚油酸、亚麻酸等。已经被认为是维生素F的亚油酸和亚麻酸的含量非常高,占总脂类成分的47.2%[8]。
已知金平人参中含有17种氨基酸,包括赖氨酸、组氨酸、精氨酸、天冬氨酸、苏氨酸、丝氨酸、谷氨酸、脯氨酸、亮氨酸、异亮氨酸等人体必需氨基酸[8]。
3 金平人参的药理作用
3.1 抗炎
炎症是机体对各种损伤或感染的刺激所发生的防御反应。炎症主要分为急性炎症与慢性炎症,两者在发生过程中都会对机体造成不同程度的损伤。急性炎症可以很快恢复,而慢性炎症会对机体造成渐进性损伤,引发器官和组织系统的功能退化,导致炎症性疾病的发生。金平人参中的皂苷类成分对脂多糖诱导的巨噬细胞的炎症反应有抑制作用。Jeong等[42]研究了化合物vinaginsenoside R2和珠子参苷R2以及它们的代谢产物拟人参皂苷Rt4和奥克梯隆醇苷元的抗炎活性。结果发现,vinaginsenoside R2对腹膜巨噬细胞显示出细胞毒性;珠子参苷R2、拟人参皂苷Rt4和奥克梯隆醇苷元能抑制脂多糖诱导的核转录因子-κB(nuclear factor kappaB,NF-κB)的活化,显著降低肿瘤坏死因子-α、白细胞介素-1、环氧合酶-2和诱导型一氧化氮合酶的含量,并下调白细胞介素-1受体相关激酶1和转化生长因子-β激活激酶1的磷酸化水平,表明上述4种人参皂苷可抑制脂多糖诱导的小鼠巨噬细胞NF-κB信号通路的激活和促炎因子的合成。
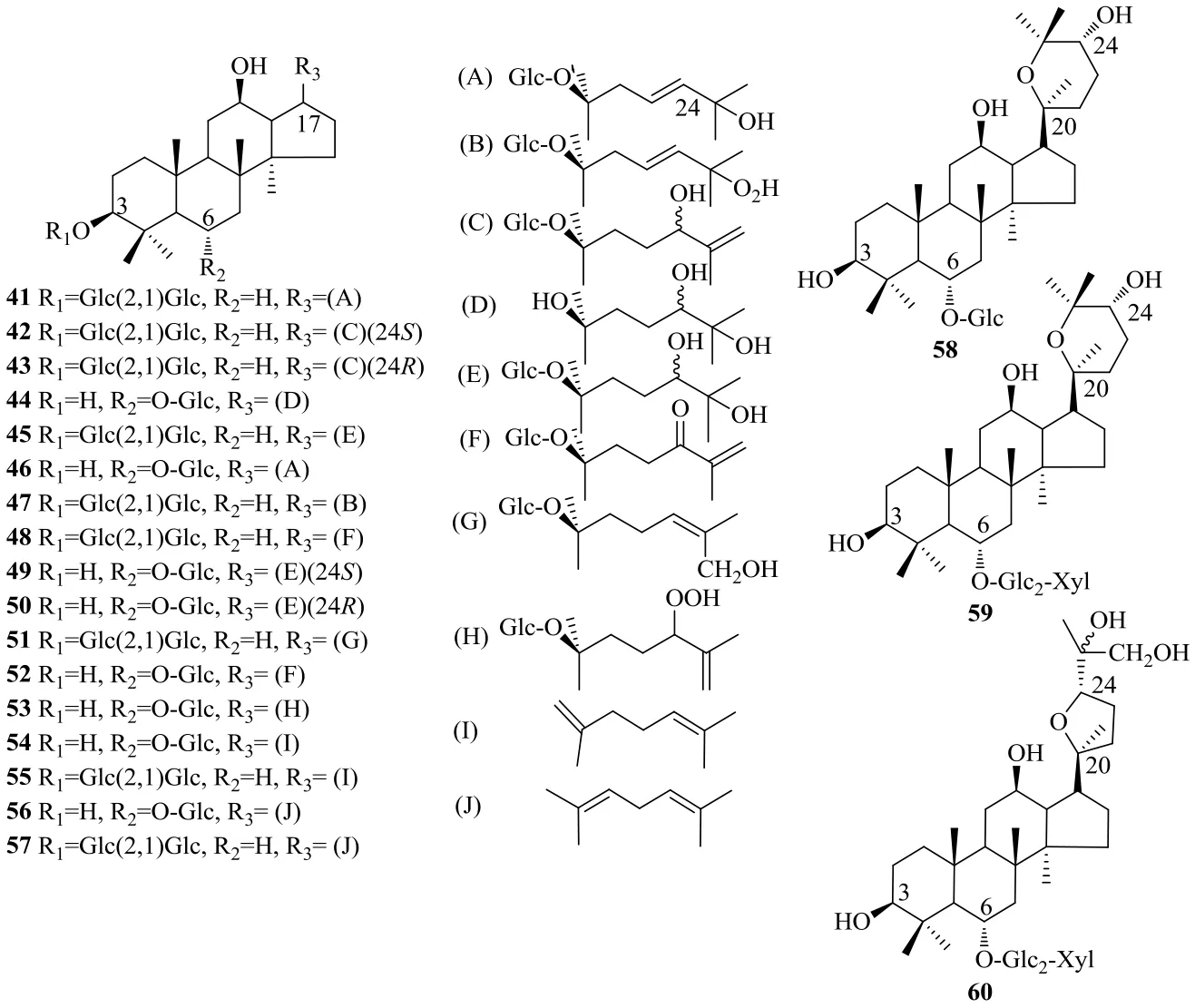
图4 金平人参中C-17侧链变化型皂苷类化合物Fig. 4 C-17 side-chain varied type saponins isolated from P. vietnamensis
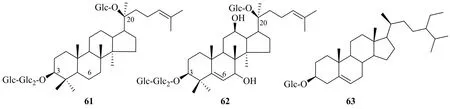
图5 金平人参中的其他类型化合物Fig. 5 Other types of saponins isolated from P. vietnamensis
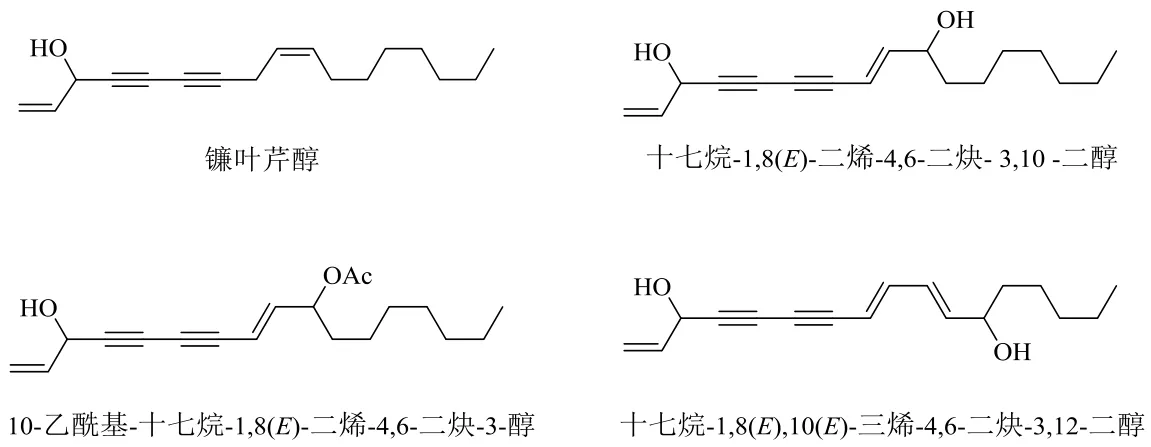
图6 金平人参中的聚炔类化合物Fig. 6 Polyacetylene compounds isolated from P. vietnamensis
Lee等[43]研究化合物珠子参苷R2及其代谢物拟人参皂苷Rt4和奥克梯隆醇苷元对辅助性T细胞17(Th17)分化的抑制作用,这3种人参皂苷均能显著抑制体外白细胞介素-6/肿瘤生长因子β-诱导的脾CD4+T细胞向Th17细胞分化和白细胞介素-17的表达,其中奥克梯隆醇苷元抑制作用最强。同时检测了奥克梯隆醇苷元对2,4,6-三硝基苯磺酸(2,4,6-trinitrobenzenesulfonic acid,TNBS)诱导的结肠炎小鼠的抗炎作用,奥克梯隆醇苷元促进了由TNBS抑制的结肠紧密连接蛋白ZO-1、occludin和claudin-1的表达,抑制了TNBS-诱导的肿瘤坏死因子-α和白细胞介素-1β的表达以及NF-κB和丝裂原活化蛋白激酶的激活。此外,奥克梯隆醇苷元还抑制了TNBS诱导的结肠角膜基质的Th17细胞分化,以及转录因子T-bet、RORγt、白细胞介素-17和白细胞介素-23的表达。奥克梯隆醇苷元增加了调节性T(Treg)细胞分化以及叉头状转录因子Foxp3和白细胞介素-10的表达。这些结果表明,口服给药珠子参苷R2可被肠道菌群代谢成奥克梯隆醇苷元,而经转化的奥克梯隆醇苷元可通过恢复Th17/Treg细胞的平衡而减轻炎症性疾病,如结肠炎。
3.2 抗肿瘤
珠子参苷R2具有抑制癌细胞生长的能力。珠子参苷R2对小鼠肝肿瘤2阶段癌变模型具有较强的抗肿瘤促进作用。此外,珠子参苷R2对一氧化氮供体/12-氧-十四烷酰佛波醇-13-乙酸酯(12-Otetradecanoylphorbol-13-acetate,TPA)或过氧亚硝酸盐/TPA引起的小鼠皮肤2阶段癌变模型具有显著的抑制作用[44-45]。珠子参苷R2对肿瘤启动子醋酸佛波引起的巴尔病毒早期抗原具有抑制作用,该作用比已知的抗肿瘤促进剂甘草次酸强得多[22]。众所周知,人参蒸制后会改变其化学成分和生物活性,金平人参在蒸煮20 h内,无糖基奥克梯隆醇型皂苷元清除自由基的能力持续增强;对人肺癌A549细胞的抗增殖活性也有所提高,推测其抗增殖活性与人参皂苷Rg3、Rg5、Rk1的含量密切相关[26-27]。奥克梯隆醇苷元能增强阿霉素的抗癌作用,奥克梯隆醇可以增强阿霉素诱导的p53野生型癌细胞的死亡,奥克梯隆醇与阿霉素共同作用可在一定程度上诱导更多的细胞凋亡并激活p53[46],对阿霉素导致的心肌细胞毒性具有解毒作用[47]。
3.3 抗伤害感受性
金平人参提取物及其主要皂苷珠子参苷R2可减弱吗啡,κ-阿片受体选择性激动剂U-50、488H和条件性恐惧应激诱导的抗伤害感受作用,抑制吗啡耐受性的发展[48-49]。Nguyen等[50]在夹尾实验中发现金平人参总皂苷能减轻心理应激和足底电击应激引起的抗伤害感受性反应,珠子参苷R2对抗伤害感受活性具有明显影响。Huong等[51]在夹尾实验中,全身、脑室内和腹膜内给药珠子参苷R2对μ-阿片受体和κ-阿片受体激动剂诱导的抗伤害感受的影响,脑室内给药珠子参苷R2通过在脊柱和脊髓上水平上的γ-氨基丁酸A型受体(γ-aminobutyric acid type A,GABAA受体)复合物作用来减弱这些阿片类药物的抗伤害感受作用。Nguyen等[52]在夹尾实验中,珠子参苷R2全身给药或集中(脑室内或鞘内)给药剂量相关性拮抗可乐定诱导的抗伤害效应,其抗伤害效应可被脑室内给药氟马西尼(选择性苯二氮䓬受体拮抗剂)和印防己毒素(GABAA受体拮抗剂)逆转,表明脊髓上GABAA-/苯二氮䓬受体参与了珠子参苷R2对可乐定诱导的抗伤害感受的拮抗作用。
3.4 抑制黑色素生成
Nguyen等[53]从金平人参的根茎中分离5个奥克梯隆醇型皂苷(珠子参苷R2、vinaginsenoside R2、珠子参苷R1、拟人参皂苷Rt4、vinaginsenoside R11),3个原人参二醇型皂苷(人参皂苷Rd、Rb1和Rg3)和4个原人参三醇型皂苷(人参皂苷Rg1、Re、Rh1,三七皂苷R1)。研究发现上述12个化合物均能有效抑制α-黑素细胞刺激素诱导的B16黑色素瘤细胞黑色素的生成,半数抑制浓度(median inhibition concentration,IC50)在27.9~88.5 μmol/L。值得一提的是,珠子参苷R2能显著减少黑色素的产生(IC50=37.0 μmol/L)且无细胞毒性,其抑制黑色素生成的活性仅次于人参皂苷Rg3(IC50=27.9 μmol/L)。
3.5 抑制顺铂诱导的肾损伤
顺铂是一种临床常用铂类抗肿瘤药,用于治疗多种实体瘤,但是严重的不良反应尤其肾毒性限制了该药物的疗效和临床应用[54]。多项研究表明金平人参中的皂苷类成分对顺铂诱导的肾损伤具有保护作用。如人参皂苷Rb3可以调节细胞自噬并抑制肾小管细胞凋亡,减少肾损伤[55]。人参皂苷Rh2、Re、Rg5可扭转由顺铂诱导的氧化应激、炎症反应,进而抑制肾小管细胞凋亡[56-59]。拟人参皂苷F11与顺铂联用可减轻顺铂的肾毒性而不影响其疗效[60]。人参皂苷Rh4、Rk3和Rd能剂量相关性地显著降低顺铂对猪肾细胞llc-pk1的毒性[61-64]。Vu-Huynh等[65]从蒸制的金平人参中发现20(R)-人参皂苷-Rh2和20(R)-人参皂苷-Rg3对顺铂诱导的llc-pk1细胞损伤具有显著的保护作用。此外,聚乙炔类化合物人参炔醇(panaxynol)通过下调c-Jun氨基末端激酶、P38以及半胱氨酸蛋白酶-3(caspase-3)的表达,抑制细胞凋亡,从而起到保护肾损伤的作用[66]。
3.6 精神运动的影响
研究表明,人参成分及其提取物可以增加运动能力。与对照组相比,短期给药金平人参提取物的小鼠移动距离和移动时间增加。开场试验的结果表明,金平人参提取物对一般的运动活性具有增强作用,并且不会引起任何运动损伤[67]。OT型皂苷可增加小鼠的自发运动能力并诱导神经元活化[68]。人参皂苷Rb1能增强大鼠的肌肉力量并增加自发运动能力[69]。
3.7 镇静催眠
金平人参提取物及珠子参苷R2的处理不会影响戊巴比妥引起的小鼠睡眠[67,70],也不会引起镇静作用,这表明金平人参没有镇静催眠作用,但珠子参苷R2能显著地将心理应激和社会隔绝应激诱导的戊巴比妥睡眠下降恢复到对照处理的水平,它由小鼠GABAA受体复合物上的神经甾体位点介导的[70-71]。而Lee等[72]发现高丽人参可以改善大鼠的睡眠状况。这种差异值得进一步研究。
3.8 肝保护
Tran等[9]对金平人参中分离得到的16个三萜皂苷化合物对原代培养的小鼠肝细胞中D-半乳糖胺/肿瘤坏死因子-α诱导的细胞死亡的肝细胞保护活性进行体外试验评价,其中OT型皂苷化合物珠子参苷R2,拟人参皂苷Rt4,vinaginsenosides R1、R2、20(S),24(S)-奥克梯隆醇以及人参皂苷Rh4具有较强的肝细胞保护活性,人参皂苷Rg1、Rh1、Rb2、Re具有中等强度的肝细胞保护活性,而化合物vinaginsenoside R25及人参皂苷Rb1、Rd则不具有肝细胞保护活性或是作用很弱。这些结果表明,对D-半乳糖胺/肿瘤坏死因子-α诱导的小鼠原代培养肝细胞死亡的肝细胞保护活性,可能跟达玛烷型皂苷在C-17侧链呋喃环的形成有关。随后,又评价了珠子参苷R2对D-半乳糖胺/脂多糖诱导的小鼠肝细胞凋亡及随后的肝衰竭体内保护活性试验,结果表明通过抑制活化的巨噬细胞产生的肿瘤坏死因子-α和直接抑制肿瘤坏死因子-α诱导的凋亡来抑制D-半乳糖胺/肿瘤坏死因子-α诱导的细胞凋亡以保护原代培养的小鼠肝细胞免受细胞凋亡[73]。
3.9 其他
此外,研究发现金平人参还具有抗氧化[74]、增强噬菌细胞的噬菌活性[75]、抗菌活性[76-77]等方面的药理活性。
4 结语与展望
金平人参是一种珍贵的植物资源,具有人参、西洋参、三七、珠子参及竹节参等人参属植物共有的化学成分,而含有更为丰富的OT型皂苷,其含量占总皂苷的50%以上,具有广泛的应用价值可作为功能食品或药品开发的重要植物来源。在药理学及植化成分、人参皂苷生物合成等方面已经具备较好的研究基础。无疑可以作为功能食品、保健品、药品开发的重要候选天然药物。然而,尽管它在药理学、植物化学以及生物合成等方面已经具备较好的研究基础,并且表现出广泛而强大的药理作用,但其分子水平上的作用机制尚不清楚,因此在未来的研究中有必要进行全面的科学研究。
目前,由于金平人参野生种质资源稀少,加之药用价值较高,经市场高价刺激后致使人们无序采挖金平人参,造成金平人参的生态系统遭受严重破坏,若仍不对金平人参采取有效保护措施,则极有可能使该物种陷入濒危的境地。因此,迫切需要采取一定措施来保护金平人参的野生资源并发展其规模化、规范化的种植,如可以对金平人参分布比较集中的区域,建立专门的自然保护区,开展种质资源收集,加速金平人参的生物学研究,掌握其生长发育规律和适应特性,进而开展该物种的人工引种驯化研究,选育出具有不同生态适应性的优良品种,再对优良品种进行规范化的大规模种植,最终达到有效保护金平人参和合理开发利用的目的。
植物细胞培养技术[78-81]、化学合成[82-83]及生物合成生物活性皂苷类化合物的方法[84-85]为金平人参资源的扩大开发及应用提供了强有力的支持。不同学科之间的相互渗透与融合使分子生物学进入植物研究领域,已进行了金平人参转录组分析[6,33]和叶绿体基因组[86]的研究,未来对金平人参进行全基因组的研究和其三萜皂苷生物合成相关代谢通路的关键基因的解析将为金平人参的遗传学研究和进一步开发利用提供了可靠的数据基础,对金平人参的育种、种植和深加工产业发展具有重要的意义。
利益冲突 所有作者均声明不存在利益冲突
[1] Dung H T, Grushvitsky I V.Panax vietnamensis, a newPanaxspecies [J].J Viet Bot, 1985,4: 518.
[2] Zhu S, Fushimi H, Cai S,et al. A new variety of the genusPanaxfrom southern Yunnan, China and its nucleotide sequences of 18S ribosomal RNA gene and matK gene[J].J Jpn Bot, 2003, 78(2): 86-94.
[3] 李晓波, 杨紫刚, 沈勇, 等. HPLC法同时测定野三七中三七皂苷R1及人参皂苷Rg1、Rb1、Rd的含量 [J]. 中国药师, 2012, 15(10): 1383-1385.
[4]The Plant List(2013). Version 1. 1 [DB/OL].http://www.theplantlist.org/tpl1.1/ record/kew-146825.
[5] 希 雨. 人参家族中的珍稀、濒危品种——越南人参[J]. 现代药物与临床, 2002, 17(2): 91-92.
[6] Vu D D, Shah S N M, Pham M P,et al. De novo assembly and transcriptome characterization of an endemic species of Vietnam,Panax vietnamensisHa et Grushv., including the development of EST-SSR markers for population genetics [J].BMC Plant Biol, 2020, 20(1): 358.
[7] Nguyen M D, Nguyen T N, Kasai R,et al. Saponins from Vietnamese ginseng,Panax vietnamensisHa et Grushv.Collected in central Vietnam. I [J].Chem Pharm Bull,1993, 41(11): 2010-2014.
[8] Duc N M, Nham N T. Chemical composition and pharmacological activities of Vietnamese ginseng,Panax Vietnamensis[J].International Symposium Ginseng,1998, 9: 127-137.
[9] Tran Q L, Adnyana I K, Tezuka Y,et al. Triterpene saponins from vietnamese ginseng (Panax vietnamensis)and their hepatocytoprotective activity [J].J Nat Prod,2001, 64(4): 456-461.
[10] 旭文, 王振淮, 晓戈. 蔡希陶传略 [M]. 北京: 国际文化出版公司, 1993: 263.
[11] 赵仁, 赵毅, 李东明, 等. 珠子参研究进展 [J]. 中国现代中药, 2008, 10(7): 3-6.
[12] 云南省植物研究所. 人参属植物的三萜成分和分类系统, 地理分布的关系 [J]. 植物分类学报, 1975, 13(2):29-48.
[13] Linh N T N, Cuong L K, Tam H T,et al. Improvement of bioactive saponin accumulation in adventitious root cultures ofPanax vietnamensisvia culture periods and elicitation [J].Plant Cell Tissue Organ Cult PCTOC,2019, 137(1): 101-113.
[14] Nhut D T, Hai N T, Huy N P,et al. New Achievement in Panax vietnamensis Research [J].Biotechnol Neglected Underutilized Crop, 2013, doi: 10.1007/978-94-007-5500-0_3.
[15] Le Q U, Lay H L, Wu M C,et al. Phytoconstituents and biological activities ofPanax vietnamensis(Vietnamese ginseng): A precious ginseng and call for further research-A systematic review [J].Nat Prod Commun,2018, 13(10): 1934578X1801301.
[16] Christensen L P. Ginsenosides: Chemistry, biosynthesis,analysis and potential health effects (Chapter 1) [J].Adv Food Nutr Res, 2008, 55(55): 1-99.
[17] Shin B K, Kwon S W, Park J H. Chemical diversity of ginseng saponins fromPanax ginseng[J].J Ginseng Res,2015, 39(4): 287-298.
[18] Qi L W, Wang C Z, Yuan C S. Ginsenosides from American ginseng: Chemical and pharmacological diversity [J].Phytochemistry, 2011, 72(8): 689-699.
[19] Yang W Z, Hu Y, Wu W Y,et al. Saponins in the genusPanaxL. (Araliaceae): A systematic review of their chemical diversity [J].Phytochemistry, 2014, 106: 7-24.
[20] Zhu S, Zou K, Cai S Q,et al. Simultaneous determination of triterpene saponins in ginseng drugs by high-performance liquid chromatography [J].Chem Pharm Bull, 2004, 52(8): 995-998.
[21] Zhu S, Zou K, Fushimi H,et al. Comparative study on triterpene saponins of Ginseng drugs [J].Planta Med,2004, 70(7): 666-677.
[22] Yamasaki K. Bioactive saponins in Vietnamese ginseng,Panax vietnamensis[J].Pharm Biol, 2000, 38(Suppl 1):16-24.
[23] Nguyen M D, Nguyen T N, Kasai R,et al. Saponins from Vietnamese ginseng,Panax vietnamensisHa et Grushv.Collected in central Vietnam. II [J].Chem Pharm Bull,1994, 42(1): 115-122.
[24] Nguyen M D, Nguyen T N, Kasai R,et al. Saponins from Vietnamese ginseng,Panax vietnamensisHa et Grushv.Collected in central Vietnam. III [J].Chem Pharm Bull,1994, 42(3): 634-640.
[25] Duc N M, Kasai R, Yamasaki K,et al. New dammarane saponins from Vietnamese ginseng [J].Stud Plant Sci,1999, 6: 77-82.
[26] Le T H, Lee S Y, Lee G J,et al. Effects of steaming on saponin compositions and antiproliferative activity of Vietnamese ginseng [J].J Ginseng Res, 2015, 39(3):274-278.
[27] Le T H, Lee S Y, Kim T R,et al. Processed Vietnamese ginseng: Preliminary results in chemistry and biological activity [J].J Ginseng Res, 2014, 38(2): 154-159.
[28] 沈晓静, 李晓波, 沈勇, 等. 野三七皂苷类化学成分研究 [J]. 中药材, 2018, 41(8): 1894-1898.
[29] Tanaka O, Morita T, Kasai R,et al. Study on saponins of rhizomes ofPanaxpseudo-ginsengsubsp.himalaicuscollected at Tzatogang and Pari-la, Bhutan-Himalaya [J].Chem Pharm Bull, 1985, 33(6): 2323-2330.
[30] 李向高, 张连学, 孟祥颖, 等. 西洋参特有成分: 拟人参皂苷F11的分离、鉴定与含量测定 [J]. 吉林农业大学学报, 2005, 27(6): 645-648.
[31] Morita T, Kasai R, Tanaka O,et al. Saponins of Zu-Tziseng, rhizomes ofPanax japonicusC.A. Meyer var.major(Burk.) C.Y. Wu et K.M. Feng, collected in Yunnan, China [J].Chem Pharm Bull, 1982, 30(12):4341-4345.
[32] Dou D, Chen Y, Ren J,et al. Ocotillone-type ginsenoside from leaves ofPanax ginseng[J].J Chin Pharm Sci,2002, 11(4): 119-121.
[33] Zhang G H, Ma C H, Zhang J J,et al. Transcriptome analysis ofPanax vietnamensisvar.fuscidicusdiscovers putative ocotillol-type ginsenosides biosynthesis genes and genetic markers [J].BMC Genom, 2015, 16(1): 1-20.
[34] Hao H, Lai L, Zheng C,et al. Microsomal cytochrome p450-mediated metabolism of protopanaxatriol ginsenosides: Metabolite profile, reaction phenotyping,and structure-metabolism relationship [J].Drug Metab Dispos, 2010, 38(10): 1731-1739.
[35] Li L, Chen X Y, Zhou J L,et al.In vitrostudies on the oxidative metabolism of 20(S)-ginsenoside Rh2in human,monkey, dog, rat, and mouse liver microsomes, and human liver S9 [J].Drug Metab Dispos, 2012, 40(10):2041-2053.
[36] Wang W Y, Wang L, Wu X M,et al. Stereoselective formation and metabolism of 20(S)-protopanaxadiol ocotillol type epimersin vivoandin vitro[J].Chirality,2015, 27(2): 170-176.
[37] Takemoto T, Arihara S, Nakajima T,et al. Studies on the constituents ofGynostemma pentaphyllumMakino. I.structures of gypenoside I-XIV [J].Yakugaku Zasshi,1983, 103(2): 173-185.
[38] Takemoto T, Arihara S, Nakajima T,et al. Studies on the constituents ofGynostemma pentaphyllumMakino. II.structures of gypenoside XV-XXI [J].Yakugaku Zasshi,1983, 103(10): 1015-1023.
[39] Morita T, Nie R L, Fujino H K,et al. Saponins from Chinese cucurbitaceous plants: Solubilization of saikosaponin-a with hemslosides Ma2 and Ma3 and structure of hemsloside H1 fromHemsleya chinensis[J].Chem Pharm Bull, 1986, 34(1): 401-405.
[40] Lutomski J, Luan T C. Polyacetylenes in rhizomes and roots of Vietnamese ginseng (Panax vietnamensisHa et Grushv.) [J].Herba Polon, 1989, 35(4): 207-211.
[41] Lutomski J, Luan T C. Polyacetylenes in the Araliaceae family. Part I. The isolation and identification of acetylenic compounds from rhizomes and roots of Vietnamese ginseng (Panax vietnamensisHa et Grushv.)[J].Herba Polon, 1991, 37(3/4): 113-123.
[42] Jeong J J, Van Le T H, Lee S Y,et al. Anti-inflammatory effects of vina-ginsenoside R2and majonoside R2isolated fromPanax vietnamensisand their metabolites in lipopolysaccharide-stimulated macrophages [J].Int Immunopharmacol, 2015, 28(1): 700-706.
[43] Lee S Y, Jeong J J, Le T H,et al. Ocotillol, a majonoside R2metabolite, ameliorates 2, 4, 6-trinitrobenzenesulfonic acid-induced colitis in mice by restoring the balance of Th17/treg cells [J].J Agric Food Chem, 2015, 63(31):7024-7031.
[44] Konoshima T, Takasaki M, Ichiishi E,et al. Cancer chemopreventive activity of majonoside-R2from Vietnamese ginseng,Panax vietnamensis[J].Cancer Lett,1999, 147(1/2): 11-16.
[45] Konoshima T, Takasaki M, Tokuda H,et al.Anti-tumor-promoting activity of majonoside-R2from Vietnamese ginseng,Panax vietnamensisHa et Grushv.(I) [J].Biol Pharm Bull, 1998, 21(8): 834-838.
[46] Wang H, Yu P, Bai J,et al. Ocotillol enhanced the antitumor activity of doxorubicin via p53-dependent apoptosis [J].Evid Based Complement Alternat Med,2013, 2013: 468537.
[47] Fu X Y, Kong L, Tang M T,et al. Protective effect of ocotillol against doxorubicin induced acute and chronic cardiac injury [J].Mol Med Rep, 2014, 9(1): 360-364.
[48] Huong N T T, Matsumoto K, Yamasaki K,et al. Effects of Vietnamese ginseng on opioid agonist—and conditioned fear stress-induced antinociception [J].Phytomedicine,1996, 3(1): 33-39.
[49] Huong N T T, Matsumoto K, Yamasaki K,et al. The possible involvement of GABAA systems in the antinarcotic effect of majonoside-R2, a major constituent ofVietnamese ginseng, in mice [J].Jpn J Pharmacol,1996, 71(4): 345-349.
[50] Nguyen T T, Matsumoto K, Yamasaki K,et al. Crude saponin extracted from Vietnamese ginseng and its major constituent majonoside-R2attenuate the psychological stress-and foot-shock stress-induced antinociception in mice [J].Pharmacol Biochem Behav, 1995, 52(2):427-432.
[51] Huong N T T, Matsumoto K, Yamasaki K,et al.Majonoside-R2, a major constituent ofVietnamese ginseng, attenuates opioid-induced antinociception [J].Pharmacol Biochem Behav, 1997, 57(1/2): 285-291.
[52] Nguyen T T, Matsumoto K, Yamasaki K,et al.Involvement of supraspinal GABA receptors in majonoside-R2suppression of clonidine-induced antinociception in mice [J].Life Sci, 1997, 61(4): 427-436.
[53] Nguyen H M, Nguyen H T, Win N,et al.Antimelanogenic activity of ocotillol-type saponins fromPanax vietnamensis[J].Chem Biodivers, 2020, 17(5):e2000037.
[54] 张召杨, 孙增涛, 王霖. 益气温阳法联合顺铂对荷瘤小鼠调节性T细胞的影响 [J]. 世界中医药, 2021, 16(14):2110-2114.
[55] Xing J J, Hou J G, Ma Z N,et al. Ginsenoside Rb3provides protective effects against cisplatin-induced nephrotoxicity via regulation of AMPK-/mTORmediated autophagy and inhibition of apoptosisin vitroandin vivo[J].Cell Prolif, 2019, 52(4): e12627.
[56] Qi Z, Li W, Tan J,et al. Effect of ginsenoside Rh2on renal apoptosis in cisplatin-induced nephrotoxicityin vivo[J].Phytomedicine, 2019, 61: 152862.
[57] Wang Z, Li Y F, Han X Y,et al. Kidney protection effect of ginsenoside Re and its underlying mechanisms on cisplatin-induced kidney injury [J].Cell Physiol Biochem,2018, 48(5): 2219-2229.
[58] Li W, Yan M H, Liu Y,et al. Ginsenoside Rg5ameliorates cisplatin-induced nephrotoxicity in mice through inhibition of inflammation, oxidative stress, and apoptosis[J].Nutrients, 2016, 8(9): 566.
[59] 王浩, 邹茜. 人参皂苷Rg1调节沉默信息调节因子1对抗晶状体上皮细胞衰老的影响 [J]. 世界中医药, 2021,16(7): 1095-1098.
[60] Wang H, Kong L, Zhang J,et al. The pseudoginsenoside F11 ameliorates cisplatin-induced nephrotoxicity without compromising its anti-tumor activityin vivo[J].Sci Rep,2014, 4: 4986.
[61] Baek S H, Piao X L, Lee U J,et al. Reduction of cisplatin-induced nephrotoxicity by ginsenosides isolated from processed ginseng in cultured renal tubular cells [J].Biol Pharm Bull, 2006, 29(10): 2051-2055.
[62] Baek S H, Shin B K, Kim N J,et al. Protective effect of ginsenosides Rk3and Rh4on cisplatin-induced acute kidney injuryin vitroandin vivo[J].J Ginseng Res,2017, 41(3): 233-239.
[63] Yokozawa T, Liu Z W. The role of ginsenoside-Rd in cisplatin-induced acute renal failure [J].Ren Fail, 2000,22(2): 115-127.
[64] Yokozawa T, Dong E. Role of ginsenoside-Rd in cisplatin-induced renal injury: Special reference to DNA fragmentation [J].Nephron, 2001, 89(4): 433-438.
[65] Vu-Huynh K L, Le T H V, Nguyen H T,et al. Increase in protective effect ofPanax vietnamensisby heat processing on cisplatin-induced kidney cell toxicity [J].Molecules, 2019, 24(24): 4627.
[66] Lee D, Lee J, Vu-Huynh K L,et al. Protective effect of panaxynol isolated fromPanax vietnamensisagainst cisplatin-induced renal damage:In vitroandin vivostudies [J].Biomolecules, 2019, 9(12): 890.
[67] Dela Peña I J I, Kim H J, Botanas C J,et al. The psychopharmacological activities of Vietnamese ginseng in mice: Characterization of its psychomotor,sedative-hypnotic, antistress, anxiolytic, and cognitive effects [J].J Ginseng Res, 2017, 41(2): 201-208.
[68] Wang Z J, Sun L, Peng W,et al. Ginseng derivative ocotillol enhances neuronal activity through increased glutamate release: A possible mechanism underlying increased spontaneous locomotor activity of mice [J].Neuroscience, 2011, 195: 1-8.
[69] Tan S J, Li N, Zhou F,et al. Ginsenoside Rb1 improves energy metabolism in the skeletal muscle of an animal model of postoperative fatigue syndrome [J].J Surg Res,2014, 191(2): 344-349.
[70] Nguyen T T, Matsumoto K, Yamasaki K,et al. Effects of majonoside-R2 on pentobarbital sleep and gastric lesion in psychologically stressed mice [J].Pharmacol Biochem Behav, 1996, 53(4): 957-963.
[71] Huong N T, Matsumoto K, Watanabe H. The antistress effect of majonoside-R2, a major saponin component ofVietnamese ginseng: Neuronal mechanisms of action [J].Methods Find Exp Clin Pharmacol, 1998, 20(1): 65-76.
[72] Lee C I, Kim C S, Han J Y,et al. Repeated administration of Korea red ginseng extract increases non-rapid eye movement sleep via GABAAergic systems [J].J Ginseng Res, 2012, 36(4): 403-410.
[73] Tran Q L, Adnyana I K, Tezuka Y,et al. Hepatoprotective effect of majonoside R2, the major saponin fromVietnamese ginseng(Panax vietnamensis) [J].Planta Med, 2002, 68(5): 402-406.
[74] Houng N T T, Matsumoto K, Kasai R,et al.In vitroantioxidant activity ofVietnamese ginsengsaponin and its components [J].Biol Pharm Bull, 1998, 21(9): 978-981.
[75] Huong N T T, Matsumoto K, Nham N T,et al. Effect ofVietnamese ginsengon the phagocytosisin vitroandin vivo[J].Phytomedicine, 1997, 4(4): 341-346.
[76] 毕 毅, 徐进宜, 周志文, 等. 具有抗菌活性的 (20S,24S)-ocotillol型人参皂苷类衍生物其制备方法及用途:中国, CN 2012104221860 [P]. 2012-10-30.
[77] 毕 毅, 徐进宜, 周志文, 等. 具有抗菌活性的 (20S,24R)-ocotillol型人参皂苷类衍生物其制备方法及用途:中国, CN2012104339203 [P]. 2012-11-05.
[78] Kochan E, Nowak A, Zakłos-Szyda M,et al.Panax quinquefoliumL. ginsenosides from hairy root cultures and their clones exert cytotoxic, genotoxic and pro-apoptotic activity towards human colon adenocarcinoma cell line caco-2 [J].Molecules, 2020, 25(9): 2262.
[79] Ha L T, Pawlicki-Jullian N, Pillon-Lequart M,et al. Hairy root cultures ofPanax vietnamensis, a promising approach for the production of ocotillol-type ginsenosides[J].Plant Cell Tissue Organ Cult PCTOC, 2016, 126(1):93-103.
[80] Trong T T, Truong D H, Nguyen H C,et al. Biomass accumulation ofPanax vietnamensisin cell suspension cultures varies with addition of plant growth regulators and organic additives [J].Asian Pac J Trop Med, 2017,10(9): 907-915.
[81] Adil M, Jeong B R.In vitrocultivation ofPanax ginsengC.A. Meyer [J].Ind Crop Prod, 2018, 122: 239-251.
[82] Liu J, Xu Y, Yang J,et al. Discovery, semisynthesis,biological activities, and metabolism of ocotillol-type saponins [J].J Ginseng Res, 2017, 41(3): 373-378.
[83] Ren Q, Yang G, Guo M,et al. Design, synthesis, and discovery of ocotillol-type amide derivatives as orally available modulators ofP-glycoprotein-mediated multidrug resistance [J].Eur J Med Chem, 2019, 161: 118-130.
[84] Hu D, Gao H, Yao X S.Biosynthesis of Triterpenoid Natural Products[M]. Comprehensive Natural Products IIIAmsterdam: Elsevier, 2020: 577-612.
[85] Yang J L, Hu Z F, Zhang T T,et al. Progress on the studies of the key enzymes of ginsenoside biosynthesis[J].Molecules, 2018, 23(3): 589.
[86] Nguyen B, Kim K, Kim Y C,et al. The complete chloroplast genome sequence ofPanax vietnamensisHa et Grushv (Araliaceae) [J].Mitochondrial DNA A, 2017,28(1): 85-86.
Research and utilization of precious Chinese medicine resources ofPanax vietnamensis
LI Xiao-bo1,2, JIANG Wei-wei1,3, ZHANG Guang-hui1, DENG Zi-you4, WANG Song5, TIAN Xing-zhi5, GUO Qiao-sheng6, YANG Sheng-chao1
1. The Key Laboratory of Medicinal Plant Biology of Yunnan Province, National and Local Joint Engineering Research Center on Germplasm Innovation and Utilization of Chinese Medicinal Materials in Southwest China, Yunnan Agricultural University,Kunming 650201, China 2. College of Agronomy and Biotechnology, Yunnan Agricultural University, Kunming 650201, China 3. College of Science, Yunnan Agricultural University, Kunming 650201, China 4. The People's Government of Jinping Miao Yao Dai Autonomous County, Honghe 661599, China 5. Jinping Big Health Medicinal Materials Co., Ltd, Honghe 661599, China 6. Institute of Chinese Medicinal materials, Nanjing Agricultural University, Nanjing 210095, China
Panax vietnamensisHa et Grushv., is a precious medicinal plant, naturally distributed in the Jinping County in Yunnan,China, and Ngoc Linh and Hoang Lien Son mountain areas in Vietnam. Its wild resources are scarce, while artificial cultivation is beginning to take shape. The chemistry components isolated fromP. vietnamensiswere mainly triterpenoids, and the reported 63 saponin components related to ocotillol type, protopanaxadiol type, protopanaxatriol type, oleanolic acid type, and C-17 side-chain varied type, etc. Among them, the content of majonoside R2was as high as 5.3%. In addition, it contents steroidal glycosides,polyacetylenes, fatty acids and amino acids, etc. Pharmacological studies showed thatP. vietnamensishad the effects of anti-inflammatory, anti-tumor, melanin production inhibition, liver and kidney protection and sedation, etc. This article mainly summarized the current status on resources, chemical compositions, and pharmacological activities ofP. vietnamensisin order to provide a reference for development and utilization of the plant.
Panax vietnamensisHa et Grushv.; resources; triterpenoids; majonoside R2; anti-inflammatory; anti-tumor; inhibition of melanin production
R28;R285
A
0253-2670(2022)14-4568-14
10.7501/j.issn.0253-2670.2022.14.034
2021-11-04
国家重点研发计划(2017YFC1702500);云南省科技厅重大专项(2019ZF011-1);云南省科技厅重大专项(202102AA310048);云南省农业基础研究联合项目(2018FG001-037)
李晓波(1989—),男,博士研究生,作物遗传育种专业。Tel: 15974828708 E-mail: lixiaobo-2007@163.com
*通信作者:杨生超,男,博士,教授,主要从事药用植物资源评价与利用的研究工作。E-mail: shengchaoyang@163.com
[责任编辑 王文倩]
