基于数据挖掘探讨“柴胡劫肝阴”的相杀配伍内涵
2022-07-22刘青松陈双兰谢子妍
刘青松,李 微,张 怡,陈双兰,谢子妍,李 斌
·数据挖掘与循证医学·
基于数据挖掘探讨“柴胡劫肝阴”的相杀配伍内涵
刘青松,李 微,张 怡,陈双兰,谢子妍,李 斌*
成都中医药大学附属医院,四川 成都 610075
基于数据挖掘分析含柴胡经典方剂的配伍规律,并阐明“柴胡劫肝阴”和配伍高频药物对柴胡“解毒存效”的分子机制,为其临床应用及新药研发提供思路。通过药智数据库、中国期刊全文数据库(CNKI)、万方数据库(Wanfang)和中文科技期刊全文数据库(VIP)对含柴胡方剂进行检索,运用Excel 2019、IBM SPSS Modeler18.0和IBM SPSS26.0软件进行频数分析和聚类分析。利用网络毒理学对“柴胡劫肝阴”的毒性成分、毒性靶点和调控网络进行分析。通过网络药理学构建高频配伍中药和柴胡肝毒性成分-靶点网络图。共筛选82首含柴胡方剂涉及205味中药,共897频次,关联规则分析得到13组关联规则。网络毒理学结果显示,柴胡皂苷和挥发油作为柴胡潜在的毒性成分,得到柴胡潜在毒性靶标298个,肝毒性靶点198个,柴胡致肝毒性潜在靶点20个,相关信号通路61条。网络药理学结果显示甘草和柴胡肝毒性共有靶点5个、通路17条,白芍和柴胡肝毒性共有靶点9个、通路49条,当归和柴胡肝毒性共有靶点2个、通路38条,黄芩和柴胡肝毒性共有靶点5个、通路33条。柴胡分别与甘草、白芍、当归、黄芩配伍关联程度强,甘草、白芍、当归、黄芩具有多成分拮抗柴胡肝毒性的作用,前列腺素内过氧化物合酶2(prostaglandin-endoperoxide synthase 2,PTGS2)可能是潜在的拮抗靶点,为指导含柴胡方剂临床合理应用提供依据。
柴胡;数据挖掘;网络药理学;柴胡劫肝阴;相杀配伍;中药毒性;甘草;白芍;当归;黄芩;柴胡皂苷
柴胡为伞形科植物柴胡DC. 或狭叶柴胡Willd. 的干燥根,味苦、微辛,具有解表退热、疏肝解郁、升举阳气的功效,临床应用较广。柴胡因其升发之性,易耗竭肝阴肝血,后世将这一特性总结为“柴胡劫肝阴”。“柴胡劫肝阴”是对柴胡不良反应的重要总结并指导临床用药。如温热学派叶天士临证中常以茵陈、嫩青蒿代替柴胡[1],现代医家郭维琴教授等因“柴胡劫肝阴”而减少柴胡的剂量[2]。有研究表明“柴胡劫肝阴”作用与柴胡肝毒性具有统一性[3],但其潜在的致肝毒性作用目前尚不清楚。相杀配伍能够减轻或者消除药物毒性,起到“减毒存效”的作用[4-5]。尽管临床上对“柴胡劫肝阴”有较深的认识,但对于柴胡临床配伍关系却知之甚少。本研究拟利用数据挖掘技术对含柴胡方剂的配伍进行系统分析,并用现代生物信息学手段对其机制进行进一步探索,以期为临床柴胡配伍处方及柴胡中成药研发提供参考。
1 材料与方法
1.1 数据来源
本研究是以药智数据库(https://db.yaozh.com)、中国期刊全文数据库(CNKI)、万方数据库(Wanfang)和中文科技期刊全文数据库(VIP)为数据来源。检索年限定为建库至2022年4月。以“柴胡”为主关键词在药智数据库进行高级检索,选择经典方剂进行限定。药智数据库是国内医药数据库中覆盖面较广的综合性开放式数据系统,其收纳的经典方剂定义为目前仍广泛应用、疗效确切、具有明显优势与特色的清代及清代以前医籍所记载的方剂[6]。
中国期刊全文数据库中选择“专业检索”项,按照SU='柴胡'*'临床'-'银柴胡'-'大鼠'-'小鼠'-'中西医联合'进行检索,选择“北大核心”和“期刊论文”,检索得到879篇文献;万方数据库中选择“专业检索”项,按照主题:(柴胡and临床)not(银柴胡and大鼠and小鼠and中西医联合),选择“期刊论文”和“北大核心”,检索得到347篇文献;中文科技期刊全文数据库选择“检索式检索”项,按照U='柴胡'*'临床'-'银柴胡'-'大鼠'-'小鼠'-'中西医联合',选择“北大核心期刊”,检索得到3篇文献。
1.2 纳入标准
(1)含柴胡方剂的临床研究性论文(不区分是否为随机对照试验);(2)文献中中药处方完整;(3)自拟方需为临床应用较广或核心期刊对该方的报道大于等于2次;(4)两方合方、加味方选择含柴胡的原方。
1.3 排除标准
(1)重复文献、重复组成的方剂;(2)内容不完整的方剂;(3)综述、系统评价、数据挖掘、理论研究、动物或者细胞实验;(4)仅含柴胡单味药材研究的文献;(5)与银柴胡有关方剂。
1.4 数据处理
1.4.1 建立数据库及中药标准化 将筛选出的处方导入Excel 2019建立方剂数据库。根据《中国药典》2020年版对涉及中药名称进行标准化处理,具体见表1。将同一中药的不同炮制方法归纳为不同药物,如将“甘草”和“炙甘草”划分为不同药物。
表1 部分中药名称的标准化处理
Table 1 Standardization of some traditional Chinese medicine names
别名正名别名正名 黄芩片黄芩炙黄芪黄芪 黄连片黄连熟地熟地黄 炒白芍白芍丹皮牡丹皮 制何首乌何首乌制半夏半夏 龙胆龙胆草川郁金郁金香
1.4.2 数据分析 用Excel 2019软件对纳入文献处方中全部中药分别进行频数分析,将全部中药规范后的数据分别录入IBM SPSS Modeler 18.0和IBM SPSS 26.0软件进行关联规则分析和聚类分析,统计与柴胡关联强度较高的中药。
1.5 “柴胡劫肝阴”的网络毒理学分析
SwissTargetPrediction数据库(http:// swisstargetprediction.ch/)可以基于已知化合物的二维和三维结构的相似性来预测化合物的靶标。利用CNKI和PubMed对柴胡肝毒性成分进行检索,将柴胡潜在毒性成分的Canonical SMILES格式导入SwissTargetPrediction数据库进行靶点预测。人类基因数据库(Genecard)提供了目前已注释的、可预测的所有基因。遗传药理学与药物基因组学数据库(PharmGkB)完整的收集药物基因组相关的基因型和表型信息,并进行系统归类。以“hepatotoxicity”在Genecard(https:/www.genecards. org/)数据库和PharmGkB数据库(https://www. pharmgkb.org/)进行检索,得到疾病相关靶点。两者取交集得到柴胡肝毒性相关靶点。利用STRING数据库(https:/string-db.org/)构建交集靶点的蛋白- 蛋白相互作用(protein-protein interaction,PPI)网络。利用Cytoscape 3.8.2软件[7]绘制柴胡肝毒性网络。通过R4.0.2软件的clusterProfiler包[8]以错误发现率(false discovery rate,FDR)<0.05为阈值对柴胡肝毒性靶点进行信号通路富集分析。
1.6 “柴胡劫肝阴”的相杀配伍的网络药理学分析
通过上述数据挖掘的结果,得到与柴胡配伍置信度较高的中药。导入中药系统药理学数据库与分析平台(TCMSP,http:/sp.nwsuaf.edu.cn/tcmsp.php)以口服生物利用度(oral bioavailability,OB)≥30%和类药性(drug like,DL)≥0.18筛选中药的活性成分及作用靶点[9]。利用Uniprot数据库对其进行矫正。将中药与柴胡肝毒性相关靶点取交集,得到潜在中药-柴胡肝毒性靶点。通过R 4.0.2软件的clusterProfiler包以<0.05为阈值进行潜在中药-肝毒性靶点的信号通路富集分析。最后,利用Cytoscape 3.8.2软件对柴胡毒性成分,柴胡肝毒性靶点,潜在中药的化学成分进行整合分析,构建柴胡配伍减毒的调控网络,并利用cytoHubba插件进行网络拓扑分析。
2 结果
2.1 数据筛选
通过数据库检索获得相关文献1229篇,根据纳入及排除标准,筛选出符合标准的方剂43首。药智数据库经过筛选排除,共纳入60首含柴胡的经典方剂。排除组成重复的方剂,整理后共得到82首方剂。数据库检索的具体流程见图1。
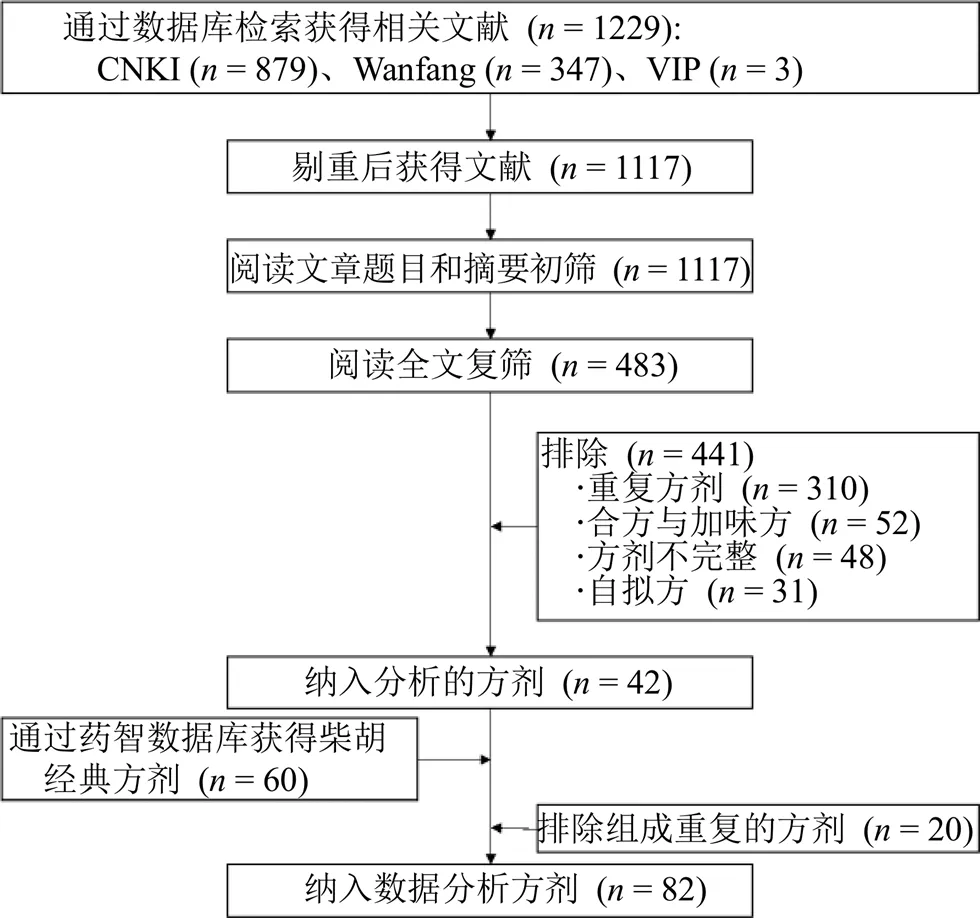
图1 文献检索流程
2.2 纳入中药频次分析
本研究经过筛选排除,共纳入82首含柴胡方剂,除柴胡外共计涉及204味中药,出现频数共897次。对频数≥8次的药材进行频数、频率统计分析发现共涉及中药30味,累计使用565次。所涉及中药使用频次见表2。
表2 含柴胡处方中常用药物(频数≥8次)
Table 2 Commonly used drugs in prescriptions containing Bupleuri Radix (frequency ≥ 8)
中药频数占比/%中药频数占比/%中药频数占比/% 柴胡8314.69枳壳173.01羌活122.12 白芍38 6.73白术162.83黄连101.77 甘草37 6.55生地黄162.83牡丹皮101.77 当归32 5.66人参152.65香附101.77 黄芩32 5.66炙甘草152.65独活 91.59 茯苓26 4.60薄荷142.48桃仁 91.59 陈皮21 3.72防风142.48知母 91.59 川芎20 3.54赤芍132.30大枣 81.42 桔梗20 3.54生姜132.30泽泻 81.42 半夏18 3.19黄芪122.12栀子 81.42
2.3 关联规则分析
以支持度≥15%、置信度≥80%、最大前项数1~4、提升≥1为条件进行关联规则分析,共得到关联规则13组,其关联规则展示见表3。支持度反映了柴胡与另一种药物同时出现的概率,置信度反映了出现了柴胡后另一种药出现的概率,增益反映了柴胡的出现对另外一种药物的出现概率产生的变化,实例表示前项与后项出现在同一个方剂中的实际数目,关联规则反映了柴胡与高频药物之间的关联性。与柴胡配伍高频药物关系的网络化分析见图2,节点代表中药,连线粗细表示关联程度。可见,甘草、白芍、当归、黄芩与柴胡之间的配伍关联程度强。
表3 高频药物间的关联规则分析
Table 3 Association rule analysis among high frequency drugs
后项前项实例/个支持度/%置信度/%增益 柴胡白芍3845.783 13100.001.03 柴胡甘草3744.578 31 93.330.96 柴胡当归3238.554 22100.001.03 柴胡黄芩3238.554 22100.001.03 柴胡茯苓2631.325 30 95.000.98 柴胡陈皮2125.301 20100.001.03 柴胡桔梗2024.096 39100.001.03 柴胡川芎2024.096 39100.001.03 柴胡半夏1821.686 75 93.330.96 柴胡枳壳1720.481 93100.001.03 柴胡生地黄1619.277 11100.001.03 柴胡白术1619.277 11100.001.03 柴胡炙甘草1518.072 29100.001.03
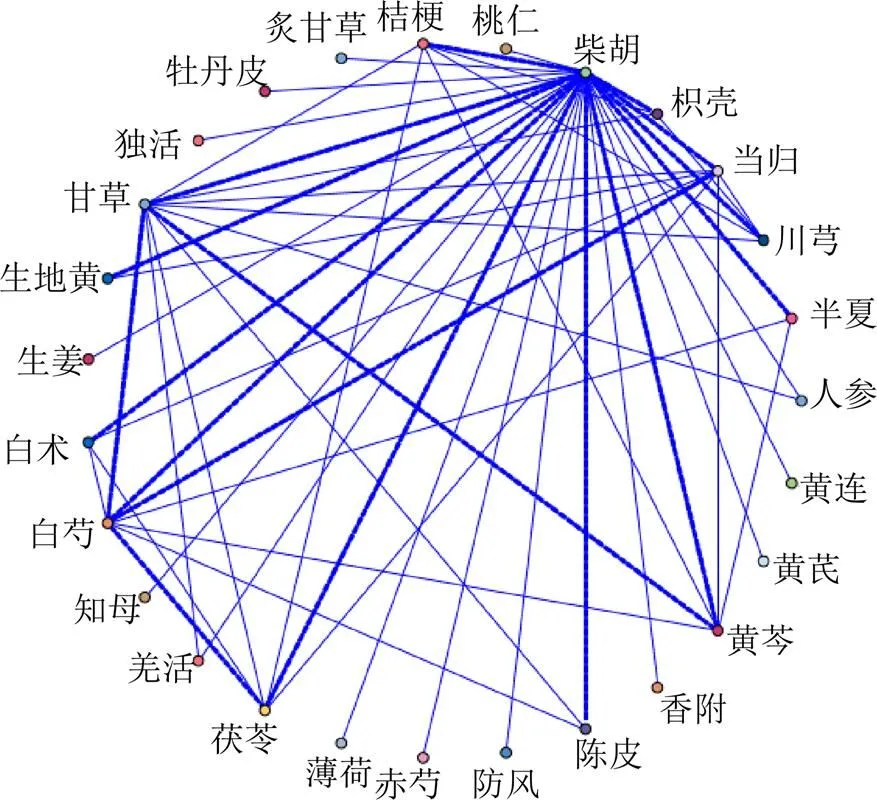
图2 高频药物间的关联网络展示
2.4 聚类分析
运用IBM SPSS26.0软件对使用频次≥8的30味高频中药进行聚类分析,聚类方法为组间联接,测量区间采用Pearson算法,以组间距离23.5为界,除柴胡单独聚类外,高频药物可分为5组,聚类分析结果见图3。与柴胡配伍的高频中药可聚为5类,见表4。

图3 高频药物聚类树状图
表4 柴胡潜在新组合
Table 4 Potential new combinations of Bupleuri Radix
序号中药组成 C1羌活、独活、川芎、桔梗、枳壳、甘草、茯苓、白术、薄荷 C2生姜、大枣、人参、黄芩、半夏、 C3白芍、香附、陈皮、牡丹皮、栀子、当归、防风、黄连、泽泻 C4黄芪、知母、炙甘草 C5生地黄、赤芍、桃仁
2.5 “柴胡劫肝阴”的网络毒理学分析
2.5.1 柴胡肝毒性关键成分和靶点筛选 通过文献检索,本研究发现柴胡主要肝毒性成分为柴胡皂苷和挥发油[10-14],具体见表5。并将化合物的Canonical SMILES格式导入SwissTargetPrediction得到柴胡潜在成分的靶点,去重后得到柴胡潜在毒性靶标298个。与198个肝毒性靶点取交集,得到柴胡致肝毒性潜在靶点20个。并将20个柴胡致肝毒性靶点导入STRING数据库构建PPI网络,见图4。拓扑分析结果显示,颜色深浅与度值呈正比,其中前列腺素内过氧化物合成酶2(prostaglandin-endoperoxide synthase2,PTGS2)、氧化物酶体增殖物激活受体γ(peroxisome proliferator activated receptor γ,PPARG)、氧化物酶体增殖物激活受体α(peroxisome proliferator activated receptor α,PPARA)、白细胞介素-2(interleukin-2,IL-2)位于网络核心位置。
2.5.2 柴胡-肝毒性网络构建 将柴胡的毒性成分和柴胡致肝毒性潜在靶点导入Cytoscape,构建柴胡-肝毒性网络,见图5。图中拓扑分析显示,MOL004635(柴胡皂苷A)、MOL004637(柴胡皂苷D)等成分及IL-2、血管内皮生长因子受体(kinase insert domain receptor,KDR)、PTSG2等靶点处于网络核心位置。
2.5.3 柴胡肝毒性潜在信号通路富集分析 利用R软件对20个柴胡致肝毒性潜在靶点进行信号通路富集分析,得到61条富集结果,根据校正后的值,对其进行排序选取前20条信号通路进行展示,见图6,图中化学致癌-DNA加合物(chemical carcinogenesis-DNA adducts)、药物代谢-细胞色素(drug metabolism-cytochrome)等肝脏代谢机制相关通路与本研究关系密切。
表5 柴胡潜在肝毒性成分
Table 5 Potential hepatotoxic constituents of Bupleuri Radix
化合物ID化合物名称 MOL004635[10]柴胡皂苷a(saikosaponin a) MOL004701[11]柴胡皂苷c(saikosaponin c) MOL004637[12]柴胡皂苷d(saikosaponin d) MOL004693[11]柴胡皂苷b1(saikosaponin b1) MOL004703[11]柴胡皂苷e(saikosaponin e) MOL004695[11]柴胡皂苷b2(saikosaponin b2) MOL004640[11]柴胡皂苷f(saikosaponin f) MOL004718[11,13]α-菠菜甾醇(α-spinasterol) MOL005217[11,13]Δ7-豆甾烯醇(delta7-stigmasterol) MOL008414[11,13]Δ22-甾醇豆烯(delta22-stigmasterol)
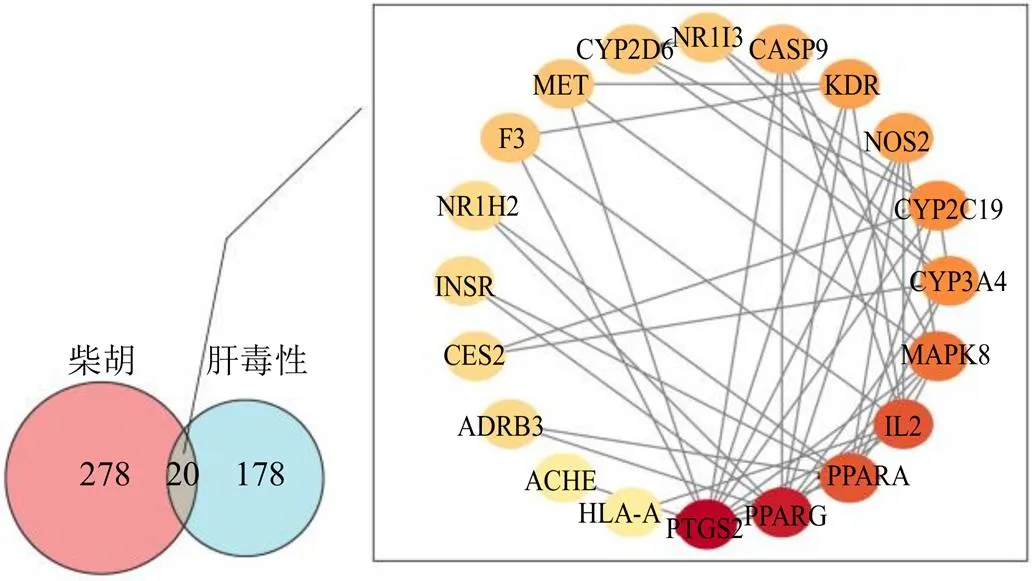
图4 柴胡毒性成分靶点与肝毒性靶点的PPI网络分析
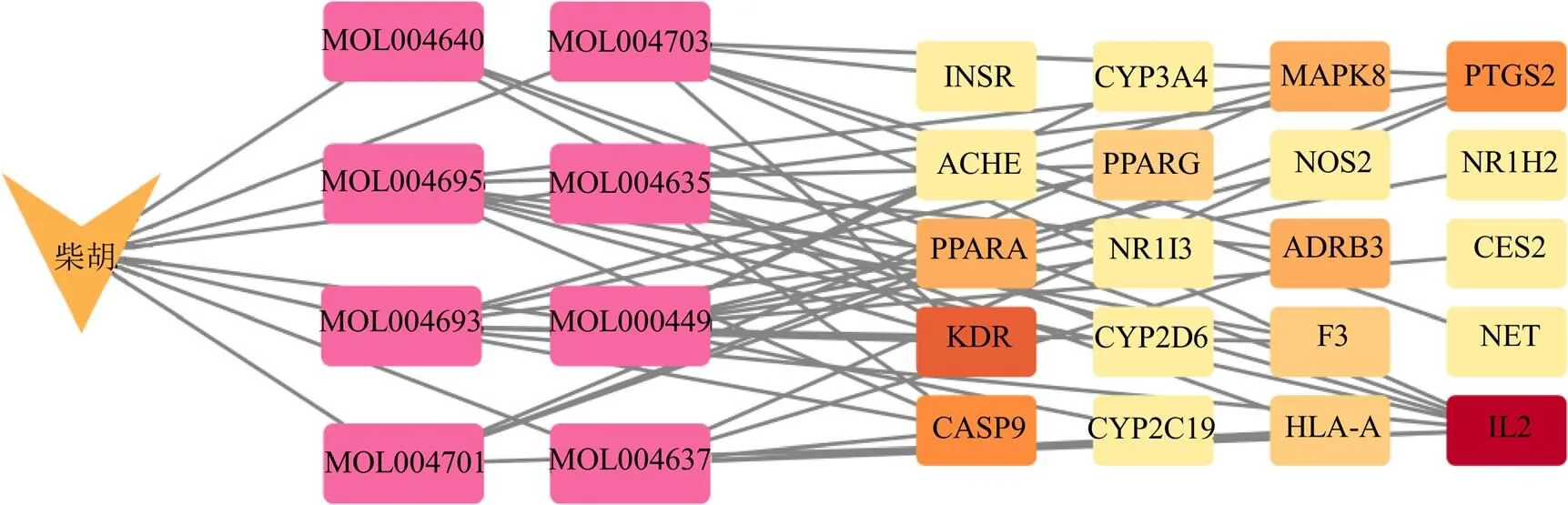
图5 柴胡成分-肝毒性网络分析
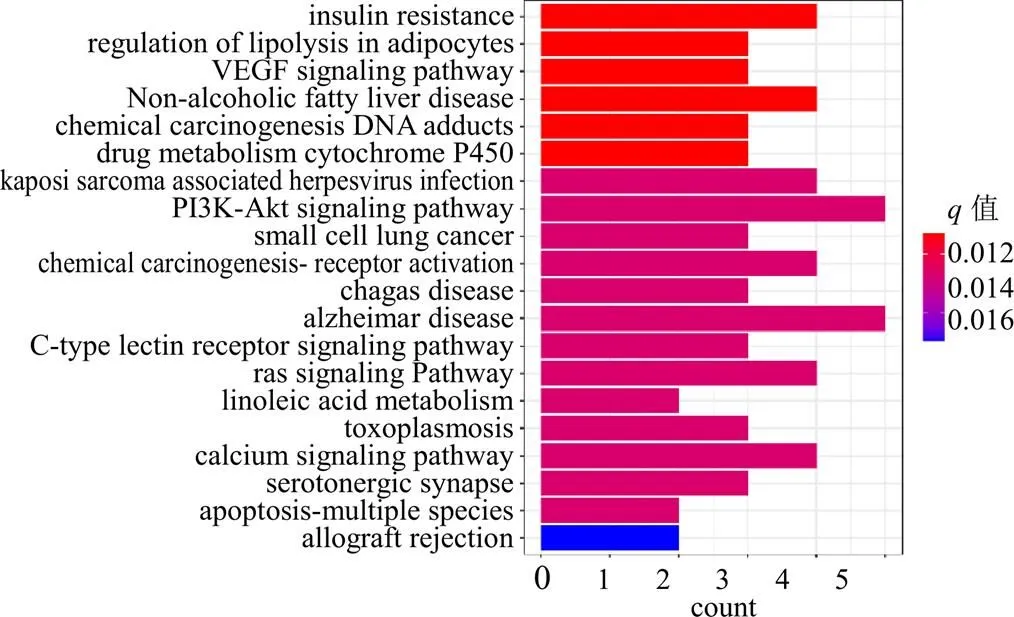
图6 柴胡肝毒性靶点的前20条信号通路富集分析
2.6 “柴胡劫肝阴”相杀配伍的网络药理学分析
2.6.1 高频配伍中药与柴胡肝毒性的共有靶点 对含柴胡的经典方剂进行高频中药关联分析发现,柴胡与甘草、柴胡与白芍、柴胡与当归、柴胡与黄芩支持度较高,且具有养阴滋阴和养血的功效,故将其纳入为可解“柴胡劫肝阴”的潜在中药。根据筛选标准从TCMSP分别得到甘草92个化学成分和205个潜在靶点,白芍13个化学成分和79个潜在靶点,当归2个化学成分和43个潜在靶点,黄芩15个化学成分和81个潜在靶点。将这些靶点分别与柴胡潜在致肝毒性靶点取交集,得到甘草-柴胡肝毒性5个靶点,白芍-柴胡肝毒性9个靶点,当归-柴胡肝毒性2个靶点,黄芩-柴胡肝毒性5个靶点,具体见图7。
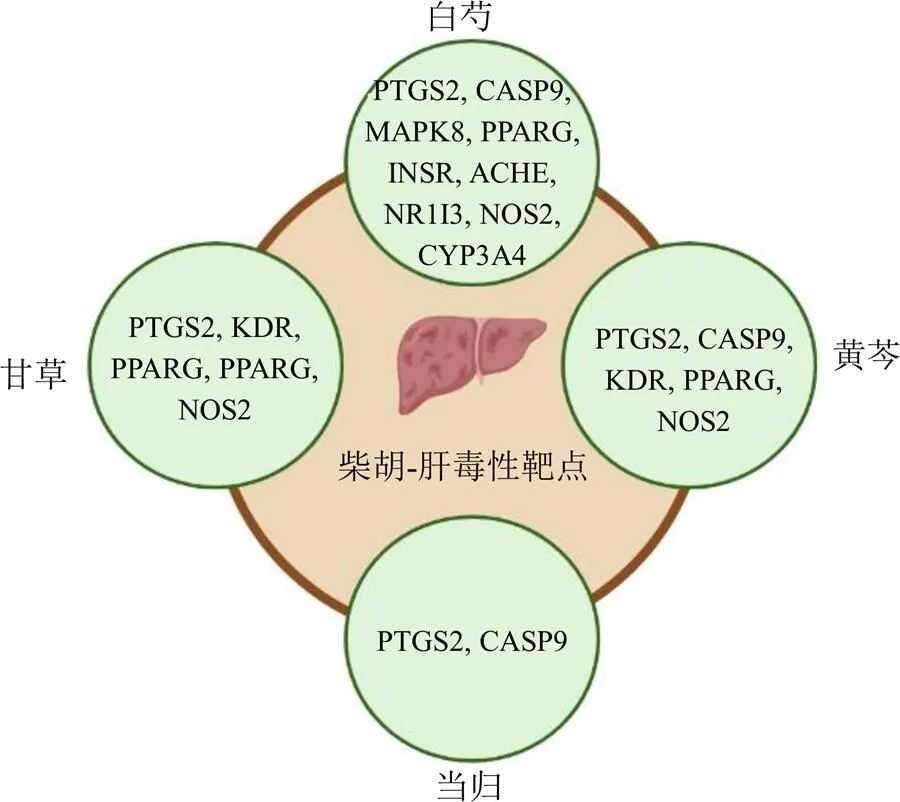
图7 高频药物与柴胡肝毒性共同靶点
2.6.2 中药-柴胡肝毒性信号通路富集分析 利用R软件对潜在中药与柴胡肝毒性共同靶点进行信号通路富集分析,其中甘草-柴胡肝毒性17条通路,白芍-柴胡肝毒性49条通路,当归-柴胡肝毒性38条通路,黄芩-柴胡肝毒性33条通路,具体见图8。4味中药调控肝毒性靶点均参与阿尔茨海默病(Alzheimer’s disease),化学致癌-DNA加合物等通路。
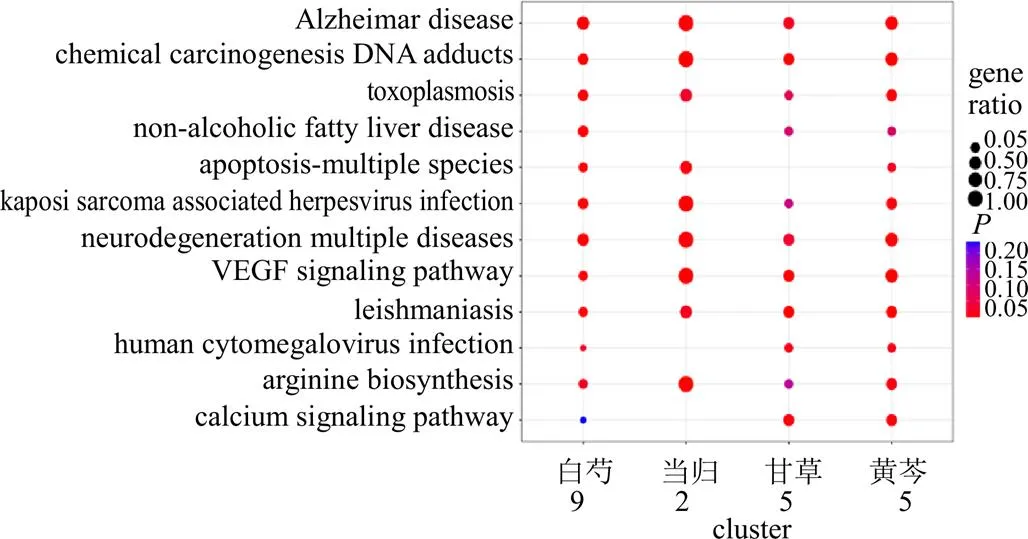
图8 高频药物与柴胡肝毒性靶点的通路富集分析
2.6.3 柴胡配伍减毒调控网络的构建 将柴胡潜在毒性成分、潜在毒性靶点及甘草、白芍、当归、黄芩的潜在化学成分构建柴胡配伍减毒调控网络,见图9。图中4味中药中甘草的化学成分最多,其次为黄芩和白芍,当归最少,拓扑分析显示,PTGS2与4味中药的化学成分相互作用较为密切。
3 讨论
“柴胡劫肝阴”之说首见于林北海重刊张司农《治暑全书》序文,叶天士《临证指南医案》推崇此观点,认为“柴胡劫肝阴,葛根竭胃汁”,致使很多人误认为此论是叶氏首倡。王孟英则直接说明此说并非叶天士首创:“柴、葛之弊二语,见林北海重刊张司农《治暑全书》,叶氏引用,原非杜撰,洄溪妄评,殊欠考也”。叶天士遵从此说,吴鞠通、王孟英、张山雷等力倡此说,对后世影响较深远。如王孟英《王氏医案》记载:“柴胡汤劫汗伤阴”。动物实验表明,长期使用柴胡对大鼠肝脏有明显的毒性作用[11,15],但其具体机制目前尚不明确。配伍是中药复方的特色,相杀配伍能起到减毒增效的作用。因此,临床上如何安全地配伍使用柴胡也成为目前困扰的问题。
柴胡的主要毒性成分为柴胡皂苷与挥发油。研究发现柴胡总皂苷具有明显的急性和累积肝毒性[16]。柴胡中挥发油成分可通过肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、IL-6、IL-10等细胞因子介导肝细胞的损伤[17]。在柴胡成分-肝毒性网络中,柴胡皂苷a和柴胡皂苷d处于核心的位置。柴胡皂苷a通过氧化损伤机制,破坏细胞膜,使细胞发生损伤而引起肝细胞毒性[18]。柴胡皂苷d可诱导细胞膜通透性改变,导致肝细胞损伤[19]。对柴胡致肝毒性的共同靶点构建PPI网络,PTGS2、PPARG、PPARA是柴胡致肝毒性的潜在靶标。PTGS2催化合成前列腺素具有促进细胞增殖、抑制细胞凋亡、抑制免疫监视的作用,是肝损伤的重要炎症介质[20]。PPARG具有保护肝细胞免于凋亡和坏死的作用,PPARG失活可能促进炎性单核细胞趋化及M2型分化,加重肝损伤[21-22]。PPARA影响肝脏脂肪代谢,抑制其活性或表达可引起肝炎和脂肪堆积[23]。信号通路富集分析结果表明,药物代谢-细胞色素通路是柴胡致肝毒性的潜在作用通路。细胞色素P450(cytochrome P450,CYP450)酶是生物转化酶的一个超家族具有促进药物代谢的作用。动物实验表明,柴胡总皂苷可导致对小鼠CYP450升高,诱导肝损伤[24]。综上,柴胡通过柴胡皂苷与挥发油等潜在毒性成分,作用于PTGS2、PPARG、PPARA等靶点,影响药物代谢-细胞色素通路,引发机体肝毒性。
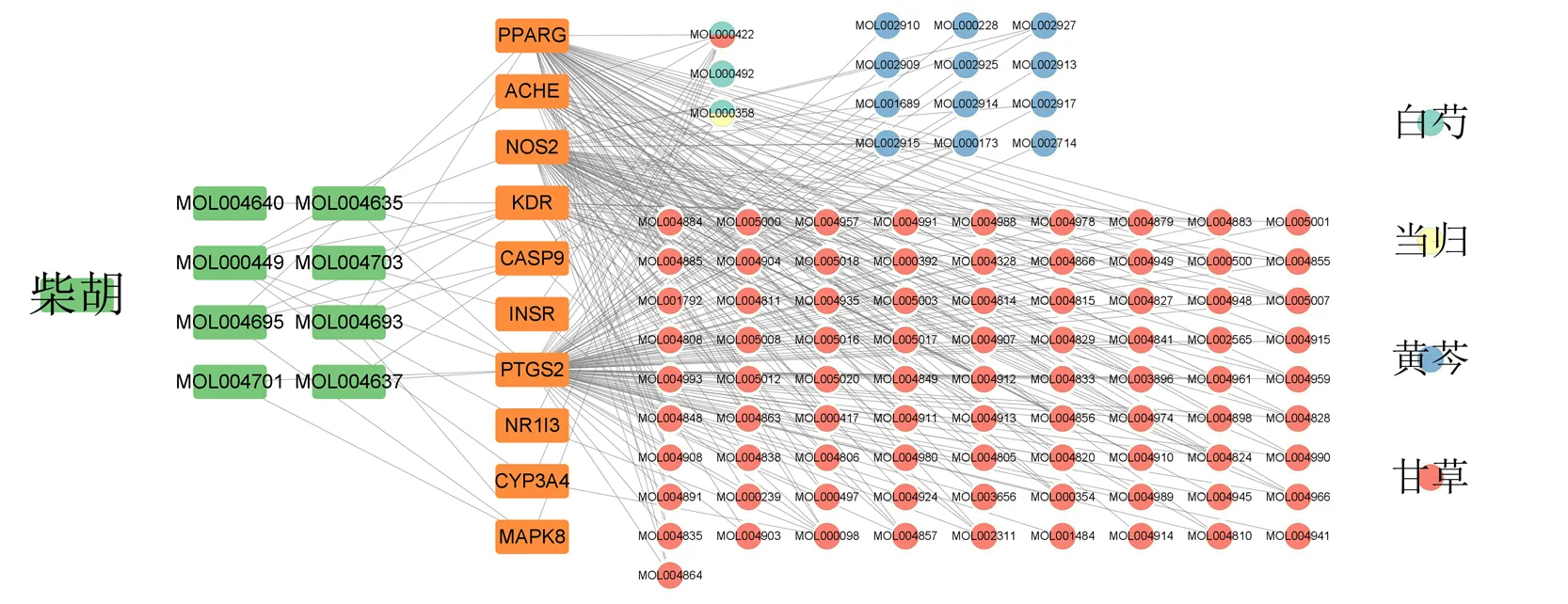
图9 柴胡配伍减毒调控网络
相杀即一种药物能减轻或消除另一种药物的毒性或副作用,首见于《神农本草经》。其序云:“药……有相反者,有相杀者。凡此七情,合和视之”。相杀理论与临床处方的有效性和安全性密切相关。对含柴胡的82首方剂进行分析,发现甘草、白芍、当归、黄芩是含柴胡方剂的主要配伍药物。甘草在诸方中多担使药,可缓肝阴以养肝,配伍柴胡可增强肝的疏泄调达作用;当归养血和肝,配伍柴胡,阴血得补而肝体得用;芍药益阴柔肝,制柴胡辛散之性,使肝不横逆,疏泄条达;黄芩具有泻肝火滋肝阴的功效,二药合用共奏清解少阳邪热之功。受“柴胡劫肝阴”思想的影响,柴胡与甘草、白芍、当归、黄芩的配伍在临证处方中应用较广。如白长川教授临证时柴胡多与白芍、当归等滋阴养血药配伍,以补肝阴,助肝用[25]。唐旭东教授临证使用柴胡时常配合白芍、当归等补血养阴之品[26]。聂莉芳教临床处方中注重柴胡剂量,常在使用柴胡的同时配伍当归、白芍、黄芩等[27]。因此,由临证经验可知,柴胡与甘草、白芍、当归、黄芩的配伍能解“柴胡劫肝阴”,一定程度上可减少柴胡的不良反应。
现代药理研究表明,甘草、白芍、当归、黄芩与柴胡相配伍可能通过多种机制发挥改善肝功能损伤的功效。甘草具有保肝的作用,其中甘草类制剂(如复方甘草酸苷等)均有改善肝功能指标及临床症状的作用。甘草发挥了多个成分拮抗柴胡肝毒性的作用,其中槲皮素可能是甘草发挥护肝作用的核心成分。槲皮素对肝细胞毒性具有保护作用,其机制与抑制活性氧水平、改善线粒体功能有关[28]。白芍具有抗炎和保护肝细胞损伤的作用,其主要成分山柰酚可以通过降低肝脏炎症微环境、抗氧化和抗凋亡保护肝实质细胞[29]。当归的主要成分β-谷甾醇可以抑制胶原沉积并减轻肝损伤[30]。黄芩和柴胡配伍可通过抗凋亡、抗氧化、抑制环氧合酶、抗炎等机制发挥肝保护的作用[31-32]。黄芩主要成分黄酮类可有效降低肝脏转氨酶水平[33]。柴胡配伍减毒调控网络中,发现甘草的槲皮素、甘草和白芍的山柰酚、白芍和当归的β-谷甾醇、黄芩的黄芩黄酮,均有拮抗柴胡致肝毒性的潜在作用。PTGS2、NOS2、PPARG、乙酰胆碱酯酶(acetylcholinesterase,ACHE)、KDR是柴胡肝毒性的潜在毒性靶点。体内外实验发现,甘草[34]、白芍[35]、当归[36]、黄芩[37]对PTGS2具有抑制作用。此外,甘草可以抑制NOS2[38]、PPARG[39]、ACHE[40]的表达。综上,甘草、白芍、当归、黄芩具有多成分拮抗柴胡肝毒性的作用,PTGS2可能是潜在的拮抗靶点。
本研究利用网络毒理学对柴胡致肝毒性的作用机制进行探讨,通过数据挖掘对经典名方中柴胡的配伍进行分析,并通过网络药理学对配伍机制进行预测,旨在通过现代生物信息学技术阐明中药配伍对柴胡肝毒性的减毒作用,对柴胡的临床应用及新药研发提供指导。
利益冲突 所有作者均声明不存在利益冲突
[1] 李崧, 刘桂荣, 高文勇. 张志远应用柴胡经验 [J]. 中医杂志, 2021, 62(5): 386-389.
[2] 侯艾琳, 戴雁彦, 张秀文, 等. 从“心主神明”探讨郭维琴治疗冠状动脉粥样硬化性心脏病经验 [J]. 中华中医药杂志, 2022, 37(2): 831-834.
[3] 侯磊, 王亮, 刘闰平, 等. 基于谱毒关系和肝毒网络整合模式的柴胡水煎液肝毒物质基础研究 [J]. 中草药, 2020, 51(10): 2798-2806.
[4] 栗焕焕, 张国琴, 邱紫莹, 等. 基于指纹图谱结合化学计量学的吴茱萸-甘草配伍减毒化学成分研究 [J]. 中草药, 2022, 53(6): 1730-1739.
[5] 罗羽莎, 闻俊, 周婷婷. 栀子肝毒性及配伍减毒研究进展 [J]. 中华中医药学刊, 2021, 39(7): 119-123.
[6] 张东佳, 彭云霞, 魏莉霞, 等. 《中国药典》、古代经典方剂中含羌活制剂分析 [J]. 中成药, 2020, 42(10): 2800-2805.
[7] Shannon P, Markiel A, Ozier O,. Cytoscape: A software environment for integrated models of biomolecular interaction networks [J]., 2003, 13(11): 2498-2504.
[8] Yu G C, Wang L G, Han Y Y,. clusterProfiler: An R package for comparing biological themes among gene clusters [J]., 2012, 16(5): 284-287.
[9] 牛明, 张斯琴, 张博, 等. 《网络药理学评价方法指南》解读 [J]. 中草药, 2021, 52(14): 4119-4129.
[10] 夏青, 韩利文, 张云, 等. 基于斑马鱼模型的柴胡皂苷a保肝作用与肝毒性研究 [J]. 中国中药杂志, 2019, 44(13): 2662-2666.
[11] 刘亚旻, 刘新民, 潘瑞乐. 柴胡毒性作用研究进展 [J]. 中成药, 2012, 34(6): 1148-1151.
[12] 李晓宇, 李晓骄阳, 孙蓉. 柴胡皂苷d对人肝细胞L-02 “量-时-毒”关系及机制研究 [J]. 中药药理与临床, 2016, 32(2): 87-90.
[13] 谭玲玲, 陈莹, 蔡霞, 等. 北柴胡的生物学及化学成分的研究进展 [J]. 中草药, 2005, 36(9): 1431-1433.
[14] 张凯, 董晓敏, 王琦, 等. 常用中药肝毒性成分代谢与毒理研究进展 [J]. 中草药, 2018, 49(22): 5435-5447.
[15] 吕天, 牟红元, 冯江江, 等. 中药柴胡总皂苷急性肝毒性的代谢组学研究 [J]. 化学研究与应用, 2013, 25(6): 789-792.
[16] 黄伟, 吕丽莉, 任海勇, 等. 柴胡总皂苷粗提物致大鼠肝毒性氧化损伤机制研究 [J]. 中草药, 2009, 40(S1): 227-229.
[17] 杨倩, 孙蓉. 柴胡挥发油致大鼠肝损伤中细胞因子与NO损伤机制研究 [J]. 中国药物警戒, 2011, 8(8): 459-461.
[18] 李晓宇, 李晓骄阳, 孙蓉. 柴胡皂苷a对人肝细胞L-02的体外肝毒性机制研究[A] // 2013年中国药学大会暨第十三届中国药师周论文集[C]. 南宁: 中国药学会, 2013: 74-82.
[19] 李晓宇, 窦立雯, 孙佳惠, 等. 柴胡皂苷d药理与毒理作用研究进展 [J]. 中国药物警戒, 2015, 12(4): 207-210.
[20] Motiño O, Francés D E, Casanova N,. Protective role of hepatocyte cyclooxygenase-2 expression against liver ischemia-reperfusion injury in mice [J]., 2019, 70(2): 650-665.
[21] Marion-Letellier R, Savoye G, Ghosh S. Fatty acids, eicosanoids and PPAR gamma [J]., 2016, 785: 44-49.
[22] 杨辉. DEHP/乙醇通过PPARα/γ信号通路致肝脏损伤的联合毒性效应研究[A] // 2019年海峡两岸暨港澳青年科学家毒理学学术交流会论文集[C]. 太原: 中国毒理学会, 2019: 16-15.
[23] 邵胜利, 杨熹, 徐丰. PIK3R3通过PPARA调节肝癌细胞脂质代谢及增殖 [J]. 华中科技大学学报: 医学版, 2019, 48(2): 129-136.
[24] 黄幼异, 黄伟, 孙蓉. 基于肝药酶P450动态变化的柴胡总皂苷小鼠肝毒性剂量-时间-毒性关系研究 [J]. 中国实验方剂学杂志, 2012, 18(22): 299-303.
[25] 沙灵汐, 杜丹丹, 白长川, 等. 白长川教授柴胡应用心法 [J]. 中华中医药学刊, 2021, 39(11): 130-133.
[26] 秦金燕. 唐旭东教授论治IBS-D经验挖掘及痛泻要方对IBS-D肝郁脾虚证患者SCFAs的影响 [D]. 北京: 北京中医药大学, 2021.
[27] 徐建龙, 孙红颖, 王瑞芳. 聂莉芳分期辨治IgA肾病用药经验 [J]. 上海中医药杂志, 2009, 43(12): 1-3.
[28] 陈廷玉, 陈大印, 沈洪, 等. 槲皮素对异烟肼诱导肝细胞毒性的保护作用及其机制 [J]. 癌变·畸变·突变, 2021, 33(1): 12-16.
[29] Xiao X L, Hu Q C, Deng X Y,. Old wine in new bottles: Kaempferol is a promising agent for treating the trilogy of liver diseases [J]., 2022, 175: 106005.
[30] Kim K S, Yang H J, Lee J Y,. Effects of β-sitosterol derived fromon the activated human hepatic stellate cells and dimethylnitrosamine-induced mouse liver fibrosis [J]., 2014, 14: 363.
[31] 李亚芹, 瞿融. 柴胡和黄芩配伍的研究进展 [J]. 中国中医基础医学杂志, 2018, 24(2): 282-285.
[32] 于蓓蓓, 闫雪生, 周洪雷. 基于UPLC-Q-Exactive Orbitrap-MS谱-效相关的柴胡-黄芩药对解热质量标志物的筛选及含量测定方法的建立 [J]. 中草药, 2022, 53(7): 1983-1992.
[33] 李欣坪, 乔雪, 王蒙蒙, 等. 滇黄芩黄酮的调脂保肝作用及其对肝组织HMGCR、CYP7A1活性影响的研究 [J]. 中国现代应用药学, 2022, 39(2): 168-173.
[34] Shin E M, Zhou H Y, Guo L Y,. Anti-inflammatory effects of glycyrol isolated fromin LPS-stimulated RAW264.7 macrophages [J]., 2008, 8(11): 1524-1532.
[35] Zheng Y Q, Wei W, Zhu L,. Effects and mechanisms of Paeoniflorin, a bioactive glucoside from paeony root, on adjuvant arthritis in rats [J]., 2007, 56(5): 182-188.
[36] 李杨, 周岚, 汪典, 等. 不同剂量活血、破血中药对动脉粥样硬化小鼠主动脉PTGS2、PADI4、ITGAM基因表达的影响 [J]. 疑难病杂志, 2016, 15(11): 1182-1186.
[37] Lim H S, Kim O S, Kim B Y,. Apigetrin fromGeorgi inhibits neuroinflammation in BV-2 microglia and exerts neuroprotective effect in HT22 hippocampal cells [J]., 2016, 19(11): 1032-1040.
[38] Richard S A. Exploring the pivotal immunomodulatory and anti-inflammatory potentials of glycyrrhizic and glycyrrhetinic acids [J]., 2021, 2021: 6699560.
[39] 郑庆轩. 基于18β-甘草次酸的先导化合物的设计,合成及抗肿瘤活性研究 [D]. 济南: 山东大学, 2019.
[40] 王鹭, 方平飞. 神经递质紊乱与甘草神经保护作用的相关研究现状 [J]. 中国临床药理学杂志, 2021, 37(17): 2364-2368.
Analysis of mutual-detoxication compatibility rules of “decreaseing liver’sessence” based on data mining
LIU Qing-song, LI Wei, ZHANG Yi, CHEN Shuang-lan, XIE Zi-yan, LI Bin
Hospital of Chengdu University of Traditional Chinese Medicine, Chengdu 610075, China
To analyze the compatibility rules of classical prescriptions containing Chaihu () and elucidate the molecular mechanism of “decreaseing liver’sessence” and the compatible high frequency drugs to “detoxification and efficacy” ofbased on data mining technology, providing the idea for clinical application and new drug research and development.The prescriptions ofwere searched through the databases of YaoZh, CNKI, Wanfang, and VIP using Excel 2019 and IBM SPSS Modeler 18.0 and IBM SPSS 26.0 software for frequency analysis and cluster analysis. The toxic components, toxic targets and regulatory network of “decreaseing liver’sessence” were analyzed by network toxicology. The hepatotoxicity components-target network diagram of high-frequency compatible traditional Chinese medicine (TCM) andwas constructed through network pharmacology.A total of 82 prescriptions containingwere screened, involving 205 TCMs with 897 frequency, and 13 sets of association rules were obtained by association rule analysis. The results of network toxicology showed that saponins and volatile oil inwere the potential toxicity components; 298 potential toxicity targets, 198 hepatotoxicity targets, 20 potential hepatotoxicity, and 61 related signal pathways were obtained. The results of network pharmacology also showed that there were five targets and 17 pathways for hepatotoxicity of Gancao (et), nine targets and 49 pathways for hepatotoxicity of Baishao () and, two targets and 38 pathways for hepatotoxicity of Danggui () and, five targets and 33 pathways for hepatotoxicity ofand.was strongly associated withet,,andrespectively. They have the antagonistic effect againsthepatotoxicity. Prostaglandin-endoperoxide synthase 2 (PTGS2) may be a potential antagonistic target, providing a basis for guiding the rational clinical application of prescriptions containing.
;data mining; network pharmacology;decreaseing liver’sessence; mutual-detoxication compatibility; traditional Chinese medicine toxicity;et;;;; saikosaponin
R285
A
0253 - 2670(2022)14 - 4428 - 09
10.7501/j.issn.0253-2670.2022.14.022
2022-04-10
国家自然科学基金面上项目(82174345);四川省科技计划项目(2021YJ0435)
刘青松(1997—),男,硕士研究生,研究方向为中医药防治脾胃系病证的研究。Tel: 18408297768 E-mail: lqscptp@163.com
李 斌(1987—),男,副教授,硕士研究生导师,研究方向为中医药防治老年疾病的研究。Tel: 15882463615 E-mail: leebin1987@163.com
[责任编辑 潘明佳]
