代谢组学在中医药领域的应用与展望
2022-07-22崔芙岩杨佳颖王志刚李贤煜杨洪军
崔芙岩,杨佳颖,王志刚,李贤煜,陈 鹏,杨洪军, 3,郭 娜
·综 述·
代谢组学在中医药领域的应用与展望
崔芙岩1, 2,杨佳颖1, 2,王志刚1,李贤煜2,陈 鹏2,杨洪军2, 3*,郭 娜2*
1. 黑龙江中医药大学药学院,黑龙江 哈尔滨 150000 2. 中国中医科学院 医学实验中心,北京 100700 3. 中国中医科学院 中药研究所,北京 100700
代谢组学作为系统生物学的重要组成部分,与中医药基础理论的“整体观”具有一致性,通过现代分析技术手段检测生物体系内代谢产物的变化,更准确、直接地反映生物体系的终端和表型信息,揭示中医药治疗复杂疾病的作用机制。将中医药研究与代谢组学方法相互结合是中医药现代化进程的重要之举,为探求中医药研究新思路和新方法奠定重要基础。通过对近10年相关研究成果进行归纳,概述代谢组学在中医证候、中药作用机制、中药安全性评价和中药质量控制等方面的应用和研究进展,分析和总结代谢组学在中医药领域中的研究方法,并提出代谢组学在中医药研究中的思考和展望。
代谢组学;中医药;应用;证候;作用机制;安全评价;质量控制
中医药研究一直以整体观为基础,注重多靶点协同的联合作用机制,致力于维持人体内外平衡以攻克疾病。近些年来中医药科研成果丰硕,在世界范围内受到越来越多的认可和普及,尤其是在疾病早期干预、联合用药、肿瘤控制、辨证治疗等方面显示出巨大优势。但是,中医药治疗疾病的科学内涵仍缺乏现代研究的证明。同时,中医药多组分、多靶点、多途径的特点,决定了其作用机制的复杂性,也正是中医药研究难以突破的关键问题。因此,建立联系中医药与现代化研究的重要桥梁已成为现代医学研究的主要焦点。代谢组学技术最早由Nicholson教授在1999年提出,即以生物体内的小分子代谢物为研究对象,通过多种现代分析技术从整体水平测定体内代谢物的动态变化,多角度解析生命体生理和病理状态[1]。代谢组学的整体性、动态性研究体系与中医药“整体观”的研究思想不谋而合,与中医药多靶点、多途径的作用特点相匹配,能精准分析生物体系功能水平和代谢物的变化,为从微观上解读中医药复杂作用机制和科学内涵提供崭新的方法和理论视角,使中西医结合成为了可能[2-5]。
本文通过总结近10年相关文献,综述代谢组学在中医证候、中药药效作用机制、中药安全性评价和中药质量控制的应用进展,对代谢组学研究方法和相关代谢通路进行概括。以疾病为切入点,详细列出代谢组学在中医证候与疾病及病证结合和中药药效作用机制方面的研究成果。并对代谢组学在中医药研究中存在的问题和脂质代谢组学、空间代谢组学、代谢流分析等前沿技术进行思考和展望,以期为中医药代谢组学研究提供新思路,为进一步揭示中医药科学内涵和推动中医药现代化发展提供参考和指引。
1 代谢组学技术研究流程和方法
完整的代谢组学研究流程(图1)包括样本前处理、代谢物分析、数据分析、代谢物鉴定和代谢通路分析。目前,代谢组学常用的生物样本处理方法为溶剂沉淀、固相萃取、液液萃取、超临界萃取等[6]。中药材样本前处理方法中,中药鲜品一般需液氮冷冻后研磨成粉后进行冷冻干燥,再由甲醇、乙腈等有机溶剂进行提取;中药饮片需根据所含化合物的类别,采用不同溶剂进行有效成分的提取。在检测方面,代谢组学由最初的非靶向代谢组学逐渐发展到靶向和拟靶向代谢组学,分析方法主要为核磁共振技术(nuclear magnetic resonance,NMR)和质谱法(mass spectrography,MS)。近些年来,NMR成功建立低温探针、毛细管探针、脉冲序列等技术,在短时间内可对多个样本进行定性和定量[7]。液相色谱(liquid chromatogram,LC)- MS(LC-MS)技术具有灵敏度高和稳定性强的双重优势,能够准确、定量生物样本中的痕量代谢物,是MS联用中应用最广泛的一种技术[8]。气相色谱(gas chromatography,GC)-质谱联用(GC-MS)技术需对样本进行衍生化预处理,适用于分析具有挥发性质的化合物。此外,高分辨质谱成像(mass spectrometry imaging,MSI)作为一种新型的分子影像技术,能进行代谢物的可视化分析,并结合MS的结构鉴定能力,获取代谢物的空间分布信息,常用的质谱成像技术有空气动力辅助电离(air flow assisted ionization,AFAI)质谱成像(AFAI-MSI)、基质辅助激光解吸电离(matrix-assisted laser desorption ionization,MALDI)质谱成像(MALDI-MSI)和解吸电喷雾电离质谱成像(desorption electrospray ionization,DESI-MSI)等[9-10]。代谢组学数据预处理包括基线校正、峰对齐、峰识别、归一化等,可通过MetaboAnalyst 5.0、Waters Progenesis QI和Compound Discoverer等软件完成。应用最广泛的数据模式识别方法为主成分分析(principal component analysis,PCA)、偏最小二乘判别分析(partial least squares-discriminant analysis,PLS-DA)、正交偏最小二乘判别分析(orthogonal partial least squares-discriminant analysis,OPLS-DA)等,进而采用变量投影重要性指标(variable importance in projection,VIP)筛选差异代谢物,通过HMDB、METLIN、Mass Bank等数据库鉴定潜在的生物标志物,经MetaboAnalyst 5.0和京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)等进行相关代谢通路分析[11]。
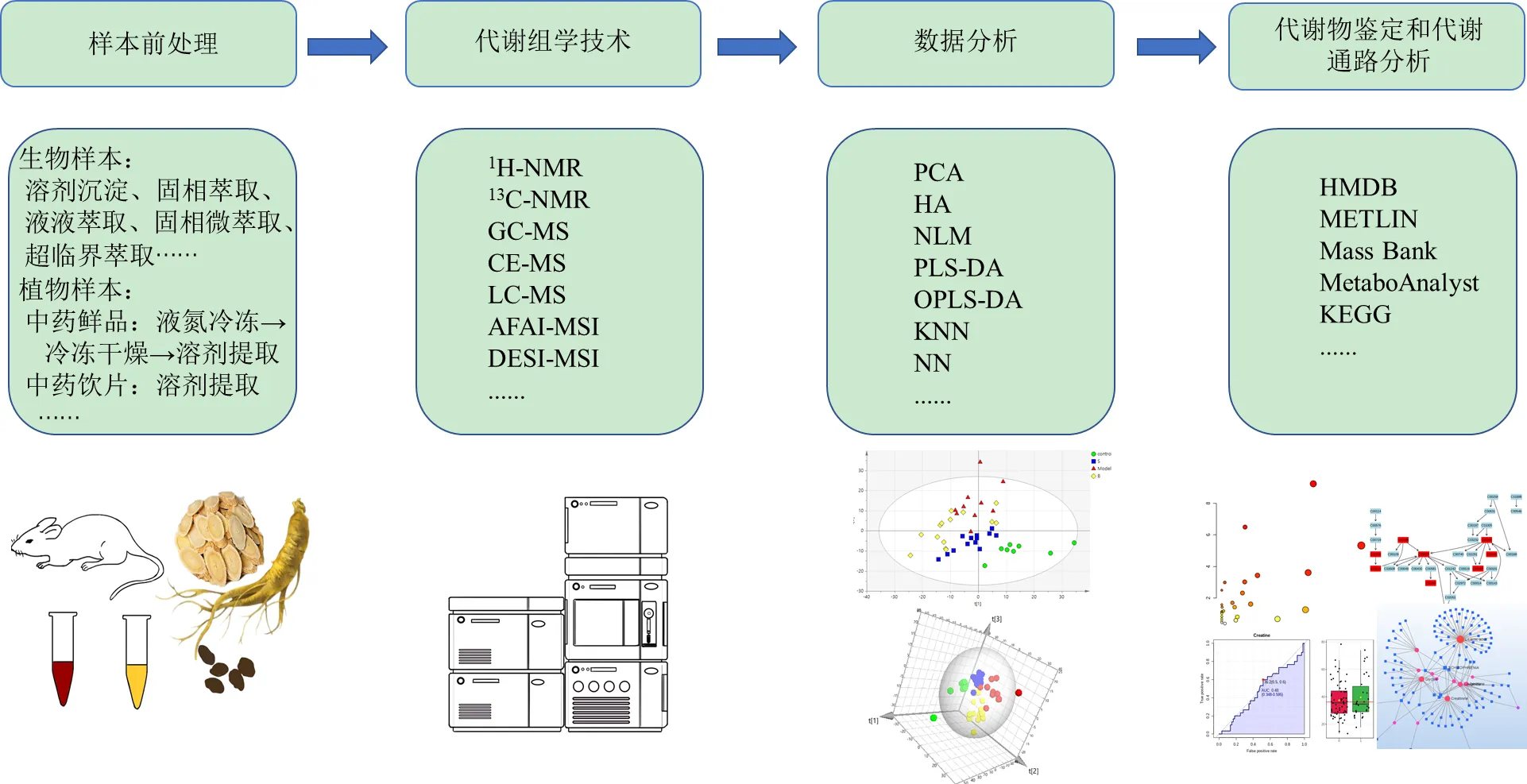
图1 代谢组学研究流程和方法
2 代谢组学在中医证候研究中的应用
中医证候是中医基础和临床研究的核心,指疾病发生和发展过程中某阶段人体特定内、外环境的反应,结合相关病理和辨证论治能够揭示患者的病因和病性等内容。证候具有特定的外候和内涵,外候是疾病和病理的外在表现,内涵是人体疾病表象背后蕴藏的发病机制和病理变化,其与生物体内代谢变化切实相关,是开展中医药研究的重要方向[12]。采用代谢组学对代谢物的可量化差异进行分析,为临床中医证候的客观化和精准化治疗提供新的研究思路和技术[13]。
Guo等[14]结合靶向和非靶向代谢组学方法对稳定型冠心病心绞痛实证和虚证临床血清样本进行分析,发现不同证型稳定型冠心病心绞痛具有不同的代谢特征,长链不饱和脂质代谢紊乱及能量代谢是冠心病心绞痛实证和虚证之间的关键区分点,脂质神经酰胺和不饱和脂肪酸可分别作为二者治疗的靶点,从而表明体内差异代谢物是中医辨证分型的物质基础。王亮等[15]对大量临床血浆样本的代谢特征进行分析,发现慢性萎缩性胃炎的发病机制与葡萄糖、丙氨酸、缬氨酸、谷氨酸、甘氨酸、乳酸等代谢途径紊乱相关,并发现慢性萎缩性胃炎脾胃虚寒证和脾胃湿热证患者在糖代谢、脂代谢、核酸代谢和氨基酸代谢存在显著差异,揭示慢性萎缩性胃炎同病异证的潜在作用机制。马欣等[16]、刘畅等[17]、Gu等[18]分别对湿热证非酒精性脂肪肝、乙肝、关节炎的代谢组学特征进行研究,3种异病同证中均发现糖代谢异常。非酒精性脂肪肝和乙肝合并湿热证的谷氨酸和核苷酸代谢异常,湿热证关节炎患者血浆中脯氨酸、糖基去氧胆酸水平升高,尿素、游离脂肪酸和多不饱和磷脂酰胆碱水平降低。肠道菌群对体内代谢具有调控作用,Lin等[19]结合代谢组学和16S rRNA测序技术对脾阳虚患者的血液、尿液和粪便等临床样本进行综合代谢和微生物分析,发现拟杆菌等活性菌与胆汁酸代谢,乙醛酸和二羧酸代谢,鞘脂代谢,色氨酸代谢,丙氨酸、天冬氨酸和谷氨酸代谢密切相关,肠道微生物与脾阳虚证候体内代谢差异相关。Jiang等[20]基于MALDI-MS技术首次全面分析肾阴虚合并糖尿病患者的代谢组学和蛋白质组学特征。结果发现,肾阴虚合并糖尿病患者的肌酐、柠檬酸、氧化三甲胺、苯丙氨酸和酪氨酸水平降低,丙氨酸、甘氨酸和牛磺酸水平升高,这些代谢物变化与氨基酸代谢、能量代谢和肠道菌群的改变有关,阐明中医辨证论治的分子基础。
以上研究表明,代谢组学通过分析同病异证、异病同证、同病异治和异病同治的差异代谢物和代谢途径,从而揭示中医证候的科学内涵。在同病异治上,慢性萎缩性胃炎脾胃虚寒证和脾胃湿热证2种证型患者的缬氨酸、乳果糖、异丁酸、肌肽等含量不同,可作为分析同一疾病2种证型的潜在依据[15];在异病同治上,肝纤维化和肺纤维化存在相似的代谢轨迹,尿液样本中均发现肾上腺素红、异柠檬酸、硫酸吲哚酚等相同的生物标志物,这些相同的代谢物及变化趋势为肝、肺纤维化的异病同治提供重要参考[21]。综合上述文献结果表明,代谢组学在中医证候的研究已由单一的证候向病证结合方向发展,将中医证候与疾病相结合,逐渐将中医证候的诊断和分析精确到点,以促进中医临床对疾病的预防和早期治疗。代谢组学在中医证候研究中的应用见表1。
3 代谢组学在中药药效及作用机制研究中的应用
中药及中药复方从整体调节人体疾病,最终起到标本兼治的作用,在长期慢性疾病的治疗上逐渐突显出优势,以达到临床干预的预期效果。中药多成分、多靶点、整体性的特点,增加了中药药效研究的困难程度,迫切需要建立一种在中医药理论指导下且符合中医药自身特点的现代化研究方法。代谢组学从整体出发,通过对生物体内代谢产物变化规律的认识,全面阐释中药对疾病的治疗机制[41]。中医药在防治心脑血管疾病上具有丰富的临床经验和用药历史,Xu等[42]基于UPLC-Q-TOF/MS和MALDI-MS 2种代谢组学分析方法研究益心舒胶囊对心力衰竭的作用机制,2种方法对心力衰竭代谢网络研究具有互补性,其分析结果相互验证。在心力衰竭进展过程中发现21种差异代谢物,主要与脂肪酸、磷脂酰胆碱、胆汁酸、氨基酸和丙酮酸等代谢途径相关。经益心舒胶囊治疗后,棕榈油酸、花生四烯酸、乳酸等16种代谢物具有明显的回调趋势。此外,利用MALDI-MS在心肌组织凋亡位置进一步对棕榈油酸、棕榈酸、花生四烯酸和乳酸4个生物标志物的变化趋势进行验证,阐明益心舒胶囊的作用机制。Liu等[43]采用代谢组学方法评价脑心通胶囊干预脑缺血大鼠疾病模型的整体疗效,在大鼠脑缺血后12 h的血浆中鉴定28种生物标志物,氨基酸、脂质、神经递质和能量代谢发生显著变化。脑心通胶囊治疗后发现大鼠神经功能缺损和脑梗死面积减小,谷氨酰胺、PE(17∶0)、LySoPE(20∶1)、LysoPE(24∶0)以及LysoPE(24∶1)等逐渐回调,说明药物通过调节单胺类神经递质代谢、氨基酸代谢、能量代谢和脂质代谢等多种途径发挥作用,以达到治疗脑缺血的目的。除此之外,还有学者对天麻钩藤汤[44]、四妙勇安汤[45]、保元汤[46]和四逆汤[47]等中药复方的心脑血管疾病治疗机制进行研究,为全面阐释中药治疗心脑血管疾病的物质基础和新药研发提供理论依据。Wang等[48]基于快速解析液相色谱-四极杆-飞行时间质谱(rapid resolution liquid chromatography-quadrupole-time of flight mass spectrometry,RRLC-Q-TOF/MS)分析人参治疗脾虚证前后患者尿代谢组学数据,发现15种与脾虚证和药物作用机制相关的生物标志物,药物通过调节脂质、氨基酸、能量、嘧啶和肠道菌群等代谢途径发挥作用,突显参芪治疗脾虚证患者在调节脂质代谢和肠道菌群代谢方面的特点。细胞代谢组学能直观体现疾病状态下某种细胞的代谢情况和药物刺激对细胞代谢的作用[49],Ma等[50]结合细胞代谢组学和UPLC-Q-TOF/MS的方法研究香附对三阴性乳腺癌的抗癌机制,发现其抑制肿瘤细胞的有氧分解、核苷酸代谢、氨基酸代谢、脂肪酸代谢和嘌呤代谢等,打破细胞三磷酸腺苷(adenosine triphosphate,ATP)产生和消耗的平衡,抑制肿瘤细胞的增殖,从而诱导细胞凋亡。多组学联合应用为中药药效作用机制提供更全面的分析,Lv等[51]基于LC-MS/MS的靶向代谢组学、转录组学和16S rRNA测序技术,从肠道菌群与代谢水平研究葛根芩连汤对大肠癌小鼠的治疗机制。结果发现,葛根芩连汤通过调节甘油磷脂和鞘脂代谢途径发挥对大肠癌细胞的抑制作用,并与PD-1抗体联合用药后能逐渐恢复T细胞功能状态,说明中药复方葛根岑连汤结合PD-1阻断免疫治疗可成为治疗直肠癌的新策略。
表1 代谢组学在中医证候研究中的应用
Table 1 Application of metabolomics in Chinese medicine syndrome research
证候疾病研究技术及方法代谢途径文献 气虚证冠心病1H-NMR、GC-MS能量代谢、糖代谢、丝氨酸代谢、缬氨酸代谢、2羟基丙酸代谢、氧化应激反应22-24 心肌梗死、心力衰竭GC-MS、UPLC-Q-TOF/MS氨基酸代谢、葡萄糖代谢、脂肪酸代谢、能量代谢、花生四烯酸代谢、胆固醇代谢25-26 血瘀证冠心病1H-NMR氨基酸代谢、脂质代谢、糖代谢、脂肪酸代谢、酮体合成27-28 心力衰竭UPLC-Q-TOF/MS氨基酸代谢、脂质代谢、能量代谢29 银屑病UPLC-Q-TOF/MS脂质代谢、氧化应激反应30 实证、虚证冠心病UPLC-Q-TOF/MS、UPLC-MS/MS脂质代谢、氨基酸代谢、糖代谢、不饱和脂肪酸代谢14 痰瘀证高血脂GC-MS亮氨酸代谢、糖代谢、脂质代谢、能量代谢、氧化应激反应31 湿热证慢性胃炎1H-NMR丙氨酸代谢、缬氨酸代谢、谷氨酸代谢、甘氨酸代谢、脂质代谢、核苷酸代谢、糖代谢15 非酒精性脂肪肝GC-MS谷氨酸代谢、亚油酸代谢、核苷酸代谢、蔗糖代谢、赖氨酸代谢、半乳糖代谢16 乙肝GC-MS天门冬氨酸代谢、谷氨酸代谢、酪氨酸代谢、能量代谢、脂肪酸代谢、核苷酸代谢17 关节炎UPLC-Q-TOF/MS、GC-MS脂质代谢、氨基酸代谢、葡萄糖代谢、抗坏血酸代谢、乙醛酸代谢、二羧酸代谢18 肝郁脾虚/UPLC-Q-TOF/MS氨基酸代谢、核苷酸代谢32 抑郁症GC-MS能量代谢、甘氨酸代谢、丝氨酸代谢、苏氨酸代谢、缬氨酸代谢、亮氨酸代谢、半乳糖代谢33 非酒精性脂肪肝1H-NMR脂肪酸代谢、能量代谢、氨基酸代谢、糖代谢34 脾阳虚/1H-NMR、UPLC-Q-TOF/MS、16S rRNA能量代谢、脂质代谢、糖代谢、鞘脂代谢、色氨酸代谢、丙氨酸代谢、天冬氨酸代谢、谷氨酸代谢、胆汁酸代谢、肠道菌群代谢19,35-36 肾阴虚/UPLC-MS/MS酪氨酸代谢、组氨酸代谢、吡啶代谢、甾体激素类代谢37 大肠癌GC-MS亚麻酸代谢、亚油酸代谢、半乳糖代谢、核苷酸代谢、糖酵解、三羧酸循环、精氨酸代谢、脯氨酸代谢、花生四烯酸代谢、胆汁酸合成38 糖尿病MALDI- MS苯丙氨酸代谢、酪氨酸代谢、牛磺酸代谢、胆汁酸代谢、甘氨酸代谢、丝氨酸代谢20 肾阳虚/UPLC-MS氨基酸代谢、能量代谢、甲胺代谢、胆汁酸代谢、尿素循环、短链脂肪酸代谢39 不育GC-MS丙氨酸代谢、天冬氨酸代谢、谷氨酸代谢、精氨酸代谢、脯氨酸代谢、亮氨酸代谢、谷胱甘肽代谢、鸟氨酸代谢、缬氨酸代谢40
代谢组学在中药药效及作用机制研究中的应用见表2。在中医药现代化研究中,利用代谢组学结合多元统计分析,对生物整体代谢轮廓进行描述,探讨中药治疗循环系统[42-48]、神经系统[56-59]、消化系统[60-68]、免疫系统[78-81]和恶性肿瘤[70-72]等疾病的作用机制,推动中药作用机制的深入研究。综合上述文献结果表明,基于复杂的代谢通路和网络关联,运用细胞代谢组学和16S rRNA测序技术,能阐述生物体内不同层次的生命过程,将代谢组学结合多组学整合数据,逐渐精确对生物标志物的筛选,提高中药药效研究成果的准确性。
表2 代谢组学在中药药效及作用机制研究中的应用
Table 2 Application of metabolomics in efficacy and mechanism research of TCM
疾病中药研究技术及方法代谢通路文献 循环系统疾病益心舒胶囊MALDI-MS、UPLC-Q-TOF/ MS糖酵解、嘌呤代谢、花生四烯酸代谢、胆固醇代谢、氨基酸代谢42 脑心通胶囊UPLC-Q-TOF/MS氨基酸代谢、能量代谢、脂质代谢43 天麻钩藤汤UPLC-Q-TOF/MS脂肪酸代谢、氨基酸代谢、不饱和脂肪酸合成44 四妙勇安汤HPLC-MS/MS丙酮酸代谢、牛磺酸代谢、次牛磺酸代谢45 保元汤1H-NMR、LC-MS短链脂肪酸代谢、中链脂肪酸代谢、初级胆汁酸代谢、次级胆汁酸代谢、氨基酸代谢46 四逆汤GC-MS、UPLC-Q-TOF/MS、转录组学乳酸代谢、丙氨酸代谢、琥珀酸代谢、糖代谢、花生四烯酸代谢47 人参RRLC-Q-TOF/MS能量代谢、氨基酸代谢、碳水化合物代谢、脂质代谢、嘧啶代谢、尿素循环、肠道菌群代谢48 丹参三七UPLC-MS/MS脂质代谢、氨基酸代谢52 丹红注射液HPLC-FLD甘氨酸代谢、丝氨酸代谢、苏氨酸代谢、组氨酸代谢53 黄连解毒汤1H-NMR、转录组学葡萄糖代谢、亮氨酸代谢、谷氨酸代谢、能量代谢54

续表2
4 代谢组学在中药毒性及安全性评价中的作用
中医药在疾病防治和养生保健领域有效运用的同时,中药毒性和安全性问题也一直备受关注,使中医药研究面临严峻挑战。由于中药成分和作用机制的复杂性,很难用传统的安全性评价方法来全面分析药物的毒性。迄今为止,中药毒性和安全性评价仍缺乏标准和客观依据,制约了中医药现代化的发展。代谢组学是一种有效、无创的中药毒性评价方法,是分析和阐明中药毒性作用机制的有力工具,有助于建立科学的现代化中医药临床用药安全评价体系。
马钱子具有一定的肾毒性,使其临床用药受到一定局限。Fan等[82]基于1H-NMR的代谢组学方法对马钱子给药后大鼠血清和尿液样本进行分析,并结合组织病理学验证马钱子的肾毒性,发现大鼠血清样本中葡萄糖、肌酸、乳酸和不饱和脂肪酸等代谢途径发生改变,尿液样本中的葡萄糖、肌酸、氧化三甲胺、琥珀酸、酮戊二酸、乳酸和柠檬酸等代谢途径发生改变,说明马钱子的肾毒性作用机制可能与葡萄糖代谢和肌酸代谢的紊乱相关。Wang等[83]建立空气流动辅助解吸(air flow assisted desorption)电喷雾电离质谱成像(AFAD-ESI-MS)技术的原位代谢组学方法,分析马兜铃酸给药后大鼠肾脏组织中代谢产物的变化。基于AFAD-ESI-MS的分析能够可视化已知和未知内源性代谢物的独特分布和变化,成功发现大鼠肾脏中与脂质代谢、胆碱代谢、组胺代谢、赖氨酸代谢等相关的38种代谢产物发生显著变化,进一步分析与药物毒性密切相关的原位生物标志物,揭示潜在的药物毒性分子作用机制。Ruan等[84]基于1H-NMR的代谢组学方法发现何首乌会引起小鼠氧化应激和线粒体功能障碍,导致小鼠能量代谢、氨基酸代谢和嘧啶代谢等途径发生紊乱,并引起炎症反应。代谢组学分析表明,何首乌引起的肝毒性具有明显的非线性,低剂量组毒性最大,中剂量组毒性较小,其肝脏损伤的减弱可能与何首乌的抗氧化能力有关。Yan等[85]对何首乌的肾毒性作用机制进行分析,随着给药时间的延长,何首乌的毒性逐渐影响胆汁酸、胆红素、酪氨酸等正常代谢,导致肾脏生化指标发生异常,肾毒性明显。补骨脂具有一定的肝毒性,Yu等[86]通过1H-NMR法检测补骨脂给药后大鼠血清样本中的内源性代谢物,发现补骨脂素导致缬氨酸、异亮氨酸、异丁酸、丙氨酸、丙酮酸、谷氨酰胺、柠檬酸、不饱和脂质、胆碱、肌酸、苯丙氨酸和对羟基苯甲酸盐浓度显著升高,乙醇和二甲基砜浓度显著降低。结果表明,长期服用补骨脂可引起代谢轮廓发生显著变化,丙氨酸代谢、谷氨酸代谢、尿素循环、甘氨酸代谢和丝氨酸代谢等发生紊乱。
代谢组学在中药毒性及安全性评价中的应用见表3。肝脏和肾脏分别作为药物代谢和排泄的主要场所,同时也是反映药物毒性的主要器官,中药引起的肝毒性和肾毒性问题不容小觑。众多学者对雷公藤[90-91]、朱砂[94]、甘遂[95]、雄黄[96]、苍耳子[104-105]等肝、肾毒性的作用机制进行研究,并结合生化指标检测毒性,从而达到对中药毒性的防治。此外,中药的生殖毒性、神经毒性、心脏毒性等也不能忽视。综合上述文献结果表明,代谢组学为探究中药毒性提供了新的机遇,然而筛选生物标志物的影响因素较多,如何筛选与中药毒性密切相关的代谢物成为代谢组学研究的热点。
5 代谢组学在中药质量控制中的应用
中药质量与其有效成分的组成、含量、产地和种属等因素直接相关,为中药质量控制带来巨大挑战。传统的分析技术很难对多成分的中药做出正确分析,难以达到中药质量控制的实际效果。代谢组学是基于药物整体性的检测技术,能对中药的品种栽培、产地加工、饮片炮制、分离纯化等各个生产加工环节进行质量管控,是临床用药安全性和中药质量控制的有利手段[109]。
中药品种鉴定是中药质量控制的关键。Li等[110]基于UPLC-Q-TOF/MS技术鉴定人参、西洋参和三七的花芽,发现32种潜在标记化合物,并鉴定6个主要标记物,分别为人参皂苷Rb3、Ra1、Rb2异构体、Ra1异构体、Rb1和Ra3异构体。研究结果表明,该方法是首个能系统比较人参、西洋参和三七的花芽之间代谢组差异的研究,可广泛应用于代谢信息相似的中药质量控制。Duan等[111]基于GC-MS代谢指纹图谱和扩增片段长度多态性(amplified fragment length polymorphism,AFLP)的遗传图谱成功对膜荚黄芪和蒙古黄芪进行鉴别,说明蒙古黄芪是膜荚黄芪的变种。通过多变量和单变量统计分析,发现2种黄芪的代谢指纹图谱存在明显差异,鉴定3个AFLP标记物和甘露糖、木糖、丙二酸等8个标志物来区分2种药材。Fan等[112]采用1H-NMR技术对3种黄连属植物进行分析和鉴定,发现黄连的代谢物因种而异,黄连中巴马汀、黄连碱、表小檗碱、氨基丁酸和脂肪酸的含量明显较高,药根碱的含量较低,而三角叶黄连和云南黄连中蔗糖和绿原酸的含量最高。该研究首次发现,绿原酸、蔗糖和脂肪酸是鉴别黄连属植物的主要成分,研究建立的黄连代谢指纹图谱也可用于黄连属植物的化学成分分析和药物真伪鉴别。生长年限是影响中药成分的重要因素,直接关系药材各成分的含量和药效。薛英等[113]基于UPLC-Q-TOF/MS与1H-NMR的代谢组学方法对生长1~3年的远志化学成分进行分析和比较,结果显示1年生长的远志与2、3年生长的远志化学成分相差较大。随着中药栽培时间的延长,其初级代谢物中蔗糖、果糖的含量逐渐降低,甘氨酸、棉籽糖的含量则增加;次级代谢物中皂苷类成分的含量增加,山酮、低聚糖酯的含量则减少。中药炮制是中药材采收之后处理加工的重要环节,所含化学成分在炮制过程必定发生改变,运用代谢组学分析方法即可对发生改变的成分进行综合性分析。Sun等[114]建立高覆盖、高灵敏度的MALDI-MS分析方法,对三七不同部位代谢产物的空间分布和蒸煮炮制过程进行可视化分析,首次在三七根茎中鉴定并获得三七皂苷、人参皂苷、氨基酸、丹参碱、葡萄糖酸、低分子有机酸等代谢产物的空间分布,并成功筛选出三七炮制过程中丹参碱、精氨酸、谷氨酰胺等一系列差异代谢物。这些代谢物的变化可能是三七炮制后发挥减毒增效的物质基础。另有学者对王不留行[115]、甘草[116]、女贞子[117]和何首乌[118]等生药材和不同炮制品进行分析,结果表明炮制前后中药所含成分发生显著变化,为中药材的质量控制和炮制提供重要依据。
表3 代谢组学在中药毒性及安全性评价中的应用
Table 3 Application of metabolomics in toxicity and safety evaluation of TCM
中药毒性研究技术及方法代谢通路文献 马钱子肾毒性1H-NMR糖酵解、糖异生、牛磺酸代谢、丙酮酸代谢、丙氨酸代谢、天冬氨酸代谢、谷氨酸代谢、三羧酸循环、肌酸代谢、不饱和脂肪酸代谢、氧化三甲胺代谢、琥珀酸代谢、酮戊二酸代谢82,87 马兜铃肾毒性AFADESI-MS、UPLC-Q-TOF/ HDMS肠道菌群代谢、脂肪酸代谢、嘌呤代谢、胆酸代谢、叶酸代谢、花生四烯酸代谢、脂质代谢、胆碱代谢、组胺代谢、氨基酸代谢、三磷酸腺苷代谢83,88 何首乌肾毒性UPLC-Q-TOF/MS苯丙氨酸代谢、酪氨酸代谢、胆汁酸代谢、胆红素代谢85 鱼腥草肝毒性1H-NMR、UPLC-Q-TOF/MS能量代谢、嘧啶代谢、能量代谢、胆汁酸代谢、氨基酸代谢84-85 肾毒性UPLC-Q-TOF/MS能量代谢、氨基酸代谢、脂质代谢89 雷公藤肾毒性蛋白质组学、UPLC- Q-TOF/MS嘌呤代谢、嘧啶代谢、甘油磷脂代谢、尿酸代谢90-91 生殖毒性GC-MS睾酮代谢、脂质代谢、脂肪酸代谢92 京大戟肾毒性HPLC-Q-TOF/MS嘌呤代谢、磷脂代谢、能量代谢、氨基酸代谢、鞘脂代谢93 朱砂肝毒性1H-NMR肌酸代谢、氨基酸代谢、氧化三甲胺代谢、丙酮酸代谢、葡萄糖代谢、胆碱代谢、乳酸代谢94 甘遂、雄黄肝毒性、肾毒性1H-NMR糖代谢、氨基酸代谢、乳酸代谢、氧化三甲胺代谢、肌酸代谢95 肝毒性1H-NMR脂肪酸代谢、肌酸代谢、氨基酸代谢、牛磺酸代谢、乳酸代谢、肠道菌群代谢96 栀子肝毒性UPLC-Q-TOF/MS氨基酸代谢、嘧啶代谢、初级胆汁酸代谢、泛酸代谢97 补骨脂肝毒性UPLC-Q-TOF/MS蛋白质组学1H-NMR谷胱甘肽代谢、嘌呤代谢、甘油磷脂代谢、能量代谢、丙酮酸代谢、丙氨酸代谢、谷氨酸代谢、甘氨酸代谢、丝氨酸代谢98-99 槟榔心脏毒性UPLC-Q-TOF-HDMS磷脂代谢、氨基酸代谢、脂肪酸代谢、亚油酸代谢、花生四烯酸代谢、甘油磷脂代谢、嘌呤代谢100 草乌心脏毒性、神经毒性UPLC-Q-TOF-HDMS糖代谢、乳糖代谢、色氨酸代谢、核苷酸代谢、牛磺酸代谢、次牛磺酸代谢101 番荔枝肝毒性、肾毒性UFLC-Q-TOF-HDMS能量代谢、谷氨酸代谢、酪氨酸代谢102 半夏心脏毒性UPLC-Q-TOF/MS酪氨酸代谢、尿嘧啶代谢、脯氨酸代谢、色氨酸代谢、赖氨酸代谢103 苍耳子肝毒性1H-NMR、UPLC-Q-TOF/MS脂肪酸代谢、谷氨酸代谢、缬氨酸代谢、色氨酸代谢、苯丙氨酸代谢、脂质代谢104-105 川乌肝毒性肾毒性UPLC-Q-TOF-HDMS戊糖代谢、谷氨酸代谢、丙氨酸代谢、天冬氨酸代谢106 蓖麻肾毒性、肺毒性1H-NMR能量代谢、氨基酸代谢、氧化应激反应107 大黄肝毒性1H-NMR、GC-MS、转录组学脂肪酸代谢、糖酵解、甘氨酸代谢、丝氨酸代谢、苏氨酸代谢108
综合上述文献结果表明,中药质量控制是发挥临床药效的基础,应用代谢组学对影响药材质量的关键因素进行分析,提供代谢产物的整体信息,确定与质量变化相关的质量标志物,进一步推动中药质量控制体系的规范化。此外,要加强对中药质量标志物进行更具体、更系统的研究,注重多学科的交叉融合,从而提高中药的疗效和安全性。
6 结语与展望
随着现代分析技术的不断发展,代谢组学在中医药领域取得众多创新性研究成果,代谢组学相关技术更是突飞猛进。在研究层面上,细胞代谢组学通过现代分析技术手段检测细胞中内源性小分子代谢物的差异,在细胞层面阐明其生理和病理变化的动态规律,该方法被众多学者应用于治疗乳腺癌[50,119]、直肠癌[51]、肺癌[70]等抗肿瘤中药的研究当中。脂质代谢组学通过对生物体中所含的脂质及其相互作用机制进行分析,识别对生物体内调控起到关键作用的脂类生物标志物,揭示脂质相关的代谢途径和作用机制。将代谢组学与脂质组学结合,成功为丹七通脉片[120]、丹参[121]、当归[122]、补血汤等中药药效的研究提供更加完整的代谢图谱,为揭示中医药作用机制提供新方法。在技术层面,代谢流分析技术广泛应用于生物医学的研究中,打破了传统代谢组学仅能提供静态代谢模式的局限,将代谢网络以动态变化的方式呈现,成为研究生物体代谢和肿瘤、糖尿病、心血管疾病等发病机制的重要工具[123]。质谱成像技术能高通量检测组织切片中的物质,可从生物组织原位发现与作用机制、中药质量、中药毒性相关的差异代谢物。基于质谱成像技术的空间代谢组学可对姜黄[124]、人参[125]、女贞子[126]等中药材的质量控制进行分析,对灯盏花素[127]、三七叶皂苷[128]、百里醌[129]、红景天苷[130]等中药单体的作用机制进行研究,同时也能对马兜铃酸[83]、补骨脂素[131]等中药单体的内源性代谢物进行分析,鉴定与药物毒性密切相关的原位生物标志物,揭示潜在的药物毒性分子作用机制。同时,多组学整合技术以系统生物学和多平台的分析方法为基础,涵盖代谢组学、基因组学、转录组学、蛋白质组学、影像组学等研究方法,能从多组学层面进行信息挖掘及代谢通路分析,系统解答生物学问题,具有多元化和系统性的独特优势。随着高通量代谢组学技术的发展,多组学整合技术被广泛应用于中医药和疾病研究中,鉴定与冠心病寒凝气滞证、气滞血瘀证[132]和参附方[133]、当归补血汤[134]等中药疗效相关的生物标志物,实现对相关代谢途径和作用机制的深入理解。
目前代谢组学在中医药领域的研究仍处于不断发展和完善阶段,存在数据可比性差、数据库资源不足、生物标志物特异性差等问题,距离全面系统性研究还有一定差距。因此,在中医药现代化研究中,代谢组学的应用需注重以下几方面:①建立超高灵敏度、重复性强、覆盖率高的高通量代谢组学定量分析方法;建立快速、高效的数据处理技术;完善并扩大代谢物数据库和代谢组学数据信息;②采用空间代谢组学技术建立原位检测方法,研究药物和代谢物空间分布、细胞异质性及其相互作用;③由于中医药的特殊性,模型的建立和实验设计既要与中医药的理念相一致,同时也要遵循现代科学规律;④将代谢组学与基因组学、转录组学、蛋白组学及药理学等进行整合,实现对中医药毒理、药理、有效性和质量控制等的研究。综上所述,要利用有限的科研资源,在中医基础理论的指导下充分发展代谢组学前沿技术,实现多组学数据的成功整合,不断拓展代谢物数据库,逐渐形成科学严谨的标准化中医药代谢组学研究体系,在“守正创新”中推动中医药现代化发展进程。
利益冲突 所有作者均声明不存在利益冲突
[1] Nicholson J K, Lindon J C, Holmes E. Metabonomics: Understanding the metabolic responses of living systems to pathophysiological stimuli via multivariate statistical analysis of biological NMR spectroscopic data [J]., 1999, 29(11): 1181-1189.
[2] Hocher B, Adamski J. Metabolomics for clinical use and research in chronic kidney disease [J]., 2017, 13(5): 269-284.
[3] Han Y, Sun H, Zhang A H,. Chinmedomics, a new strategy for evaluating the therapeutic efficacy of herbal medicines [J]., 2020, 216: 107680.
[4] Everett J R, Loo R L, Pullen F S. Pharmacometabonomics and personalized medicine [J]., 2013, 50(Pt 6): 523-545.
[5] 闫广利, 孙晖, 张爱华, 等. 基于中医方证代谢组学的中药质量标志物发现研究[J]. 中草药, 2018, 49(16): 3729-3734.
[6] 刘荣华, 俞洪华, 殷茜茜, 等. LC-MS在中药代谢组学中的应用进展 [J]. 亚太传统医药, 2021, 17(9): 183-191.
[7] Zou P P, Song Y L, Lei W,. Application of 1 H NMR-based metabolomics for discrimination of different parts and development of a new processing workflow for[J]., 2017, 7(6): 647-656.
[8] 徐天润, 刘心昱, 许国旺. 基于液相色谱-质谱联用技术的代谢组学分析方法研究进展 [J]. 分析测试学报, 2020, 39(1): 10-18.
[9] Schulz S, Becker M, Groseclose M R,. Advanced MALDI mass spectrometry imaging in pharmaceutical research and drug development [J]., 2019, 55: 51-59.
[10] Buchberger A R, DeLaney K, Johnson J,. Mass spectrometry imaging: A review of emerging advancements and future insights [J]., 2018, 90(1): 240-265.
[11] Chen Y, Ni J, Gao Y,. Integrated proteomics and metabolomics reveals the comprehensive characterization of antitumor mechanism underlying Shikonin on colon cancer patient-derived xenograft model [J]., 2020, 10(1): 14092.
[12] 马素娜, 关亚奇, 张淼, 等. 代谢组学技术在中医证候学研究中的应用优势 [J]. 时珍国医国药, 2019, 30(7): 1714-1716.
[13] Wang P C, Wang Q H, Yang B Y,. The progress of metabolomics study in traditional Chinese medicine research [J]., 2015, 43(7): 1281-1310.
[14] Guo N, Wang P L, Yang J Y,. Serum metabolomic analysis of coronary heart disease patients with stable angina pectoris subtyped by traditional Chinese medicine diagnostics reveals biomarkers relevant to personalized treatments [J]., 2021, 12: 664320.
[15] 王亮, 曹云, 李中峰, 等. 慢性萎缩性胃炎脾胃湿热证和脾胃虚寒证患者的血浆代谢组学特征 [J]. 中医杂志, 2019, 60(2): 131-136.
[16] 马欣, 顾宏图, 赵瑜, 等. 不同证候的非酒精性脂肪肝合并肝损伤患者的血清代谢组学分析 [J]. 中华中医药杂志, 2017, 32(3): 1246-1250.
[17] 刘畅, 苟小军, 黄迪, 等. 基于代谢组学方法的湿热证“异病同证”研究 [J]. 世界科学技术—中医药现代化, 2017, 19(3): 392-407.
[18] Gu Y, Lu C, Zha Q L,. Plasma metabonomics study of rheumatoid arthritis and its Chinese medicine subtypes by using liquid chromatography and gas chromatography coupled with mass spectrometry [J]., 2012, 8(5): 1535-1543.
[19] Lin Z, Ye W, Zu X P,. Integrative metabolic and microbial profiling on patients with Spleen-Yang-deficiency syndrome [J]., 2018, 8(1): 6619.
[20] Jiang N, Liu H F, Li S D,. An integrated metabonomic and proteomic study on Kidney-Yin Deficiency Syndrome patients with diabetes mellitus in China [J]., 2015, 36(6): 689-698.
[21] 常虹, 孟洪宇, 王宇, 等. 基于代谢组学的肝、肺纤维化“异病同治”科学内涵研究 [J]. 中草药, 2018, 49(21): 5116-5124.
[22] 史琦, 王伟, 李友林, 等. 基于代谢组学的冠心病患者气虚证识别模式 [J]. 中华中医药杂志, 2015, 30(2): 372-375.
[23] Gao K, Zhao H H, Gao J,. Mechanism of Chinese medicine herbs effects on chronic heart failure based on metabolic profiling [J]., 2017, 8: 864.
[24] Guo N, Chen Y G, Yang X F,. Urinary metabolomic profiling reveals difference between two traditional Chinese medicine subtypes of coronary heart disease [J]., 2021, 1179: 122808.
[25] Qiu Q, Li C, Wang Y,. Plasma metabonomics study on Chinese medicine syndrome evolution of heart failure rats caused by LAD ligation [J]., 2014, 14: 232.
[26] 刘阳, 赵营, 殷弘琳, 等. 基于非靶向代谢组学的心力衰竭气虚血瘀证患者血清代谢产物初筛 [J]. 时珍国医国药, 2020, 31(11): 2789-2792.
[27] 史琦, 王伟, 李友林, 等. 基于代谢组学的冠心病患者血瘀证识别模式研究 [J]. 中西医结合心脑血管病杂志, 2014, 12(5): 513-516.
[28] Zhao L L, Qiu X J, Wang W B,. NMR metabolomics and random forests models to identify potential plasma biomarkers of blood stasis syndrome with coronary heart disease patients [J]., 2019, 10: 1109.
[29] 王娟, 赵慧辉, 陈建新, 等. 慢性心力衰竭血瘀证患者血浆代谢物研究 [J]. 北京中医药大学学报, 2016, 39(2): 101-105.
[30] Li L, Yao D N, Lu Y,. Metabonomics study on serum characteristic metabolites of psoriasis vulgaris patients with blood-stasis syndrome [J]., 2020, 11: 558731.
[31] Dong B, Song J. Plasma metabolic biomarkers for syndrome of phlegm and blood stasis in hyperlipidemia and atherosclerosis [J]., 2012, 32 (4): 6.
[32] Zhang A H, Sun H, Han Y,. Exploratory urinary metabolic biomarkers and pathways using UPLC-Q-TOF-HDMS coupled with pattern recognition approach [J]., 2012, 137(18): 4200-4208.
[33] Liu L Y, Zhang H J, Luo L Y,. Blood and urinary metabolomic evidence validating traditional Chinese medicine diagnostic classification of major depressive disorder [J]., 2018, 13: 53.
[34] 李若瑜, 苗宇船, 李明磊, 等. 大鼠非酒精性脂肪肝肝郁脾虚证的尿液代谢组学研究 [J]. 中国中医基础医学杂志, 2019, 25(4): 467-470.
[35] 王颖, 王辉, 郑小伟. 基于核磁共振技术的脾气虚证、脾阳虚证血浆代谢组学研究 [J]. 中华中医药杂志, 2013, 28(8): 2270-2274.
[36] Lin Z, Ye W, Zu X P,. Integrative metabolic and microbial profiling on patients with Spleen-Yang-deficiency syndrome [J]., 2018, 8(1): 6619.
[37] Yu Y, Yang S, Mao L G,. Identification of potential metabolic biomarkers in Yin deficiency syndrome using LC-MS [J].(Hoboken), 2020, 303(8): 2121-2130.
[38] Tao F F, Lü P, Xu C B,. Metabolomics analysis for defining serum biochemical markers in colorectal cancer patients withdeficiency syndrome ordeficiency syndrome [J]., 2017, 2017: 7382752.
[39] Lu X M, Xiong Z L, Li J J,. Metabonomic study on ‘Kidney-Yang Deficiency syndrome’ and intervention effects of Rhizoma Drynariae extracts in rats using ultra performance liquid chromatography coupled with mass spectrometry [J]., 2011, 83(3): 700-708.
[40] Zheng P, Wang Y, Lu H M,. Plasma metabolomics analysis based on GC-MS in infertile males with kidney-Yang deficiency syndrome [J]., 2017, 2017: 6270195.
[41] 张爱华, 孙晖, 闫广利, 等. 中医方证代谢组学: 中医药研究的新策略 [J]. 中国中药杂志, 2015, 40(4): 569-576.
[42] Xu J, Li X Y, Zhang F B,. Integrated UPLC-Q/TOF-MS technique and MALDI-MS to study of the efficacy of YiXinshu capsules against heart failure in a rat model [J]., 2019, 10: 1474.
[43] Liu M T, Liu X, Wang H P,. Metabolomics study on the effects of Buchang Naoxintong capsules for treating cerebral ischemia in rats using UPLC-Q/TOF-MS [J]., 2016, 180: 1-11.
[44] Dong H Y, Zhang S Q, Du W X,. Pharmacodynamics and metabonomics study of Tianma Gouteng Decoction for treatment of spontaneously hypertensive rats with liver-Yang hyperactivity syndrome [J]., 2020, 253: 112661.
[45] Shi S, Liu Z Y, Xue Z Y,. A plasma metabonomics study on the therapeutic effects of the Si-Miao-yong-an Decoction in hyperlipidemic rats [J]., 2020, 256: 112780.
[46] Du Z Y, Wang J L, Lu Y Y,. The cardiac protection of Baoyuan Decoction via gut-heart axis metabolic pathway [J]., 2020, 79: 153322.
[47] Zhou Q, Meng P, Zhang Y,. The compatibility effects of sini decoction against doxorubicin-induced heart failure in rats revealed by mass spectrometry-based serum metabolite profiling and computational analysis [J]., 2020, 252: 112618.
[48] Wang N, Huang X, Li T,. Application of RRLC-QTOF-MS-based metabonomics and UPE for investigating Spleen-Qi deficiency syndrome withtreatment [J]., 2020, 256: 112822.
[49] 朱洪影, 易林, 汪子怡, 等. 单细胞代谢组学分析技术研究进展 [J]. 中国科学技术大学学报, 2018, 48(10): 842-852.
[50] Ma S S, Wang F K, Zhang C J,. Cell metabolomics to study the function mechanism ofL. on triple-negative breast cancer cells [J]., 2020, 20(1): 262.
[51] Lv J, Jia Y T, Li J,. Gegen Qinlian Decoction enhances the effect of PD-1 blockade in colorectal cancer with microsatellite stability by remodelling the gut microbiota and the tumour microenvironment [J]., 2019, 10(6): 415.
[52] Tao H J, Yang X Y, Wang W X,. Regulation of serum lipidomics and amino acid profiles of rats with acute myocardial ischemia byandherb pair [J]., 2020, 67: 153162.
[53] Guo Z L, Zhu Y, Su X T,. Danhong injection dose-dependently varies amino acid metabolites and metabolic pathways in the treatment of rats with cerebral ischemia [J]., 2015, 36(6): 748-757.
[54] Zhang Q, Fu X W, Wang J S,. Treatment effects of ischemic stroke by berberine, baicalin, and jasminoidin from Huang-Lian-Jie-du-decoction (HLJDD) explored by an integrated metabolomics approach [J]., 2017, 2017: 9848594.
[55] Zhao Y H, Nie S S, Yi M,. UPLC-QTOF/MS-based metabolomics analysis of plasma reveals an effect of Xue-Fu-Zhu-Yu capsules on blood-stasis syndrome in CHD rats [J]., 2019, 241: 111908.
[56] 张明勇. 丹参防治阿尔茨海默病的细胞代谢组学和跨血脑屏障转运机制研究 [D]. 上海: 中国人民解放军海军军医大学, 2019.
[57] Zhang Y, Yao Y, Shi X L,. Combination of cell metabolomics and pharmacology: A novel strategy to investigate the neuroprotective effect of Zhi-zi-Chi Decoction [J]., 2019, 236: 302-315.
[58] Gao X X, Cui J, Zheng X Y,. An investigation of the antidepressant action of Xiaoyaosan in rats using ultra performance liquid chromatography-mass spectrometry combined with metabonomics [J]., 2013, 27(7): 1074-1085.
[59] Gong W X, Zhu S W, Chen C C,. The anti-depression effect ofis related to the pharmacological activity of modulating the hematological anomalies [J]., 2019, 10: 192.
[60] Fang H, Zhang A H, Yu J B,. Insight into the metabolic mechanism of scoparone on biomarkers for inhibiting Yanghuang syndrome [J]., 2016, 6: 37519.
[61] Fang H, Zhang A H, Zhou X H,. High-throughput metabolomics reveals the perturbed metabolic pathways and biomarkers of Yang Huang syndrome as potential targets for evaluating the therapeutic effects and mechanism of geniposide [J]., 2020, 14(5): 651-663.
[62] Su G Y, Wang H F, Gao Y X,. ¹H-NMR-based metabonomics of the protective effect ofand berberine on cinnabar-induced hepatotoxicity and nephrotoxicity in rats [J]., 2017, 22(11): 1855.
[63] Wang R, Xiong A Z, Teng Z Q,.andattenuate CCl4-induced acute liver injury: An ultra-performance liquid chromatography-mass spectrometry (UPLC-MS) based metabolomic approach for the pharmacodynamic study of traditional Chinese medicines (TCMs) [J]., 2012, 13(11): 14634-14647.
[64] Wu J S, Li Y F, Li Y Y,. Huangqi Decoction alleviates alpha-naphthylisothiocyanate induced intrahepatic cholestasis by reversing disordered bile acid and glutathione homeostasis in mice [J]., 2017, 8: 938.
[65] Li C F, Li Z Y, Wu H W,. Therapeutic effect ofleaves on constipation mice based on pharmacodynamics and serum metabonomics [J]., 2022, 282: 114644.
[66] Cui D N, Wang X, Chen J Q,. Quantitative evaluation of the compatibility effects of Huangqin Decoction on the treatment of irinotecan-induced gastrointestinal toxicity using untargeted metabolomics [J]., 2017, 8: 211.
[67] Zhou X H, Zhang A H, Wang L,. Novel chinmedomics strategy for discovering effective constituents from Shenqiwan acting on Shenyangxu syndrome [J]., 2016, 14(8): 561-581.
[68] Wang Y L, Fan S N, Yang M,. Evaluation of the mechanism of Danggui-Shaoyao-San in regulating the metabolome of nephrotic syndrome based on urinary metabonomics and bioinformatics approaches [J]., 2020, 261: 113020.
[69] Pang H Q, Yue S J, Tang Y P,. Integrated metabolomics and network pharmacology approach to explain possible action mechanisms of Xin-Sheng-Hua granule for treating[J]., 2018, 9: 165.
[70] Zhou J L, Zheng J Y, Cheng X Q,. Chemical markers' knockout coupled with UHPLC-HRMS-based metabolomics reveals anti-cancer integration effects of the curcuminoids of turmeric (L.) on lung cancer cell line [J]., 2019, 175: 112738.
[71] Sun H, Zhang A H, Liu S B,. Cell metabolomics identify regulatory pathways and targets of magnoline against prostate cancer [J]., 2018, 1102/1103: 143-151.
[72] Gao L, Wang K X, Zhou Y Z,. Uncovering the anticancer mechanism of Compound Kushen Injection against HCC by integrating quantitative analysis, network analysis and experimental validation [J]., 2018, 8(1): 624.
[73] Gao K, Yang R, Zhang J,. Effects of Qijian mixture on type 2 diabetes assessed by metabonomics, gut microbiota and network pharmacology [J]., 2018, 130: 93-109.
[74] Zhao L C, Gao H C, Zhao Y X,. Metabonomic analysis of the therapeutic effect of Zhibai Dihuang Pill in treatment of streptozotocin-induced diabetic nephropathy [J]., 2012, 142(3): 647-656.
[75] Wang Y M, Guo X J, Xie J B,. A GC-MS based metabonomics study of rheumatoid arthritis and the interventional effects of the simiaowan in rats [J]., 2015, 20(12): 21364-21372.
[76] Wang N N, Zhao X N, Huai J X,. Arachidonic acid metabonomics study for understanding therapeutic mechanism of Huo Luo Xiao Ling Dan on rat model of rheumatoid arthritis [J]., 2018, 217: 205-211.
[77] Zuo J, Wang X, Liu Y,. Integrating network pharmacology and metabolomics study on anti-rheumatic mechanisms and antagonistic effects against methotrexate-induced toxicity of Qing-Luo-Yin [J]., 2018, 9: 1472.
[78] Li Y B, Li Y M, Lu W L,. Integrated network pharmacology and metabolomics analysis of the therapeutic effects of Zi Dian Fang on immune thrombocytopenic[J]., 2018, 9: 597.
[79] Gao D, Niu M, Wei S Z,. Identification of a pharmacological biomarker for the bioassay-based quality control of a thirteen-component TCM formula (Lianhua Qingwen) used in treating influenza A virus (H1N1) infection [J]., 2020, 11: 746.
[80] Zhao S Y, Liu Z L, Wang M L,. Anti-inflammatory effects of Zhishi and Zhiqiao revealed by network pharmacology integrated with molecular mechanism and metabolomics studies [J]., 2018, 50: 61-72.
[81] Ma Y, Bao Y R, Wang S,. Anti-inflammation effects and potential mechanism of saikosaponins by regulating nicotinate and nicotinamide metabolism and arachidonic acid metabolism [J]., 2016, 39(4): 1453-1461.
[82] Fan Y F, Liu S F, Chen X D,. Toxicological effects of Nux Vomica in rats urine and serum by means of clinical chemistry, histopathology and1H-NMR-based metabonomics approach [J]., 2018, 210: 242-253.
[83] Wang Z H, He B S, Liu Y Q,.metabolomics in nephrotoxicity of aristolochic acids based on air flow-assisted desorption electrospray ionization mass spectrometry imaging [J]., 2020, 10(6): 1083-1093.
[84] Ruan L Y, Li M H, Xing Y X,. Hepatotoxicity and hepatoprotection ofThund. as two sides of the same biological coin [J]., 2019, 230: 81-94.
[85] Yan Y, Shi N, Han X Y,. UPLC/MS/MS-based metabolomics study of the hepatotoxicity and nephrotoxicity in rats induced byThunb. [J]., 2020, 5(18): 10489-10500.
[86] Yu Y L, Wang P L, Yu R L,. Long-term exposure of psoralen and isopsoralen induced hepatotoxicity and serum metabolites profiles changes in female rats [J]., 2019, 9(11): 263.
[87] Gu L Q, Hou P Y, Zhang R W,. An analytical strategy to investigatenephrotoxicity based on simultaneous HILIC-ESI-MS/MS detection ofalkaloids, tyrosine and tyramine in HEK 293t cell lysates [J]., 2016, 1033/1034: 157-165.
[88] Zhao Y Y, Tang D D, Chen H,. Urinary metabolomics and biomarkers of aristolochic acid nephrotoxicity by UPLC-QTOF/HDMS [J]., 2015, 7(6): 685-700.
[89] Chen H J, Sha X X, Luo Y Y,. Acute and subacute toxicity evaluation ofethanol extract and plasma metabolic profiling analysis in both male and female rats [J]., 2021, 41(12): 2068-2082.
[90] Xie L J, Zhao Y W, Duan J Y,. Integrated proteomics and metabolomics reveal the mechanism of nephrotoxicity induced by triptolide [J]., 2020, 33(7): 1897-1906.
[91] 常立娟, 李佐静, 李清, 等. 雷公藤致大鼠肾毒性血清代谢组学分析 [J]. 中国实验方剂学杂志, 2016, 22(24): 89-94.
[92] Ma B, Qi H H, Li J,. Triptolide disrupts fatty acids and peroxisome proliferator-activated receptor (PPAR) levels in male mice testes followed by testicular injury: A GC-MS based metabolomics study [J]., 2015, 336: 84-95.
[93] Liu Z Z, Zeng Y, Hou P Y. Metabolomic evaluation ofinduced nephrotoxicity in rats [J]., 2018, 56(1): 145-153.
[94] Wang H F, Bai J, Chen G,. A metabolic profiling analysis of the acute hepatotoxicity and nephrotoxicity of Zhusha Anshen Wan compared with cinnabar in rats using1H-NMR spectroscopy [J]., 2013, 146(2): 572-580.
[95] Tang B W, Ding J J, Wu F H,.1H NMR-based metabonomics study of the urinary biochemical changes in Kansui treated rat [J]., 2012, 141(1): 134-142.
[96] Huo T G, Fang Y, Zhao L S,.1H-NMR-based metabonomic study of sub-chronic hepatotoxicity induced by realgar [J]., 2016, 192: 1-9.
[97] Luo Y S, Gao F Y, Chang R R,. Metabolomics based comprehensive investigation ofinduced hepatotoxicity [J]., 2021, 153: 112250.
[98] Duan J Y, Dong W Y, Xie L J,. Integrative proteomics-metabolomics strategy reveals the mechanism of hepatotoxicity induced by[J]., 2020, 221: 103767.
[99] 胡超, 汤响林, 李杰, 等. 基于UPLC/QTOF-MS技术的补骨脂水提物对大鼠血浆代谢组学研究 [J]. 中药药理与临床, 2016, 32(1): 22-26.
[100] Lin Q H, Wang C G, Jia Z,. UPLC-HDMS-based on serum metabolomics reveals the toxicity of arecae semen [J]., 2020, 247: 112223.
[101] Yan Y, Zhang A H, Dong H,. Toxicity and detoxification effects of herbal Caowu via ultra performance liquid chromatography/mass spectrometry metabolomics analyzed using pattern recognition method [J]., 2017, 13(52): 683-692.
[102] Miao Y J, Shi Y Y, Li F Q,. Metabolomics study on the toxicity ofby ultraperformance liquid-chromatography high-definition mass spectrometry coupled with pattern recognition approach and metabolic pathways analysis [J]., 2016, 184: 187-195.
[103] Su T, Tan Y, Tsui M S,. Metabolomics reveals the mechanisms for the cardiotoxicity ofand the toxicity-reducing effect of processing [J]., 2016, 6: 34692.
[104] Xue L M, Zhang Q Y, Han P,. Hepatotoxic constituents and toxicological mechanism ofL. fruits [J]., 2014, 152(2): 272-282.
[105] Lu F, Cao M, Wu B,. Urinary metabonomics study on toxicity biomarker discovery in rats treated with[J]., 2013, 149(1): 311-320.
[106] Dong H, Yan G L, Han Y,. UPLC-Q-TOF/MS-based metabolomic studies on the toxicity mechanisms of traditional Chinese medicine Chuanwu and the detoxification mechanisms of Gancao, Baishao, and Ganjiang [J]., 2015, 13(9): 687-698.
[107] Guo P P, Wang J S, Dong G,. NMR-based metabolomics approach to study the chronic toxicity of crude ricin frombean kernels on rats [J]., 2014, 10(9): 2426-2440.
[108] Man S L, Qiu P Y, Li J,. Global metabolic profiling for the study ofsaponins-induced hepatotoxicity in rats [J]., 2017, 32(1): 99-108.
[109] Liu S, Liang Y Z, Liu H T. Chemometrics applied to quality control and metabolomics for traditional Chinese medicines [J]., 2016, 1015/1016: 82-91.
[110] Li J, Zuo T T, Zhang C X,. Simultaneous profiling and holistic comparison of the metabolomes among the flower buds of,, andby UHPLC/IM-QTOF-HDMS E-based metabolomics analysis [J]., 2019, 24(11): 2188.
[111] Duan L X, Chen T L, Li M,. Use of the metabolomics approach to characterize Chinese medicinal material Huangqi [J]., 2012, 5(2): 376-386.
[112] Fan G, Tao L H, Yue Q H,. Metabolic discrimination of rhizoma coptidis from different species using1H-NMR spectroscopy and principal component analysis [J]., 2012, 78(6): 641-648.
[113] 薛英, 李晓伟, 李震宇, 等. 采用UPLC/Q-TOF MS与NMR代谢组学技术研究生长年限对远志药材质量的影响 [J]. 药学学报, 2015, 50(3): 340-347.
[114] Sun C L, Ma S S, Li L L,. Visualizing the distributions and spatiotemporal changes of metabolites inby MALDI mass spectrometry imaging [J]., 2021, 45(6): 726-733.
[115] 周国洪, 赵珍东, 汪小根, 等. 基于超高效液相-轨道离子肼质谱技术的王不留行炮制前后代谢组学研究 [J]. 海峡药学, 2019, 31(11): 44-48.
[116] 文旺, 李莉, 李德坤, 等. 基于液质联用技术和植物代谢组学的甘草炮制品化学成分差异性分析 [J]. 中国实验方剂学杂志, 2020, 26(17): 104-110.
[117] Li M R, Wang X Y, Han L F,. Integration of multicomponent characterization, untargeted metabolomics and mass spectrometry imaging to unveil the holistic chemical transformations and key markers associated with wine steaming of[J]., 2020, 1624: 461228.
[118] 王健, 孙瑜, 陈莉莉, 等. 基于1H-NMR代谢组学技术评价何首乌炮制品中差异代谢物的研究 [J]. 现代药物与临床, 2020, 35(8): 1537-1543.
[119] Ma C Y, Li Y, Wu H Q,. Metabolomics analysis of the potential anticancer mechanism of annonaceous acetogenins on a multidrug resistant mammary adenocarcinoma cell [J]., 2018, 553: 1-6.
[120] Li Z W, Hou J J, Deng Y P,. Exploring the protective effects of Danqi Tongmai Tablet on acute myocardial ischemia rats by comprehensive metabolomics profiling [J]., 2020, 74: 152918.
[121] Jin Y D, Xie Z R, Li S S,. Combined lipidomics and network pharmacology study of protective effects ofagainst blood stasis syndrome [J]., 2021, 2021: 5526778.
[122] Liu Y T, Li X Q, Li A P,. UHPLC Q-Exactive MS-based spleen metabolomics and lipidomics to explore the effect mechanisms of Danggui Buxue Decoction inmice [J]., 2020, 185: 113234.
[123] 李文杰, 胡泽平. 代谢流分析在肿瘤代谢研究中的应用进展 [J]. 中国医学前沿杂志: 电子版, 2019, 11(2): 18-22, 6.
[124] Shimma S, Sagawa T. Microscopy and mass spectrometry imaging reveals the distributions of curcumin species in dried turmeric root [J]., 2019, 67(34): 9652-9657.
[125] Lee J W, Ji S H, Lee Y S,. Mass spectrometry based profiling and imaging of various ginsenosides fromroots at different ages [J]., 2017, 18(6): 1114.
[126] Li M R, Wang X Y, Han L F,. Integration of multicomponent characterization, untargeted metabolomics and mass spectrometry imaging to unveil the holistic chemical transformations and key markers associated with wine steaming of[J]., 2020, 1624: 461228.
[127] Wang T, Lee H K, Yue G G L,. A novel binary matrix consisting of graphene oxide and caffeic acid for the analysis of scutellarin and its metabolites in mouse kidney by MALDI imaging [J]., 2021, 146(1): 289-295.
[128] Zhu T, Wang L, Tian F,. Anti-ischemia/reperfusion injury effects of notoginsenoside R1on small molecule metabolism in rat brain after ischemic stroke as visualized by MALDI-MS imaging [J]., 2020, 129: 110470.
[129] Tian F, Liu R Z, Fan C X,. Effects of thymoquinone on small-molecule metabolites in a rat model of cerebral ischemia reperfusion injury assessed using MALDI-MSI [J]., 2020, 10(1): 27.
[130] Meng X Y, Fu W Q, Huo M L,.label-free visualization of tissue distributions of salidroside in multiple mouse organs by MALDI-MS imaging [J]., 2020, 453: 116347.
[131] Shi G Z, Song D, Li P Y,. Screening of hepatotoxic compounds inL., a traditional Chinese herbal and dietary supplement, using high-resolution mass spectrometry and high-content imaging [J]., 2021, 35(9): e5140.
[132] Wu G S, Zhao J, Zhao J,. Exploring biological basis of syndrome differentiation in coronary heart disease patients with two distinct Syndromes by integrated multi-omics and network pharmacology strategy [J]., 2021, 16(1): 109.
[133] Huang Y T, Zhang K, Jiang M M,. Regulation of energy metabolism by combination therapy attenuates cardiac metabolic remodeling in heart failure [J]., 2020, 16(16): 3133-3148.
[134] Kwan K K L, Wong T Y, Yu A X D,. Integrated omics reveals the orchestrating role of calycosin in Danggui Buxue Tang, a herbal formula containingand, in inducing osteoblastic differentiation and proliferation [J]., 2021, 12: 670947.
Application and prospect of metabolomics in traditional Chinese medicine research
CUI Fu-yan1, 2, YANG Jia-ying1, 2, WANG Zhi-gang1, LI Xian-yu2, CHEN Peng2, YANG Hong-jun2, 3, GUO Na2
1. College of Pharmacy, Heilongjiang University of Chinese Medicine, Harbin 150000, China 2. Medical Experimental Center, China Academy of Chinese Medical Sciences, Beijing 100700, China 3. Institute of Chinese Materia Medica, China Academy of Chinese Medical Sciences, Beijing 100700, China
As an important part of systems biology, metabolomics is consistent with the “holistic view” of the basic theories of traditional Chinese medicine (TCM). Metabolomics detects changes in metabolites in biological systems through modern analytical techniques, more accurately and directly reflects the terminal and phenotypic information of biological systems, and reveals the mechanism of TCM in the treatment of the complex diseases. It is an important step in the modernization of TCM to combine TCM research with metabolomics, which lays an important foundation for exploring new ideas and methods in the research of TCM. This study aims to summarize the relevant research results in the past ten years, summarize the application and research progress of metabolomics in Chinese medicine syndromes, mechanism, safety evaluation and quality control of TCM, analyze and summarize research methods of metabolomics in the field of TCM, and put forward the thinking and prospect of metabolomics in TCM research.
metabolomics; traditional Chinese medicine; application; syndromes; mechanism; safety evaluation; quality control
R285
A
0253 - 2670(2022)14 - 4512 - 15
10.7501/j.issn.0253-2670.2022.14.030
2022-03-11
国家重点研发计划项目(2019YFC1708900);中央级公益性科研院所基本科研业务费专项资金资助(JBGS2021002);中国中医科学院科技创新工程项目资助(CI2021A05031)
崔芙岩,女,硕士研究生,研究方向为中药分析。E-mail: 1437015148@qq.com
杨洪军,研究员,博士生导师,主要从事中药新药设计理论与应用、中药复杂作用机制解析新技术新方法及应用。Tel: (010)64089839 E-mail: hongjun0420@vip.sina.com
郭 娜,研究员,博士生导师,主要从事基于质谱技术的中医药代谢组学分析方法研究。Tel: (010)64089536 E-mail: guona5246@126.com
[责任编辑 潘明佳]
