肠道菌群介导的酸枣仁总黄酮体内代谢轮廓研究
2022-07-22段慧竹刘佳星杜晨晖
段慧竹,刘佳星,闫 艳*,杜晨晖*
肠道菌群介导的酸枣仁总黄酮体内代谢轮廓研究
段慧竹1,刘佳星2,闫 艳2*,杜晨晖1*
1. 山西中医药大学中药与食品工程学院,山西 太原 030619 2. 山西大学 中医药现代研究中心,山西 太原 030006
比较正常和抗生素大鼠对酸枣仁总黄酮体内代谢转化反应的差异,及2组大鼠血浆中斯皮诺素的药动学变化特征。采用ig联合抗生素建立抗生素干预大鼠模型;正常与抗生素大鼠ig酸枣仁总黄酮(120 mg/kg),收集粪便及不同时间点的血浆样品。采用UHPLC-Q-TOF-MS/MS技术分析粪便中原型成分及代谢产物;以黄芩苷为内标,建立UPLC-MS/MS测定大鼠血浆中斯皮诺素含量的方法,并应用于斯皮诺素在正常与抗生素大鼠体内药动学比较研究。正常及抗生素大鼠粪便中共鉴定了24个化合物,包括9个原型成分(维采宁II、斯皮诺素、牡荆素、异牡荆素、当药黄素、异当药黄素、山柰酚-3--芸香糖苷、6′′′--香豆酰斯皮诺素、6′′′-阿魏酰斯皮诺素)和15个代谢产物。正常大鼠中主要发生氢化、糖基化等4种代谢反应,抗生素干预后发生了脱甲氧基、去羟基化等6种代谢反应。与正常组相比,抗生素组大鼠血浆中斯皮诺素的血药浓度显著降低(<0.05),达峰时间和半衰期显著升高(<0.05)。抗生素干预会导致酸枣仁黄酮类成分在大鼠体内代谢反应紊乱,并影响斯皮诺素的药动学行为。
酸枣仁总黄酮;抗生素大鼠;肠道菌群;体内代谢;药动学;维采宁II;斯皮诺素;牡荆素;异牡荆素;当药黄素;异当药黄素;山柰酚-3--芸香糖苷;6′′′--香豆酰斯皮诺素;6′′′-阿魏酰斯皮诺素
酸枣仁为鼠李科植物酸枣Mill. var.(Bunge) Hu ex H. F. Chou的干燥成熟种子,具有养心安神,敛汗、生津之功效[1]。酸枣仁富含皂苷、黄酮、生物碱和脂肪酸等活性成分[2]。黄酮类成分在酸枣仁中含量较高(质量分数可达3.94%),且具有镇静催眠、抗焦虑、抗抑郁、抗氧化和改善学习记忆等多种药理活性[3-7]。迄今,已从酸枣仁中分离鉴定了34种黄酮类成分,多为以芫花素为母核的C-6/8位碳糖苷黄酮,尚含有少量的C-3/7位的氧糖苷黄酮化合物[8]。
酸枣仁黄酮药理活性广泛,但体内代谢过程研究表明其入血吸收困难,生物利用度低[9]。Zhang等[10]研究表明正常大鼠ig斯皮诺素20 mg/kg后,其绝对生物利用度仅为2.20%。正常大鼠分别iv斯皮诺素和6′′′-阿魏酰斯皮诺素单体(5 mg/kg)后,两者表现出相同的药动学趋势,均在0.75 h快速减少。此外,6′′′-阿魏酰斯皮诺素最大血药浓度(max)明显低于斯皮诺素,与ig酸枣仁黄酮提取物的结果一致[11]。本课题组前期研究也表明正常大鼠ig酸枣仁水提物(生药量30 g/kg)后,斯皮诺素和6′′′-阿魏酰斯皮诺素的max分别为(45.22±7.94)、(15.83±1.54)ng/mL[12]。由此可见,酸枣仁黄酮研究中存在药动学与药效学相矛盾的现象,对阐明酸枣仁黄酮类成分的药效物质基础和作用机制提出了挑战。
肠道菌群作为“人体肝脏以外的第2个代谢性器官”,富含大量与物质代谢相关的酶系[13],因此对药物的代谢转化及吸收有重要影响。大部分酸枣仁黄酮具有C-6位碳糖苷的母核结构,同时又具有酚羟基。正常肠道菌群对黄酮类成分的代谢反应,一般包括糖基化反应、去甲基化反应、还原反应以及环裂变反应等[14-16]。本课题组前期研究酸枣仁水提物的体外肠道菌群代谢转化,发现以斯皮诺素为母核的-糖黄酮苷和以山柰酚为母核的-糖黄酮苷,均可被肠道菌群代谢转化为次级黄酮苷[17]。Bao等[18]通过SD大鼠ig酸枣仁总黄酮180 mg/kg(相当于原生药30 g/kg),发现粪便中的代谢物在12 h最为丰富,且斯皮诺素和当药黄素在粪便中含量较高,表明其过程可能涉及了肠道菌群代谢。闫艳等[19]建立UHPLC-Q-Exactive轨道离子阱高分辨质谱分析酸枣仁水提物体内、体外成分,通过体内-体外物质组关联,在正常大鼠ig酸枣仁水提物后的尿液中共鉴定和推断出8个黄酮原型及4个代谢产物,并据此推断黄酮类化合物体内代谢反应主要为肠道水解和环裂解反应。因此,深入探讨肠道菌群对酸枣仁黄酮类成分的代谢特征及药动学的影响,对阐明酸枣仁药效物质基础和作用机制具有重要的科学意义。
本研究首先采用ig三联复合抗生素建立抗生素干预大鼠模型,利用UHPLC-Q-TOF-MS/MS技术快速分析ig酸枣仁总黄酮后在正常与抗生素大鼠粪便中的原型及代谢产物。其次,建立采用UPLC-MS/MS同时测定大鼠血浆中斯皮诺素含量的方法,并应用于正常与抗生素大鼠ig酸枣仁总黄酮后的斯皮诺素药动学比较研究。以期从肠道菌群代谢和药动学的角度,揭示肠道菌群对酸枣仁黄酮类成分吸收和代谢的影响,为酸枣仁总黄酮的药效物质基础及作用机制研究提供科学依据。
1 材料
1.1 动物
SPF级雄性SD大鼠16只,6~8周龄,体质量180~200 g,购自北京维通利华实验动物技术有限公司,动物许可证号SCXK(京)2016-0006。动物实验符合动物伦理委员会的标准(批准号2021DW172)。动物饲养在室温(24±2)℃、相对湿度55%~65%、12 h明暗循环的环境。动物饲养用水均经过高压灭菌,饲料及垫料均为无菌型。
1.2 仪器
5600 Q-TOF型高分辨质谱仪(美国AB Sciex公司);Triple Quad 4500型三重四极杆串联质谱仪,电喷雾电离源(美国AB Sciex公司);LC-20AD型超高效液相色谱仪(日本Shimadzu公司);CPA225D型十万分之一分析天平(德国Sartorius公司);Milli-Q超纯水系统(美国Millipore公司)。
1.3 药品与试剂
头孢羟氨苄、土霉素、红霉素均购自上海索莱宝试剂有限公司;无菌饲料、无菌垫料购自北京维通利华实验动物技术有限公司;质谱纯甲醇、乙腈、甲酸购自美国Thermo Fisher Scientific公司;其他试剂均为分析纯;对照品斯皮诺素(批号20160314)、6′′′-阿魏酰斯皮诺素(批号20160313)和内标黄芩苷(批号20130915)均购自宝鸡市辰光生物科技有限公司;维采宁II(批号3922)、异牡荆素(批号7873)、当药黄素(批号4039)、牡荆素(批号3593)和山柰酚-3--芸香糖苷(批号6510)均购自上海诗丹德生物技术有限公司,经HPLC归一化法测定以上对照品的质量分数均大于98%。酸枣仁总黄酮为实验室自制,紫外分光光度发测定酸枣仁总黄酮质量分数为58%,得率为0.4%,UPLC-MS/MS测定酸枣仁总黄酮中斯皮诺素的质量分数为21.4%[20]。
2 方法
2.1 粪便代谢产物定性分析
2.1.1 色谱条件 Acquity UPLC®HSS T3色谱柱(150 mm×2.1 mm,1.8 µm),流动相为0.1%甲酸水溶液(A)-乙腈(B),梯度洗脱:0~8 min,5%~17% B;8~10 min,17% B;10~11 min,17%~18% B;11~12 min,18%~20% B;12~17 min,20%~23% B;17~22 min,23%~33% B;22~25 min,33%~100% B。体积流量为0.3 mL/min;柱温为40 ℃;进样量为2 µL。
2.1.2 质谱条件 5600 Q-TOF离子源为电喷雾离子源(ESI);正离子模式扫描;雾化气(GS1,N2)压力为55 psi(1 psi=6.895 kPa);辅助气(GS2,N2)压力为55 psi;源喷射电压(IS)为5500 V;雾化温度为450 ℃;气帘气(curtain gas,N2)压力为30 psi。
2.1.3 动物分组、给药及样品收集 SD大鼠6只,适应性饲养1周后,随机分为正常组(=3)和抗生素组(=3),抗生素组大鼠以无菌水、无菌饲料喂养,并使用无菌垫料。抗生素组每天ig联合抗生素[头孢羟氨苄(100 mg/kg)、土霉素(300 mg/kg)和红霉素(300 mg/kg)],2次/d,连续3 d。抗生素组大鼠代谢2 d后ig酸枣仁总黄酮(120 mg/kg),连续给药2 d;正常组ig等剂量的酸枣仁总黄酮,连续给药2 d;于末次给药前,各组大鼠禁食12 h,给药后将大鼠置于代谢笼中,于置有冰盒的瓶子中收集0~24 h粪便,期间自由饮水。
2.1.4 样本的预处理 粪便样品50 ℃烘干,称取2组粪便样品各0.75 g,分别加入15 mL甲醇,超声提取30 min,4 ℃、3500 r/min离心10 min,取上清液2 mL,上样于活化后的SPE C18固相萃取小柱。依次用6 mL蒸馏水和6 mL甲醇洗脱,收集甲醇洗脱液,N2吹干,以800 μL初始流动相复溶,4 ℃、13 000 r/min离心10 min,取上清分析。
2.1.5 16S rRNA测序 将收集的正常组与抗生素组大鼠粪便置于冻存管中,交于上海派森诺生物科技有限公司,进行16S rRNA基因V3~4区的测序分析。
2.2 血浆药动学研究
2.2.1 色谱条件 Acquity UPLC®HSS T3色谱柱(150 mm×2.1 mm,1.8 µm),流动相为0.1%甲酸水溶液(A)-乙腈(B),梯度洗脱:0~8 min,5%~17% B;8~10 min,17% B;10~11 min,17%~18% B;11~12 min,18%~20% B;12~14 min,20%~33% B;14~17 min,33%~100% B。体积流量为0.3 mL/min;柱温为40 ℃;进样量为2 µL。
2.2.2 质谱条件 AB Triple Quad 4500离子源为电喷雾离子源(ESI);扫描模式为MRM负离子扫描;源喷射电压(IS)为−4500 V;雾化温度为550 ℃;气帘气(curtain gas,N2)压力为40 psi;雾化气(GS1,N2)压力为50 psi;辅助气(GS2,N2)压力为50 psi。斯皮诺素及内标成分通过针泵进样优化质谱参数,详见表1。
表1 斯皮诺素和黄芩苷的质谱参数信息
Table 1 Mass spectrometry parameters of spinosin and baicalin
成分tR/min碎片离子(m/z)二级碎片离子(m/z)去簇电压/V碰撞电压/eV 斯皮诺素11.31607.0427.0−160−45 黄芩苷12.74445.0269.3−90−36
2.2.3 储备液的制备 取对照品适量,精密称定,加甲醇分别制备成含斯皮诺素1.02 mg/mL和黄芩苷0.96 mg/mL的单一对照品溶液。
2.2.4 工作溶液的制备 精密吸取斯皮诺素对照品储备液适量加70%甲醇溶液配制成质量浓度分别为12.15、244.35、266.45、855.15、977.25、1 221.60 ng/mL的工作溶液;另精密吸取内标储备液适量加70%甲醇溶液配制成黄芩苷为28.7 ng/mL的内标溶液。
2.2.5 模拟生物样本的制备 分别精密吸取内标溶液、斯皮诺素系列工作溶液各10 µL,加入到150 µL的空白血浆中制成质量浓度为0.81、16.29、24.43、57.01、65.15、81.44 ng/mL的模拟生物样本。
2.2.6 血浆样品处理 取内标溶液10 µL,挥干,加150 µL血浆涡旋1 min,然后加乙腈450 µL,涡旋3 min,4 ℃、13 000 r/min离心15 min,取上清液400 µL于EP管中,离心浓缩蒸干,100 µL 70%甲醇(含0.1%甲酸)溶液复溶,4 ℃、13 000 r/min离心10 min,取上清进样分析。
2.2.7 方法学考察
(1)专属性考察:取大鼠空白血浆、模拟生物血浆样品和0.75 h含药血浆按“2.2.6”项下方法处理血浆样品进样分析。
(2)标准曲线与最低定量下限(LLOQ):以待测成分峰面积与内标峰面积的比值作为纵坐标(),血浆中加入的待测成分对照品的质量浓度作为横坐标(),采用1/2加权最小二乘法进行线性回归,求出线性回归方程。LLOQ为标准曲线上的最低浓度点,其响应值应为空白生物基质干扰物响应值的10倍以上(/≥10),且精密度表示为相对标准偏差(relative standard deviation,RSD)应≤20%;并计算LLOQ点的准确度,其回算的质量浓度应在标示质量浓度的±20%。其余质控样品回算的质量浓度应在标示质量浓度的±15%内。
(3)精密度与准确度:批内精密度采用LLOQ、低、中、高质量浓度质控样品工作液在同一工作日内进行测定。批间精密度采用3个分析批的LLOQ、低、中、高质量浓度质控样品工作液连续3 d进样,每个浓度5个样品进样分析,以RSD来评估批内、批间精密度,LLOQ样品的RSD不得超过20%,低、中、高质量浓度质控样品的RSD不得超过15%;用相对误差(relative error,RE)来评估批内、批间准确度,LLOQ样品的RE不得超过20%,低、中、高浓度质控样品的RE不得超过15%。
(4)基质效应与提取回收率:取内标和LLOQ、低、中、高质量浓度质控工作溶液各10 µL,挥干,加入150 µL空白血浆,按“2.2.6”项下制备质控样品(A);取150 µL空白血浆按“2.2.6”项下方法处理,上清液分别加入内标、LLOQ、低、中、高浓度质控工作液10 µL(B);以水溶液代替空白血浆按“2.2.6”项下方法处理,上清液分别加入内标、LLOQ、低、中、高质量浓度质控工作液10 µL(C)。以相同质量浓度A与B溶液的峰面积比值计算提取回收率;以B与C溶液的峰面积比值计算基质效应。
(5)稳定性:取内标和LLOQ、低、中、高质量浓度质控工作溶液各10 µL,挥干,加入150 µL空白血浆,混匀,分别于−80 ℃反复冻融3次、−80 ℃下保存20 d和室温下血浆样品放置4 h考察样品处理前稳定性;按“2.2.6”项下方法处理后的质控样品考察进样器4 ℃放置24 h稳定性及室温下放置4 h稳定性。以RSD和RE来评估样品稳定性,LLOQ样品的RSD、RE不得超过20%,低、中、高质量浓度质控样品的RSD、RE不得超过15%。
2.2.8 动物分组及药动学研究 SD大鼠10只,适应性饲养7 d后,随机分为正常组(=5)和抗生素组(=5),抗生素组大鼠以无菌水、无菌饲料喂养,并使用无菌垫料。抗生素组按“2.1.3”项下方法造模成功后,代谢2 d;造模期间正常对照组ig等体积的生理盐水。给药前禁食12 h,自由饮水,2组大鼠均ig酸枣仁总黄酮(120 mg/kg)。分别于给药前及给药后0.083、0.167、0.333、0.5、0.75、1、2、4、6、10 h眼眶采血,置于预先涂有1%肝素钠的EP管中,3500 r/min离心10 min,取上清,即得血浆。
2.2.9 药动学数据处理 采用DAS 3.2.8数据处理软件(中国药理学会数学药理学专业委员会),以非房室模型法(统计矩法)进行药动学参数达峰浓度(max)、达峰时间(max)、半衰期(1/2)、血药浓度-时间曲线下面积(AUC0~t)、平均驻留时间(MRT0~t)、总体清除率(CL/F)等的计算,并对研究时间延长至无穷后的参数AUC0~∞、MRT0~∞进行预测。
3 结果
3.1 正常与抗生素大鼠的菌群差异分析
3.1.1 菌群数量分析 在正常状态下,粪便微生物与菌群之间保持相对稳定的状态,并且与宿主之间保持相对平衡。当菌群发生改变,粪便微生物数量也随之改变。如图1所示,与正常组相比,抗生素组大鼠肠道菌群的分类操作单元(operational taxonomic unit,OTU)总数量显著降低(<0.01),表明抗生素组大鼠肠道菌群数量发生了明显的改变,抗生素大鼠模型制备成功。
3.1.2 菌群多样性分析 本研究肠道微生物群落的Alpha多样性分析以Chao指数、Observed_species指数(表征丰富度)及Shannon指数(表征多样性)进行评估。如图2所示,正常组大鼠肠道菌群中Chao指数、Observed_species指数及Shannon指数显著高于抗生素大鼠(<0.05),表明经抗生素干预后大鼠肠道菌群Alpha多样性降低,菌群稳态被破坏。
3.1.3 菌群差异分析 为了明确抗生素干预对大鼠肠道菌群的影响,利用微生物信息进行LEfSe分析。结果以显著差异物种LDA值分布柱状图(图3)进行展示。正常肠道菌群主要由厚壁菌门、拟杆菌门、放线菌门、变形杆门和疣微菌门组成。LEfSe分析显示在正常大鼠粪便中包括厚壁菌门的乳酸杆菌属、瘤胃球菌、梭菌科梭菌属、拟杆菌门的普雷沃菌属、变形菌门的志贺氏菌属、放线菌门的安德克氏菌属、疣微菌门的阿克曼菌属等13种标志性差异菌属(LDA>3,<0.05)。经抗生素干预后,大鼠肠道菌群的数量和组成均有显著改变,LEfSe分析显示仅有厚壁菌门的真细菌属和放线菌门的双歧杆菌属成为其标志性菌属(LDA>3,<0.05),菌群组成稳态被破坏。
3.2 正常大鼠与抗生素大鼠粪便中原型成分及代谢产物的鉴定
利用UHPLC-Q-TOF-MS/MS技术分别对酸枣仁总黄酮体外样品、正常组大鼠粪便样品、抗生素组大鼠粪便样品进行检测,基峰离子流图见图4。利用Metabolite Pilot软件对采集的正常组和抗生素大鼠组粪便原始数据进行分析,原型成分与代谢产物信息见表2。
首先,对已知成分采用对照品进行裂解规律分析。在正离子模式下,斯皮诺素、当药黄素和6′′′阿魏酰斯皮诺素均产生了碎片离子429.118 2、351.086 3、327.086 7和297.076 0。177.054 3为6′′′阿魏酰斯皮诺素阿魏酰基的特征碎片离子。异牡荆素和牡荆素分别为以芹菜素为母核的C-6碳糖和C-8碳糖。在正离子模式下,两者通过丢失中性碎片-C5H10O5、-CO和-H2O,产生特征碎片337、313、283。维采宁II为以芹菜素为母核的C-6和C-8双碳糖类,337、325、295为其特征碎片[21]。以上黄酮碳糖类成分均有规律地脱去120(C4H8O4)、90(C3H6O3)和60(C2H4O2)产生碎片离子。此外,山柰酚-3--芸香糖苷为酸枣仁中代表性的黄酮氧糖苷类成分。在正离子模式下,其通过直接脱掉双糖苷产生287的特征碎片[22]。
表2 基于UHPLC-Q-TOF-MS/MS的正常组和抗生素组大鼠的原型及代谢产物
Table 2 Prototype and metabolites of rats in normal group and antibiotic-treated groupbased on UHPLC-Q-TOF-MS/MS
编号tR/min[M+H]+偏差/(×10−6)碎片离子分子式成分平均峰面积(n = 3) 正常组抗生素组 1a9.68595.165 3−0.7577.153 5, 559.143 6, 457.112 0, 379.070 1, 337.070 1, 325.070 4, 313.070 9, 295.059 5C27H30O15维采宁II7.03×10−4±8.98×10−31.05×10−5±1.25×10−4** M110.63741.221 5−2.9609.177 0, 489.137 1, 447.124 9, 429.116 3, 351.085 6, 327.085 7, 297.074 1C33H40O19斯皮诺素葡萄糖基化去甲氧基产物ND6.93×10−4±4.07×10−4 M211.21625.172 5−0.7607.171 5, 505.131 5, 463.121 4, 445.110 0, 397.0903, 367.080 5, 343.078 3, 313.070 4C28H32O16斯皮诺素羟基化产物ND9.94×10−4±6.97×10−4 M311.92463.122 6−2.0445.112 0,409.090 6, 367.068 8, 343.080 4, 313.070 4C22H22O11当药黄素羟基化产物ND2.93×10−4±1.87×10−4 M413.41449.144 40.3431.132 8, 413.122 6, 395.111 8, 365.101 7, 353.101 9, 329.101 6, 299.090 7, 275.054 2, 245.043 7, 233.043 5, 209.043 8C22H24O10当药黄素氢化产物9.29×10−5±1.14×10−4ND M513.44771.233 7−0.7651.189 8, 609.176 3, 591.167 7, 489.139 8, 447.126 2, 429.116 2, 351.084 9, 327.085 8, 297.075 1, 285.073 7, 145.050 9C34H42O20斯皮诺素葡萄糖基化 产物ND1.10×10−5±4.91×10−4 2a13.68609.182 31.4489.139 1, 447.127 7, 429.118 2, 351.086 3, 327.086 7, 297.076 0, 285.075 7C28H32O15斯皮诺素2.57×10−4±3.11×10−43.67×10−7±4.97×10−3* 3a13.70433.112 2−1.6415.102 2, 397.090 5, 337.070 9, 313.070 4, 283.059 8C21H20O10牡荆素2.21×10−5±2.62×10−54.04×10−5±7.03×10−4 M613.83579.169 6−2.2433.112 1, 415.098 7, 337.070 1, 313.069 3, 301.139 9C27H30O14维采宁II去羟基化产物ND1.79×10−4±4.97×10−3 4a14.01433.113 61.5397.090 5, 367.083 5, 337.071 4, 313.069 7, 283.058 6C21H20O10异牡荆素3.49×10−5±4.55×10−42.09×10−6±8.04×10−5* 5a14.63447.129 11.1429.118 2, 411.107 4, 351.086 3, 327.086 7, 297.076 0C22H22O10当药黄素4.51×10−6±5.24×10−56.90×10−6±2.90×10−4* M714.65429.118 10.2411.098 5, 393.093 9, 375.264 3, 351.083 8, 327.104 8, 323.162 1, 297.074 8, 285.078 8C22H20O9当药黄素脱水产物3.18×10−5±3.74×10−35.15×10−5±2.23×10−5 M814.95463.123 2−0.7445.111 6, 397.090 9, 367.080 3, 343.080 0, 313.070 8C22H22O11当药黄羟基化产物ND5.98×10−4±1.48×10−3 615.38447.126 10.5327.085 9, 299.054 5C22H22O10异当药黄素3.49×10−5±4.55×10−42.09×10−6±8.04×10−5** M915.88449.108 50.4287.054 9, 145.050 1C21H20O11山柰酚葡萄糖基化产物ND1.78×10−5±4.70×10−4 715.89595.166 71.5449.106 6, 287.054 2C27H30O15山柰酚-3-O-芸香糖苷ND9.32×10−5±2.99×10−4 M1016.17771.213 20.1651.165 8, 609.177 9, 447.153 7, 429.117 7, 351.085 2, 327.085 2, 297.075 8, 163.038 6C37H38O186′′′-阿魏酰斯皮诺素去甲基产物ND9.76×10−5±5.81×10−4 818.15755.215 1−0.4635.174 4, 609.179 7, 447.128 0, 429.117 4, 327.086 0, 297.075 8, 147.043 9C37H38O176′′′-p-香豆酰斯皮诺素3.62×10−2±1.61×10−22.56×10−6±1.13×10−4** 9a18.36785.228 2−0.7665.185 8, 605.164 8, 489.138 4, 447.128 5, 429.118 2, 351.086 3, 327.086 7, 297.076 0, 285.075 1, 177.054 3C38H40O186′′′-阿魏酰斯皮诺素ND1.32×10−7±5.02×10−6 M1118.55447.129 30.9411.284 7, 343.091 5, 327.081 7, 297.068 9, 285.074 7, 207.024 4C22H22O10芫花素葡萄糖基化产物1.67×10−4±6.11×10−3ND M1218.99803.238 5−1.0683.211 1, 429.118 2, 351.085 5, 327.085 6, 195.064 6C38H42O196′′′-阿魏酰斯皮诺素水合产物1.00×10−5±8.77×10−5ND M1318.90433.132 8−2.0415.138 9, 397.125 3, 337.118 5, 327.112 5, 311.106 0, 301.107 2, 297.221 3, 285.221 4, 249.075 7, 245.083 3C22H22O9当药黄素去甲基产物1.14×10−4±3.73×10−3ND M1421.06755.218 1−0.1635.173 4, 447.128 5, 429.114 3, 351.082 6, 327.085 1, 285.073 4, 147.044 1C37H38O176′′′-阿魏酰斯皮诺素去甲氧基产物ND4.29×10−4±1.79×10−4 M1522.37415.138 90.3397.314 8, 355.115 2, 327.088 7, 323.082 4, 279.209 9, 263.066 4, 235.116 0C22H22O8当药黄素去羟基化产物ND1.93×10−4±6.60×10−2
a通过与对照品比较确定;ND为未检测到;与正常组比较:*<0.05**<0.01
adetermined by comparison with standard; ND is not detected;*< 0.05**< 0.01normal group
参考以上裂解特征碎片及文献报道[23],在2组粪便中快速表征和鉴别了24个化合物,其中9个原型成分和15个代谢产物。
由表2可知,在抗生素组大鼠粪便中鉴定了9种原型成分,分别为维采宁II(1)、斯皮诺素(2)、牡荆素(3)、异牡荆素(4)、当药黄素(5)、异当药黄素(6)和山柰酚-3--芸香糖苷(7)、6′′′--香豆酰斯皮诺素(8)及6′′′-阿魏酰斯皮诺素(9);在正常大鼠鉴定了维采宁II(1)、斯皮诺素(2)、牡荆素(3)、异牡荆素(4)、当药黄素(5)、异当药黄素(6)及6′′′--香豆酰斯皮诺素(8)共7种原型成分。其中异当药黄素(6)及6′′′--香豆酰斯皮诺素(8)通过与文献比对鉴别[24]。
在正常组与抗生素组大鼠粪便中共鉴定了15种代谢产物。抗生素组大鼠粪便中11种代谢产物,即M1~M3、M5~M10和M14~M15,主要发生去甲基化、脱甲氧基、去羟基化等I相代谢反应及葡萄糖基化II相代谢反应。如图4所示,抗生素组大鼠粪便总离子流图信息更为丰富,抗生素大鼠中11种代谢物结构式及二级质谱图信息见图5、6。
M2的相对分子质量(/625.172 5)比斯皮诺素多16。二级质谱显示碎片离子/505.131 5为母离子丢失C4H8O4(120)所得。此外,碎片离子/463.121 4比斯皮诺素特征碎片/447多16,推测M2为斯皮诺素羟基化代谢产物。M3和M8的准分子离子峰分别为/463.122 6和/463.123 2,比当药黄素相对分子质量多16,且其二级质谱碎片离子分别比当药黄素特征碎片离子351.086 3、327.086 3和297.075 5多16,因此推测M3和M8为当药黄素的羟基化产物。
M1产生/741.221 5 [M+H]+的分子离子峰。母离子通过脱去C5H8O4(132)产生碎片离子609.177 0,推测母核为斯皮诺素。碎片离子609进一步丢失中性碎片C4H8O4(120)产生碎片离子489.137 1或直接脱去1分子Glu,产生碎片离子447.124 9、327.085 7和297.074 1。因此,推测M1为斯皮诺素葡萄糖基化再脱甲氧基代谢产物。M14产生755.218 1的分子离子峰,相对分子质量比6′′′-阿魏酰斯皮诺素少了30,并产生特征碎片离子447.128 5、429.114 3和327.085 1。因此推测M14为6′′′-阿魏酰斯皮诺素的脱甲氧基代谢产物。
M5准分子离子峰为/771.233 7 [M+H]+,比斯皮诺素相对分子质量多162(Glu),结合二级质谱碎片信息/609.176 3、489.139 8、327.085 8,推测M5为斯皮诺素的葡萄糖基化代谢产物。M9产生449.108 5 [M+H]+的分子离子峰,通过丢失1分子Glu(162)产生特征碎片离子/287.054 9 (山柰酚),推测M9为山柰酚葡萄糖基化产物。
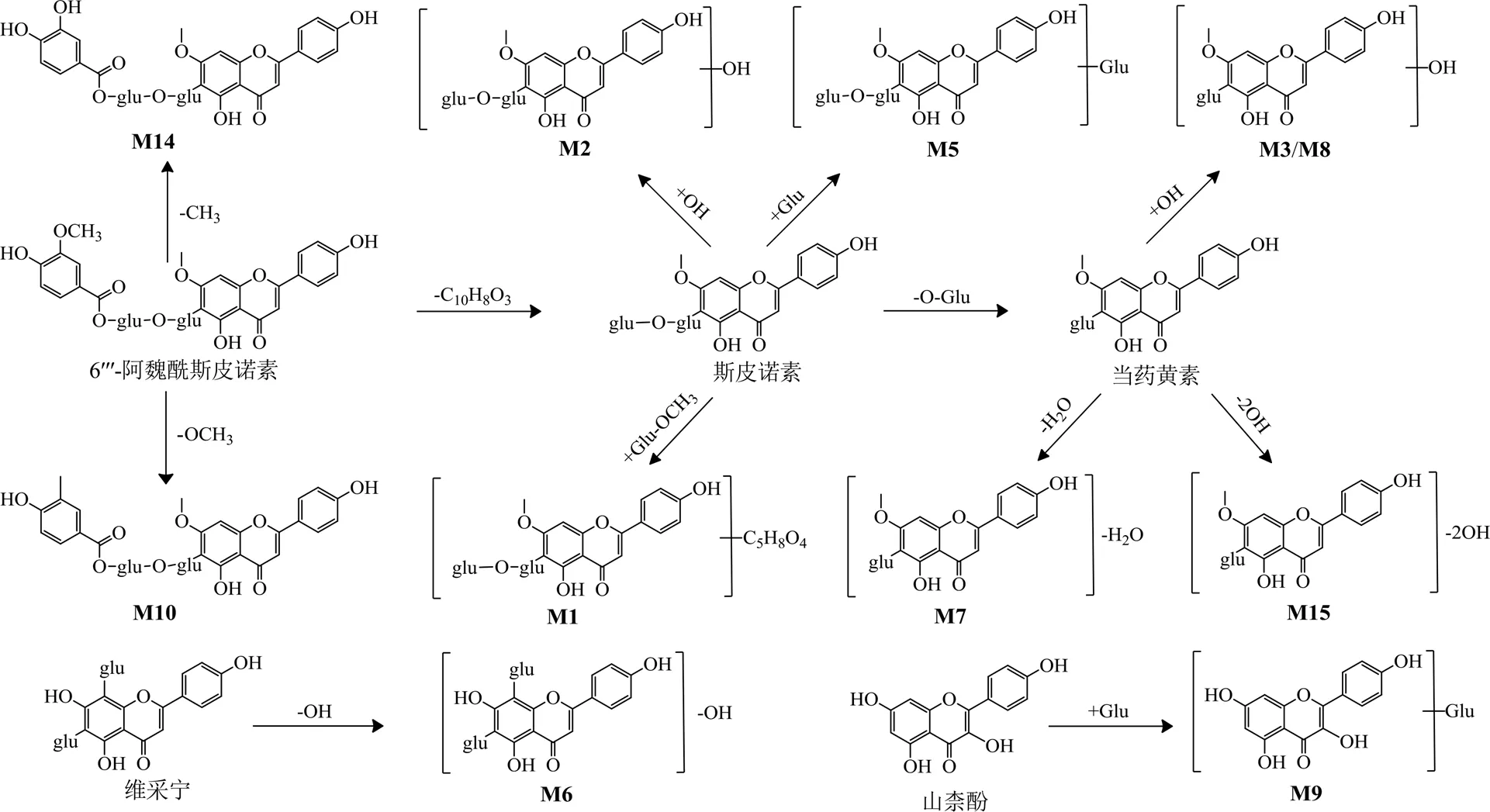
图5 酸枣仁总黄酮在抗生素大鼠粪便中代谢途径
图6 抗生素大鼠粪便中11种代谢产物提取离子流图
M6产生579.169 6 [M+H]+的分子离子峰。其相对分子质量比维采宁II多16,并产生碎片离子337.070 1、313.069 3和301.139 9,推测M6为维采宁II的脱羟基代谢产物。M15产生415.138 9的分子离子峰,比当药黄素少32,并产生与当药黄素相同的碎片离子327.088 7,因此,推测M15为当药黄素脱2分子羟基代谢产物,且羟基均从糖基侧链丢失。
M10产生771.213 2 [M+H]+的分子离子峰和碎片离子609.177 9、447.153 7、327.085 2和297.075 8。此外,163.038 6为阿魏酰基脱CH3生成的碎片离子,推测M10为6′′′-阿魏酰斯皮诺素的去甲基产物,且甲基从阿魏酰基丢失。
正常大鼠粪便中鉴定了5种代谢产物,即M4、M7、M11~M13,主要发生氢化、去甲基化、糖基化、水合等代谢反应类型。M4产生分子离子峰449.144 4,碎片离子431.132 8、413.122 6、353.101 9和329.101 6分别比当药黄素碎片离子429.117 6、411.107 4、351.086 3和327.087 2多2,推测M4为当药黄素氢化代谢产物。M11产生447.129 3的分子离子峰,通过丢失中性碎片C4H8O4产生碎片离子327.081 7及碎片离子z 297.068 9、285.074 7和207.024 4。与本课题组前期[25]研究一致,推测M11为芫花素葡萄糖基化代谢产物。M12产生803.238 5的分子离子峰,通过丢失中性碎片C4H8O4产生碎片离子683.211 1及碎片离子429.118 2、327.085 6和195.064 6。其中碎片离子195.064 6较阿魏酰基碎片离子多18,因此,推测M12为6′′′-阿魏酰斯皮诺素水合产物。M13产生分子离子峰433.132 8,碎片离子415.138 9、397.125 3、337.118 5均比当药黄素碎片离子429.117 6、411.107 4、351.086 3少14,推测M13为当药黄素去甲基化代谢产物。
2组中共同鉴别到7种原型成分及1种代谢产物,其峰面积均在抗生素组均显著高于正常组(<0.05),见表2。共有代谢产物M7产生/429.118 1 [M+H]+的分子离子峰,比当药黄素相对分子质量少16,产生当药黄素特征碎片离子/411.098 5、351.083 8、327.104 8、297.074 8,推测其为当药黄素脱水反应的代谢产物。
3.3 方法学考察
3.3.1 专属性 在“2.1.1”项色谱条件下,血浆中内源性基质对待测成分斯皮诺素(R=11.31 min)和内标黄芩苷(R=12.74 min)无干扰,表明该色谱质谱条件下待测成分的专属性良好。MRM色谱图见图7。
3.3.2 标准曲线与LLOQ 斯皮诺素的回归方程为=0.110 20+0.108 84,2=0.999 6,线性范围为0.81~81.44 ng/mL,LLOQ为0.81 ng/mL,在线性范围内相关性良好。
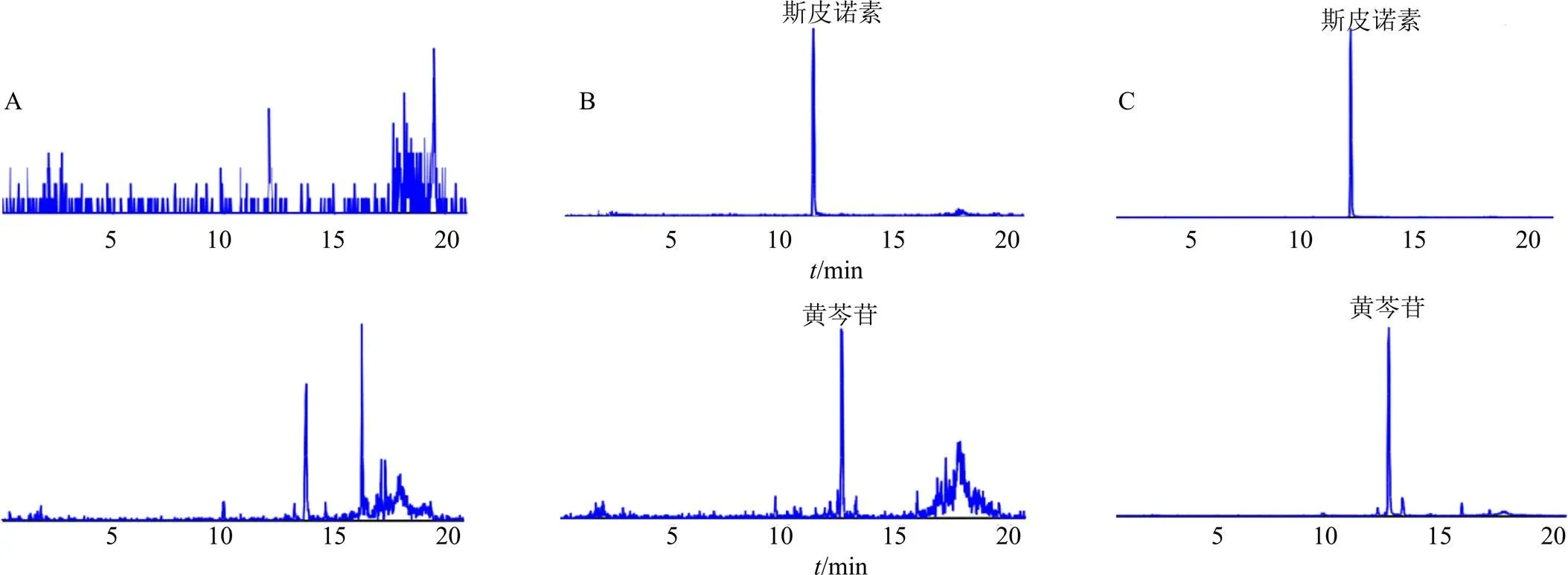
A-空白血浆 B-空白血浆中添加斯皮诺素对照品及内标 C-ig酸枣仁总黄酮0.75 h的血浆样品
3.3.3 精密度和准确度考察 如表3所示,待测成分LLOQ、低、中、高质量浓度的批内精密度的RSD为6.04%~13.30%,准确度的RE为−4.50%~10.96%,且LLOQ的RSD和RE均小于20%;批间精密度的RSD在5.50%~10.31%,准确度的RE为−6.42%~14.81%,LLOQ样品的RSD和RE均在20%以内,符合生物样品含量测定要求。
3.3.4 基质效应和提取回收率 斯皮诺素LLOQ、低、中、高质量浓度的质控样品基质效应及提取回收率结果见表4。血浆中斯皮诺素的基质效应在90.15%~107.97%,RSD为4.52%~16.96%。斯皮诺素LLOQ、低、中、高质量浓度的质控样品平均提取回收率均>70%,RSD<15%,符合生物样本含量测定的要求。
3.3.5 样品稳定性 斯皮诺素在LLOQ、低、中、高质量浓度质控样品的模拟血浆样品的−80 ℃下冻融3次的稳定性、−80 ℃冷冻条件下保存20 d的长期稳定性、室温下25 ℃放置4 h的短期稳定性、样品处理后在室温下25 ℃放置4 h和自动进样器中放置24 h的稳定性结果见表5,模拟血浆样品的稳定性RSD在1.21%~14.91%,RE在−6.45%~14.64%;处理后样品稳定性的RSD在0.97%~13.91%,RE在−10.69%~7.87%。LLOQ浓度样品RSD与RE均小于20%,表明斯皮诺素在模拟生物样本中的稳定性符合生物样本分析要求。
表3 斯皮诺素的批内和批间精密度
Table 3 Intra-batch and inter-batches accuracy of spinosin
理论质量浓度/(ng·mL−1)批内(n = 5)批间(n = 5) 计算质量浓度/ (ng·mL−1)精密度RSD/%准确度RE/%计算质量浓度/ (ng·mL−1)精密度RSD/%准确度RE/% 0.410.398.09−4.500.389.41−6.42 0.810.9013.3010.960.9310.3114.81 57.0158.467.222.5458.797.193.12 65.1569.656.046.9167.865.504.16
表4 斯皮诺素的基质效应和提取回收率
Table 4 Matrix effects and extraction recovery of spinosin
质量浓度/(ng·mL−1)基质效应/%基质效应RSD/%提取回收率/%提取回收率RSD/% 0.4196.80±16.4116.9689.29±6.066.78 0.8190.15±4.074.5278.08±3.694.72 57.01107.97±4.825.2091.69±5.245.71 65.15104.63±7.738.0873.82±3.344.52
表5 不同储存条件下斯皮诺素的稳定性
Table 5 Stability of spinosin under different storage conditions
质量浓度/(ng·mL−1)−80 ℃反复冻融−80 ℃保存20 d室温放置4 h进样器放置24 h室温放置4 h RSD/%RE/%RSD/%RE/%RSD/%RE/%RSD/%RE/%RSD/%RE/% 0.4114.911.7112.8914.6410.382.1910.11−10.6913.912.61 0.814.155.125.496.016.743.132.964.0410.19−8.03 57.011.21−6.454.77−1.384.28−3.580.971.124.247.87 65.153.4712.998.161.127.7412.044.733.826.58−1.05
3.4 正常与抗生素大鼠体内药动学研究
采用以上分析方法对正常与抗生素组大鼠ig酸枣仁总黄酮后斯皮诺素的含量进行测定。应用DAS 3.2.8软件对药动学数据进行非房室模型拟合,计算药动学参数。采用SPSS软件对正常组与抗生素组的药动学参数进行统计分析。如图8所示,2组大鼠血浆中斯皮诺素的药时曲线均呈双峰吸收现象。如表6所示,与正常组比较,抗生素组大鼠血浆中斯皮诺素的max显著降低(<0.05),max、1/2和MRT0~t显著增高(<0.05),表明在菌群破坏的情况下,斯皮诺素入血吸收明显减少,达峰时间延长。提示大鼠肠道菌群变化可导致酸枣仁黄酮成分的吸收减少和延迟,同时也更好地解释了抗生素组大鼠粪便中斯皮诺素的相对峰面积较正常组高的现象。
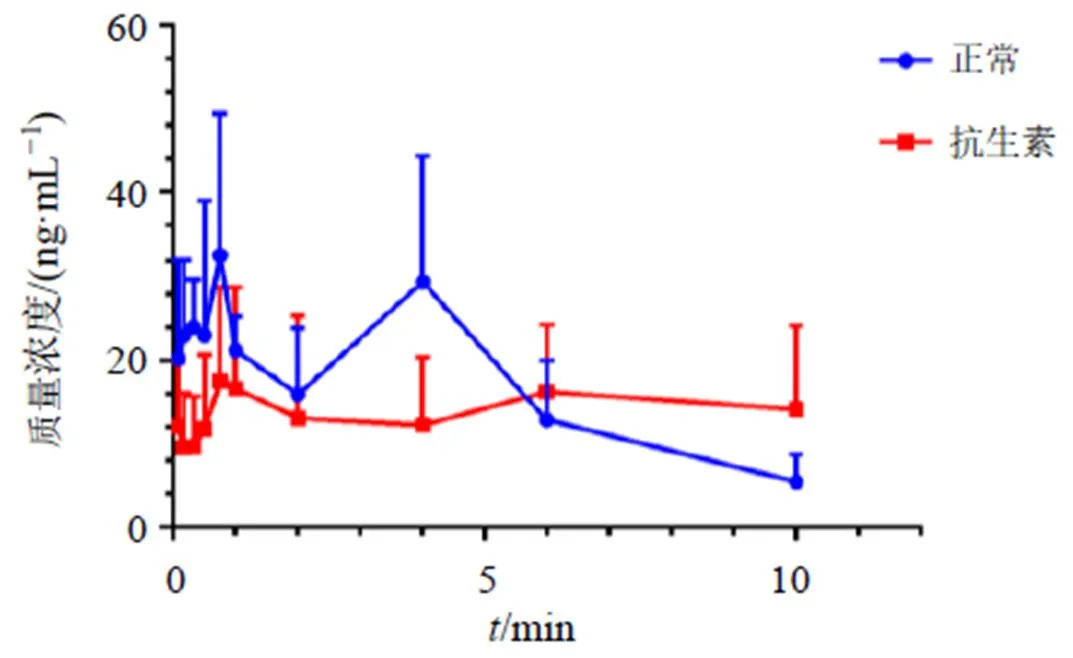
图8 正常组和抗生素组大鼠ig酸枣仁总黄酮后血浆中斯皮诺素的药时曲线
表6 斯皮诺素的药动学参数
Table 6 Pharmacokinetic parameters of spinosin
参数单位正常组抗生素组 Cmaxng·mL−140.73±10.6225.27±6.89* Tmaxh1.45±1.435.00±2.88* t1/2h2.78±1.038.73±7.87* AUC0~tng·h−1·mL−1167.53±57.99142.64±46.40 AUC0~∞ng·h−1·mL−1192.29±70.13168.80±54.85 MRT0~th3.82±0.415.20±1.22* MRT0~∞h5.15±1.036.75±1.80 CL/FL·h−1·kg−1129 728.79±30 750.13191 003.77±64 276.76
与正常组比较:*<0.05
*< 0.05normal group
4 讨论
本研究探索了正常大鼠与抗生素大鼠ig酸枣仁总黄酮后粪便中原型成分及代谢产物种类的差异,结果显示抗生素组大鼠体内发生的反应类型及I相代谢产物明显多于正常组大鼠,并比较了具有改善睡眠和抗焦虑作用的活性成分斯皮诺素在正常大鼠与抗生素大鼠体内的药动学行为。
在正常与抗生素大鼠粪便中共鉴定了9种原型成分。共有原型成分维采宁II、斯皮诺素、异牡荆素、当药黄素、异当药黄素和6′′′--香豆酰斯皮诺素的平均峰面积在抗生素大鼠粪便中显著高于正常大鼠(<0.05)。研究报道酸枣仁中黄酮类成分可在体外被肠道菌群代谢,如-糖苷类山柰酚-3--芸香糖苷可在体外肠道菌群作用下脱去芸香糖,进而发生环裂解反应,生成小分子酚酸类,并在24 h完全降解[26];正常大鼠肠道菌群中优势种属如乳酸杆菌属、瘤胃球菌属、梭菌科梭菌属等菌属中存在可以与黄酮-糖苷和-糖苷发生相互作用的酶系,参与包括糖基水解反应、去甲基化反应、脱羟基化反应、还原反应以及环裂变反应等多种代谢反应[27-31]。在抗生素干预下大鼠肠道菌群稳态环境受到破坏,对酸枣仁黄酮类成分的代谢转化能力降低[32-34],这可能是原型成分在抗生素组大鼠粪便中峰面积显著高于正常组的主要原因。
2组大鼠粪便中共鉴定到15种代谢产物。正常大鼠粪便中检测到了5种代谢产物;抗生素大鼠粪便中鉴定到了反应类型更为丰富的11种代谢产物,包括较为特殊的脱甲氧基代谢产物及去羟基化代谢产物。Jin等[35]研究表明在伪无菌大鼠粪便中检测到丹酚酸A的脱甲氧基及去羟基化反应代谢产物,而在正常大鼠粪便中未检测到其代谢产物。已有文献报道肝脏中存在细胞色素P450等酶系,可以催化黄酮类成分发生脱甲氧基和去羟基化等I相代谢反应[36-37],因此在抗生素大鼠粪便中这2种代谢产物可能主要由肝脏的代谢产生[38-39]。而在正常大鼠体内,脱甲氧基及去羟基化的代谢产物可能进一步被肠道菌群转化为下游代谢产物。
药动学结果显示,抗生素大鼠和正常大鼠血浆中斯皮诺素的吸收均呈现双峰吸收。与正常组相比,在抗生素大鼠血浆中斯皮诺素max显著降低(<0.05),max和1/2显著增高(<0.05),表明在抗生素大鼠体内斯皮诺素吸收减少且消除减慢。Jiao等[40]研究发现6′′′-对香豆酰斯皮诺素和6′′′-阿魏酰斯皮诺素等斯皮诺素衍生物,均可被由大鼠肠道菌群产生的β-葡萄糖苷酶体外催化发生脱糖基化反应转化为斯皮诺素。本课题组研究亦发现肠道菌群可有效水解斯皮诺素衍生物的对香豆酰、阿魏酰和对羟基苯甲酰等基团,生成共同的代谢产物斯皮诺素;进而斯皮诺素可被水解生成当药黄素(6-C糖)[17]。本研究中抗生素干预大鼠的肠道菌群处于紊乱状态,菌群中优势菌门数量急剧下降[41-43],包括有β-葡萄糖苷酶活性的如拟杆菌属、乳酸杆菌属、普雷沃菌属等菌属,从而减缓了对斯皮诺素及其系列衍生物的代谢转化速率,导致抗生素大鼠体内斯皮诺素max与正常大鼠相比较低,并保持在比较稳定的水平。
本研究从肠道菌群代谢和药动学的角度,初步阐释了肠道菌群对酸枣仁黄酮类成分吸收和代谢的影响,同时也为酸枣仁总黄酮的药效物质基础及吸收代谢机制研究提供科学依据。
利益冲突 所有作者均声明不存在利益冲突
[1] 中国药典 [S]. 一部. 2020: 382.
[2] 闫艳, 张敏, 崔小芳, 等. 酸枣仁化学成分体内过程及其质量标志物研究思路探讨 [J]. 中草药, 2019, 50(2): 299-309.
[3] 宋伟, 唐生安, 曹冰雁, 等. 酸枣仁黄酮部位不同配伍的解郁安神作用及谱-效相关性分析 [J]. 中草药, 2018, 49(5): 1123-1131.
[4] 屈婉, 刘硕, 朱华伟, 等. 酸枣仁水提物对焦虑大鼠症状的改善及其对肠道菌群的影响 [J]. 现代食品科技, 2019, 35(11): 30-36.
[5] Cai M D, Jung I, Kwon H,. Spinosin attenuates Alzheimer’s disease-associated synaptic dysfunction via regulation of plasmin activity [J]., 2020, 28(2): 131-136.
[6] Wang T X, Wei H H, Chen Z K,. Hypnotic activities of Zao Ren An Shen Capsule, a traditional Chinese medicine, in an anxiety-like mouse model [J]., 2021, 25(3): 1613-1623.
[7] Xu F X, He B S, Xiao F,. Neuroprotective effects of spinosin on recovery of learning and memory in a mouse model of Alzheimer’s disease [J]., 2019, 27(1): 71-77.
[8] 闫艳, 申晨曦, 张福生, 等. 酸枣仁与理枣仁的研究进展及质量标志物预测分析 [J]. 中草药, 2019, 50(19): 4769-4784.
[9] Zhao X T, Liu J J, Wen Z Y,. The pharmacokinetics and tissue distribution of coumaroylspinosin in rat: A novel flavone-glycoside derived from[J]., 2017, 1046: 18-25.
[10] Zhang Y Q, Zhang T, Wang F L,. Brain tissue distribution of spinosin in rats determined by a new high-performance liquid chromatography-electrospray ionization-mass/mass spectrometry method [J]., 2015, 53(1): 97-103.
[11] Qiao L D, Liu Y, Chen X Y,. A HPLC-MS/MS method for determination of 6′′′-feruloylspinosin in rat plasma and tissues: Pharmacokinetics and tissue distribution study [J]., 2016, 121: 77-83.
[12] du C H, Yan Y, Shen C X,. Comparative pharmacokinetics of six major compounds in normal and insomnia rats after oral administration ofaqueous extract [J]., 2020, 10(4): 385-395.
[13] Chen H T, Huang H L, Li Y Q,. Therapeutic advances in non-alcoholic fatty liver disease: A microbiota-centered view [J]., 2020, 26(16): 1901-1911.
[14] Riva A, Kolimár D, Spittler A,. Conversion of rutin, a prevalent dietary flavonol, by the human gut microbiota [J]., 2020, 11: 585428.
[15] Li H K, He J J, Jia W. The influence of gut microbiota on drug metabolism and toxicity [J]., 2016, 12(1): 31-40.
[16] Paraiso I L, Plagmann L S, Yang L P,. Reductive metabolism of xanthohumol and 8-prenylnaringenin by the intestinal bacterium[J]., 2019, 63(2): 1800923.
[17] 崔小芳, 杜晨晖, 裴香萍, 等. 基于肠道菌群转化的酸枣仁质量标志物预测分析 [J]. 中草药, 2019, 50(19): 4634-4642.
[18] Bao K D, Li P, Qi L W,. Characterization of flavonoid metabolites in rat plasma, urine, and feces after oral administration ofextract by HPLC-diode-array detection (DAD) and ion-trap mass spectrometry (MS(n)) [J]., 2009, 57(2): 144-148.
[19] 闫艳, 李强, 杜晨晖, 等. 基于体内-体外物质组关联分析酸枣仁潜在效应物质 [J]. 药学学报, 2017, 52(2): 283-290.
[20] 武锦春. 正常人肠道菌群对酸枣仁总黄酮的体外代谢研究 [D]. 太原: 山西大学, 2021.
[21] Zhang F X, Li M, Qiao L R,. Rapid characterization ofby UPLC/Qtof MS with novel informatics platform and its application in evaluation of two seeds fromspecies [J]., 2016, 122: 59-80.
[22] 武宝爱, 闫锋, 申晨曦, 等. UPLC-MS/MS法结合化学计量学法分析酸枣仁和理枣仁中多指标成分 [J]. 中草药, 2021, 52(8): 2400-2407.
[23] Choi M S, Kim J K, Kim D H,. Effects of gut microbiota on the bioavailability of bioactive compounds fromleaf extracts [J]., 2019, 9(7): E132.
[24] 申晨曦. 酸枣仁和理枣仁化学成分系统表征及对比研究 [D]. 太原: 山西大学, 2020.
[25] 张敏. 酸枣仁水提取物体内过程研究 [D]. 太原: 山西大学, 2019.
[26] Vollmer M, Esders S, Farquharson F M,. Mutual interaction of phenolic compounds and microbiota: Metabolism of complex phenolic apigenin-- and kaempferol--derivatives by human fecal samples [J]., 2018, 66(2): 485-497.
[27] Wei B, Wang Y K, Qiu W H,. Discovery and mechanism of intestinal bacteria in enzymatic cleavage of C-C glycosidic bonds [J]., 2020, 104(5): 1883-1890.
[28] Yang G H, Hong S, Yang P J,. Discovery of an ene-reductase for initiating flavone and flavonol catabolism in gut bacteria [J]., 2021, 12(1): 790.
[29] Braune A, Engst W, Blaut M. Identification and functional expression of genes encoding flavonoid- and-glycosidases in intestinal bacteria [J]., 2016, 18(7): 2117-2129.
[30] Santangelo R, Silvestrini A, Mancuso C. Ginsenosides, catechins, quercetin and gut microbiota: Current evidence of challenging interactions [J]., 2019, 123: 42-49.
[31] 李鑫靓, 张树明. 湿浊内蕴证、脾肾两虚证慢性肾衰患者肠道菌液对黄芪水提物中毛蕊异黄酮葡萄糖苷体外代谢的影响 [J]. 中国中医药科技, 2021, 28(3): 348-351.
[32] Lee S H, An J H, Park H M,. Investigation of endogenous metabolic changes in the urine of pseudo germ-free rats using a metabolomic approach [J]., 2012, 887/888: 8-18.
[33] Cao H, Chen X Q, Jassbi A R,. Microbial biotransformation of bioactive flavonoids [J]., 2015, 33(1): 214-223.
[34] 于航, 郑瑞芳, 苏文灵, 等. 基于肠道菌的黄酮类成分代谢特征及药理学思考 [J]. 药学学报, 2021, 56(7): 1757-1768.
[35] Jin M J, Kim U, Kim I S,. Effects of gut microflora on pharmacokinetics of hesperidin: A study on non-antibiotic and pseudo-germ-free rats [J]., 2010, 73(21/22): 1441-1450.
[36] 刘双月, 安燕南, 刘斯琪, 等. 金莲花中8种黄酮类成分的肝微粒体生物转化研究 [J]. 中国现代中药, 2019, 21(11): 1489-1496.
[37] 曾华平, 陈红, 陈丹, 等. 玳玳果黄酮降脂提取物效应组分大鼠肝肠微粒体代谢特性研究 [J]. 中国中药杂志, 2019, 44(4): 819-826.
[38] Zhang X, Yin J T, Liang C J,. UHPLC-Q-TOF-MS/MS method based on four-step strategy for metabolism study of fisetinand[J]., 2017, 65(50): 10959-10972.
[39] Zhou F Q, Teng L X, Liu Y,. Elaboration of the comprehensive metabolic profile of salvianolic acid Aandusing UFLC-Q/TOF-MS [J]., 2019, 67(44): 12199-12207.
[40] Jiao L J, Li Y X, Zhang Y Q,. Degradation kinetics of 6‴--coumaroylspinosin and identification of its metabolites by rat intestinal flora [J]., 2017, 65(22): 4449-4455.
[41] Braune A, Blaut M. Bacterial species involved in the conversion of dietary flavonoids in the human gut [J]., 2016, 7(3): 216-234.
[42] Monteiro N E S, Queirós L D, Lopes D B,. Impact of microbiota on the use and effects of isoflavones in the relief of climacteric symptoms in menopausal women-A review [J]., 2018, 41: 100-111.
[43] Kim M, Kim N, Han J. Metabolism ofpolymethoxyflavones by human intestinal bacteriumsp. MRG-PMF1 [J]., 2014, 62(51): 12377-12383.
metabolic profile of total flavonoids inmediated by gut microbiota
DUAN Hui-zhu1, LIU Jia-xing2, YAN Yan2, DU Chen-hui1
1. College of Traditional ChineseMedicine and Food Engineering, Shanxi University of Chinese Medicine, Taiyuan 030619, China 2. Modern Research Center for Traditional Chinese Medicine, Shanxi University, Taiyuan 030006, China
To compare the differences ofmetabolic transformation reaction of total flavonoids in Suanzaoren (, ZSSF) in normal and antibiotic-treated rats and pharmacokinetic characteristic changes of spinosin in plasma of both groups.Rats were treated with antibiotics by intragastric administration, normal and antibiotic-treated rats were ig ZSSF (120 mg/kg), then feces and plasma from different time periods were collected. UHPLC-Q-TOF-MS/MS was used to analyze the prototype components and metabolites in feces, and baicalin was used as internal standard to establish a UPLC-MS/MS method for the determination of spinosin in rat plasma, which was applied to the comparative study of pharmacokinetics between normal and antibiotic-treated rats.A total of 24 compounds were identified from both normal and antibiotic-treated rats, including nine prototype components (vitzenin II, spinosin, vitexin, isovitexin, swertisin, isoswertisin, kaempferol-3--rutinoside, 6′′′--couma acylspinosin, 6′′′-feruloyl spinosin) and 15 metabolites. In normal rats, four metabolic reactions such as hydrogenation and glycosylation were mainly occurred, and six metabolic reactions such as demethoxylation and dehydroxylation were occurred after antibiotic intervention. Compared with normal group, plasma concentration of spinosin in antibiotic-treated group was significantly decreased (< 0.05), while peak time and half-life were significantly prolonged (< 0.05).Antibiotic intervention can lead to metabolic disorder of ZSSF in rats and affect the pharmacokinetic behavior of spinosin.
total flavonoids of; antibiotic-treated rats; gut microbiota; metabolism; pharmacokinetics; vitzenin II; spinosin; vitexin; isovitexin; swertisin; isoswertisin; kaempferol-3--rutinoside; 6′′′--couma acylspinosin; 6′′′-feruloyl spinosin
R285.5
A
0253 - 2670(2022)14 - 4376 - 12
10.7501/j.issn.0253-2670.2022.14.017
2022-01-18
山西省科技厅中央引导地方科技发展资金项目(YDZJSX2021C025);山西省自然科学基金面上项目(20210302123237,20210302123470);山西省卫生健康委“十大晋药”项目(ZYCZL 2020007);山西中医药大学青年科学家培育项目(2021PY-QN-07)
段慧竹(1996—),女,硕士,研究方向为中药资源开发与利用。Tel: 18434376753 E-mail: Duanhz0506@163.com
杜晨晖,教授,博士,研究方向为中药药效物质基础。Tel: (0351)3179982 E-mail: dch@sxtcm.edu.cn
闫 艳,副教授,博士,研究方向为中药质量控制及中药体内过程分析。Tel: (0351)7018379 E-mail: yanyan520@sxu.edu.cn
[责任编辑 李亚楠]
