甘蔗线条花叶病毒P1蛋白基因原核表达及抗血清制备
2022-04-04徐小伟陈雯丁诗文甘海锋张坤贺振
徐小伟 陈雯 丁诗文 甘海锋 张坤 贺振


摘要 甘蔗线条花叶病毒Sugarcane streak mosaic virus(SCSMV)是引起甘蔗花叶病的主要病原之一,在世界各大蔗区普遍发生,严重威胁甘蔗产业的发展。建立快速有效的检测方法对于SCSMV的防控有着重要意义。本研究依据SCSMV P1基因序列合成一对引物,扩增获得1 074 bp的目的基因,将目的基因与原核表达载体pET28a连接,获得pET28a-P1SCSMV。将连接正确的重组质粒转化大肠杆菌Rosetta菌株,经IPTG诱导后,SDS-PAGE电泳检测显示在分子量约为42 kDa处有目的蛋白带,与预期的SCSMV P1大小一致。融合蛋白主要是以可溶性蛋白的形式存在。利用镍柱亲和纯化重组的SCSMV P1蛋白,并免疫健康新西兰大白兔,制备兔抗血清。Western blot分析显示,在对多个样品进行检测时制备的抗血清能特异性地识别SCSMV的P1蛋白,在受SCSMV侵染的甘蔗植株中能检测到P1蛋白的表达,而在健康植株中检测不到P1蛋白的表达。制备的抗血清稀释至1∶20 000时仍能特异地检测到目的蛋白条带,说明通过大肠杆菌表达P1制备的SCSMV抗血清特异性强,效价高。本研究為SCSMV的快速检测提供了有效方法。
关键词 甘蔗线条花叶病毒; P1蛋白; 原核表达; 抗血清
中图分类号: S435.661
文献标识码: A
DOI: 10.16688/j.zwbh.2021042
Abstract Sugarcane streak mosaic virus (SCSMV) is one of the main pathogens that cause sugarcane mosaic disease. It occurs in major sugarcane-growing regions around the world and seriously threatens the development of the sugarcane industry. The establishment of rapid and effective detection methods to prevent and control SCSMV is of great significance. In this study, a pair of primers were synthesized based on the SCSMV P1 gene sequence, and the target gene with a size of 1 074 bp was amplified. The target gene was connected with the prokaryotic expression vector pET28a to obtain pET28a-P1SCSMV. The correct recombinant plasmid was transformed into Escherichia coli Rosetta strain. After induction by IPTG, SDS-PAGE electrophoresis showed that there was a band of the target protein at a molecular weight of about 42 kDa, which was consistent with the expected size of SCSMV P1. Fusion protein mainly existed in the form of soluble protein. The recombinant SCSMV P1 protein was obtained by affinity purification with a Ni2+-NTA column and healthy New Zealand white rabbits was immunized with recombinant SCSMV P1 protein to prepare rabbit antiserum. Western blot analysis showed that the prepared antiserum could specifically recognize the SCSMV P1 protein when testing multiple samples. The expression of P1 protein could be detected in sugarcane plants infected by SCSMV, but not in healthy plants. When the prepared antiserum was diluted to 1∶20 000, the target protein band could still be detected specifically. This suggested that the SCSMV antiserum prepared by expressing P1 in E.coli had strong specificity and high titer, which provides favorable conditions for rapid detection of SCSMV.
Key words Sugarcane streak mosaic virus; P1 protein; prokaryotic expression; antiserum
甘蔗线条花叶病毒Sugarcane streak mosaic virus(SCSMV)属于马铃薯Y病毒科Potyviridae禾草病毒属Poacevirus,是引起甘蔗花叶病的主要病原之一[1]。SCSMV病毒于1978年由Gillaspie等在美国引自巴基斯坦的甘蔗种质上首次检测到[2]。2008年-2011年,李世访研究员团队首次发现SCSMV在我国云南省甘蔗产区发生,后续调查发现SCSMV在云南省的主要甘蔗产区发生较为频繁,并且在某些地区出现了流行趋势,对中国甘蔗产业构成严重威胁[3]。SCSMV是无包膜、弯曲线状的病毒粒体,平均大小为890 nm×15 nm。SCSMV大小为10 kb左右,其外壳蛋白(coat protein, CP)包裹着正单链RNA基因组,其编码一个多聚蛋白,经水解酶酶切后分为10个成熟的蛋白质,从N端到C端依次是P1、HC-Pro、P3、6K1、CI、6K2、VPg、NIa-Pro、NIb和CP,且在P3蛋白的氨基末端以+2移码方式编码一个额外的蛋白质P3N-PIPO (N-terminus of P3-pretty interesting Potyviridae ORF)[4]。
甘蔗与高粱作为重要的经济作物,在自然条件下都可被SCSMV侵染。此外,SCSMV也可通过人工接种的方式侵染高粱Sorghum bicolor、玉米Zea mays、御谷Pennisetum glaucum等禾本科植物[5]。甘蔗被SCSMV侵染后引起的花叶病症状与甘蔗花叶病毒Sugarcane mosaic virus(SCMV)和高粱花叶病毒Sorghum mosaic virus(SrMV)侵染造成的症状相似。SCSMV主要危害甘蔗叶片,甘蔗被侵染后,叶片上出现黄绿色条纹或斑驳症状,尤其是新叶受到的危害更严重;SCSMV能系统地侵染甘蔗,导致植株生长受损,分蘖减少,汁液量减少,口感变差,进而影响甘蔗产量和品质[6]。
常见的病毒检测技术主要包括生物学检测、分子生物学检测以及血清学检测等。生物学检测的优点在于可准确、直观地体现病毒的生物学特性;分子生物学检测具有精确度和灵敏度高的优点,但其步骤较多,容易污染[78];血清学检测的优点主要是具有较高的灵敏度和准确度,操作简单等,由于其步骤较繁琐,在许多细节上需加以注意和改进才能在节省时间的同时得到背景较为清晰的条带[9]。通过从病株汁液中提纯得到的病毒制备抗血清不能完全排除寄主蛋白的影响,导致制备的抗血清检测时易出现假阳性[10]。截至当前,对禾草病毒属中11个蛋白的功能研究甚少,但对马铃薯Y病毒科病毒的研究已较明确。P1是一种丝氨酸型蛋白酶,通过自身剪切从多聚蛋白前体中分离出来。研究显示它的变异性极高,这可能与病毒对不同宿主的广泛适应性相关[11]。在禾草病毒属成员中RNA 诱导的基因沉默能够被 P1 有效抑制[12]。马铃薯Y病毒科的HC-Pro基因的原核表达载体已被构建,HC-Pro参与病毒基因组的翻译和蛋白加工,能识别HC-Pro/P3特异切割位点,HC-Pro能够抑制RNA沉默,且与P1共表达时能明显增强沉默抑制功能[13]。因此,构建SCSMV P1基因的原核表达载体可以进一步研究HC-Pro基因功能并可更加方便地检测SCSMV病毒。本研究在大肠杆菌中成功表达了SCSMV的P1蛋白,将其作为抗原免疫兔子,制备了兔抗血清。经分析验证,所制备的抗血清可用于SCSMV的检测,并有较高的特异性和灵敏度,对于SCSMV的检测与防治有着重要作用。
1 材料与方法
1.1 材料
pCa-SCSMV农杆菌菌株由扬州大学园艺与植物保护学院植物病毒实验室培育;原核表达载体pET28a以及大肠杆菌菌株DH5α、Rosetta均由本实验室保存;限制性内切酶 (NcoⅠ、SacⅠ)、反转录酶M-MLV、dNTPs、5×M-MLV Buffer、RNA酶抑制剂、载体等购自宝生物工程(大连)有限公司;PCR仪购自ProFlex公司;AxyPrep DNA凝胶回收试剂盒购自康宁生命科学(吴江)有限公司;2×High-Fidelity Master Mix 购自擎科生物技术有限公司;2×Taq Master Mix、分子量标准购自南京诺唯赞生物科技有限公司。
1.2 基因扩增及原核表达载体构建
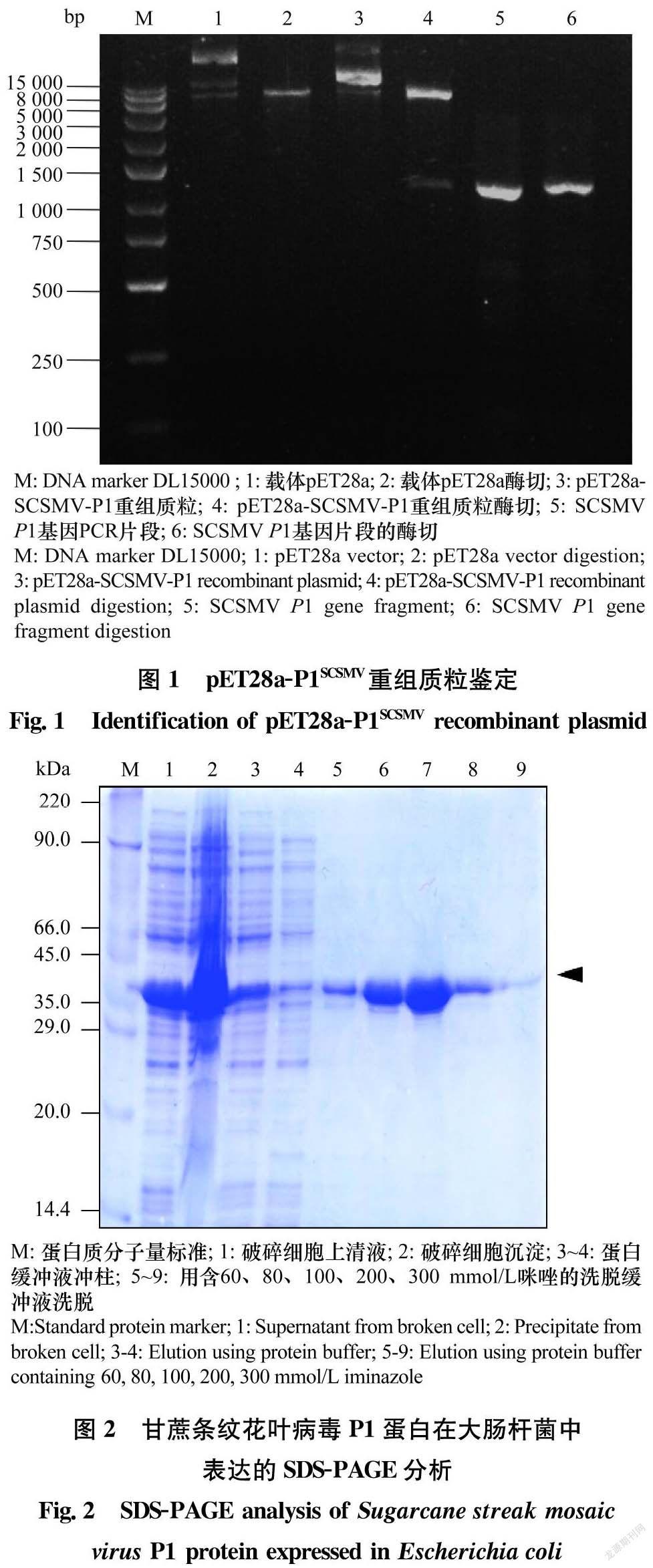
根据pCa-SCSMV的P1基因设计1对引物,利用上游引物P1SCSMV-F (5′-CATGCCATGGCTACTATCACTAAG-3′,下划线部分为NcoⅠ酶切位点)和下游引物P1SCSMV-R (5′-TCCGAGCTCGAATAAAA-TACTAAATCTTC-3′,下划线部分为SacⅠ酶切位点)扩增SCSMV P1基因(1 074 bp)。PCR产物经1%琼脂糖凝胶电泳分离后用凝胶回收试剂盒回收纯化目的条带,用NcoⅠ和SacⅠ双酶切,与同样用NcoⅠ和SacⅠ双酶切的原核表达载体pET28a在16℃金属浴中过夜连接。连接产物转化大肠杆菌Escherichia coli DH5α。通过菌落PCR验证,选取5个阳性克隆,送至生工生物工程(上海)股份有限公司进行测序,所得序列利用DNAMAN、BioEdit和BLASTN等软件进行序列比对和分析,从中选择测序结果正确的克隆进行后续的研究,并将其命名为pET28a-P1SCSMV。
1.3 重组蛋白的表达和SDS-PAGE分析
将pET28a-P1SCSMV转化大肠杆菌Rosetta。挑取单菌落于5 mL含100 μg/mL卡那霉素的LB液体培养基中,37℃,180 r/min活化过夜,翌日将活化的菌液按1∶100接种于50 mL含100 μg/mL卡那霉素的LB中,37℃,200 r/min振荡培养1.5 h (OD600为0.4~1),各取2 mL菌液,加入终浓度为1 mmol/L IPTG分别在28℃和37℃诱导表达4~6 h,以不加IPTG作为对照。取2 mL诱导产物离心收集菌体,加入200 μL蛋白悬浮缓冲液 (pH 6.8),振荡混匀,吸取20 μL蛋白样品并加入等体积的2×SDS上样缓冲液,在沸水中煮10 min,冰浴5 min,12 000 r/min离心20 min,取8 μL上清液进行SDS-PAGE电泳。电泳结束后,通过考马斯亮蓝R-250染色,分析融合蛋白的表達情况。
1.4 重组蛋白的可溶性分析
通过离心收集诱导表达4~6 h的菌体,利用双蒸水重悬菌体,加入蛋白酶抑制剂PMSF至终浓度为1 mmol/L,采用超声波破碎菌体细胞后,分别收集离心20 min后的上清和沉淀,将沉淀重悬后进行SDS-PAGE电泳,对融合蛋白进行可溶性分析,观察目的蛋白在上清和沉淀中的相对含量。
1.5 可溶性蛋白的Ni柱纯化
将诱导表达的目的蛋白扩大培养至1 L,按照上述方法诱导表达4~6 h,1 000 r/min,离心5 min,收集菌体,用25 mL pH 6.8的蛋白悬浮缓冲液悬浮细胞,将悬浮液转移至烧杯并加入1%的蛋白酶抑制剂,超声波破碎至菌液透亮,悬浮液转移到离心管中,4℃,12 000 r/min,离心30 min以上;取上清液,加入1% PMSF过0.5 μm滤膜并通过Ni2+-NTA亲和层析柱进行纯化,随后加入蛋白缓冲液冲洗柱子5次,冲洗结束后,用pH 6.8的蛋白缓冲液(分别含60、80、100、200、300、400 mmol/L的咪唑洗脱缓冲液)各洗脱5次,分别收集洗脱液,置于冰上。
1.6 抗血清制備
纯化的重组蛋白与等体积的弗氏不完全佐剂混匀,通过皮下多点注射抗原的方法免疫新西兰大白兔,抗原总注射量为2.0 mg,每次注射0.5 mg,共免疫3次,每次免疫间隔时间为7~10 d,免疫结束后,在新西兰大白兔耳缘静脉抽取0.5~1 mL的兔血,37℃静置1 h,4℃静置过夜,分离抗血清。血清中加入0.02%的叠碳化钠于-80℃保存。
1.7 抗血清特异性检测
利用Western blot检测抗血清的特异性和灵敏程度。将诱导表达后的菌体进行SDS-PAGE凝胶电泳。电泳结束后,用双蒸水洗脱凝胶,随后通过电转移的方法将蛋白质转移至硝酸纤维素膜上 (200 mA,100 min);电转结束后,取出硝酸纤维素膜放至1×TBST (20 mmol/L Tris-HCl,pH 7.5或8.0,150 mmol/L NaCl, 0.1% Tween-20)缓冲液中洗脱,随即转入10 mL封闭液(TBST+ 5% 脱脂奶粉)中,37℃封闭反应1 h或者4℃封闭过夜;封闭完成后直接在封闭液中加入1∶2 000的特异性抗血清,37℃一抗反应至少1 h,一抗反应结束后将硝酸纤维素膜放至1×TBST缓冲液中洗脱3次,每次10 min;洗脱结束,将硝酸纤维素膜加入用TBST稀释 (1∶5 000)的AP-IgG二抗,37℃反应45 min;再用1×TBST洗脱3次,每次10 min;在避光条件下,将硝酸纤维素膜放至含有NBT(330 μg/mL)和BCIP (165 μg/mL)的碱性磷酸酯酶缓冲液中显色至条带清晰,取出硝酸纤维素膜并用双蒸水漂洗3次,终止显色反应。将晾干的膜进行扫描分析。
将所制得的抗血清进行梯度稀释 (1∶1 000,1∶5 000, 1∶10 000, 1∶20 000),与病叶汁液进行免疫抗原反应,Western blot检测分析抗血清的特异性和灵敏度。
2 结果与分析
2.1 原核表达载体的构建
经过菌落PCR、双酶切 (图1)以及测序验证,重组表达质粒pET28a-P1SCSMV构建成功。
2.2 SCSMV P1的诱导表达和SDS-PAGE分析
pET28a-P1SCSMV转化的大肠杆菌DH5α经过1 mmol/L的IPTG进行蛋白的诱导表达,SDS-PAGE电泳检测到42 kDa的蛋白条带,与所预期的大小一致(图2),表明pET28a-P1SCSMV在大肠杆菌中正确表达。剩余菌体通过超声波细胞破碎仪破碎细胞,分别取上清和沉淀进行SDS-PAGE电泳,结果显示融合蛋白主要是以可溶蛋白的形式存在。
2.3 抗血清特异性及样品鉴定
RT-PCR检测结果显示,采集的7个样品中除1号和5号样品外,其余5个样品均为阳性。表明2、3、4、6号和7号样品被SCSMV所侵染。Western blot分析结果显示,抗血清与SCSMV侵染的5个甘蔗叶片提取液有特异性免疫反应,而与健康甘蔗叶片1号和5号提取液无反应,这一结果与RT-PCR分析结果一致,证实了制备的SCSMV P1抗血清可用于该病毒的检测且抗体有非常好的特异性,能够应用于植物样品的检测。
2.4 抗血清灵敏度鉴定
通过Western blot对SCSMV侵染后的病汁液进行检测,发现当抗血清稀释到1∶20 000时仍然能够特异地检测到目的蛋白 (图4),说明制备的抗血清具有较高的灵敏度。
3 讨论
血清学方法作为一种重要的植物病毒检测技术手段是不可或缺的[13]。目前,利用提纯的病毒来作为抗原直接免疫动物获得抗血清是抗血清制备中相对主流的一种方法[14]。植物病毒检测过程中易出现假阳性是因为抗血清中常常会含有寄主蛋白的抗体[15]。因此,本研究通过原核表达SCSMV P1重组蛋白,利用纯化的蛋白作为抗原免疫新西兰大白兔获得特异性高的P1抗血清。先前我们已经构建出SCSMV CP蛋白的抗血清[16],此前研究报道表明SCSMV CP蛋白与同样引起甘蔗花叶病的甘蔗花叶病毒Sugarcane mosaic virus (SCMV)和高粱花叶病毒 Sorghum mosaic virus (SrMV)的CP蛋白存在血清学交叉反应[17]。因此,为了适应SCSMV遗传进化过程以及避免CP蛋白血清学交叉反应影响SCSMV检出效率,建立SCSMV P1特异性抗血清检测方法对甘蔗线条花叶病毒的检测进行补充和完备显得格外重要。本试验所获得的P1抗血清特异性强,能够高效特异的检测SCSMV的发生,适用于田间生产上的检测,为病毒的防治与研究提供了较为方便的条件。
参考文献
[1] BAGYALAKSHMI K, PARAMESWARI B, CHINNARAJA C, et al. Genetic variability and potential recombination events in the HC-Pro gene of Sugarcane streak mosaic virus [J]. Archives of Virology, 2012, 157(7): 13711375.
[2] GILLASPIE A G, MOCK R G, SMITH F F. Identification of Sugarcane mosaic virus and characterization of strains of virus from Pakistan, Iran, and Camaroon [J]. Proceedings-International Society of Sugar Cane Technology,1978, 16: 347355.
[3] LI Wenfeng, HE Zhen, LI Shifang, et al. Molecular characterization of a new strain of Sugarcane streak mosaic virus (SCSMV) [J]. Archives of Virology, 2011, 156(11): 21012104.
[4] XU Donglin, ZHOU Guohui, XIE Yujia, et al. Complete nucleotide sequence and taxonomy of Sugarcane streak mosaic virus, member of a novel genus in the family Potyviridae [J]. Virus Genes, 2010, 40(3): 432439.
[5] LIANG Shanshan, ALABI O J, DAMAJ M B, et al. Genomic variability and molecular evolution of Asian isolates of Sugarcane streak mosaic virus [J]. Archives of Virology, 2016, 161(6): 14931503.
[6] 冯小艳, 王文治, 沈林波, 等. 甘蔗线条花叶病毒研究进展[J]. 生物技术通报, 2017, 33(7): 2228.
[7] JAMES D, VARGA A, PALLAS V, et al. Strategies for simultaneous detection of multiple plant viruses [J]. Canadian Journal of Plant Pathology, 2006, 28(1):1629.
[8] SILVA F, LIMA J, NASCIMENTO A, et al. Biological and serological of an isolate of Squash mosaic virus and effects of mixed infection with a virus of the genus Potyvirus [J]. Revista Ciencia Agronomica, 2016, 47(1):153169.
[9] ZHANG Yu, GAO Yanling, HE Wanqin, et al. Monoclonal antibody-based serological detection of Potato virus M in potato plants and tubers [J]. Journal of Integrative Agriculture, 2020, 19(5): 12831291.
[10]GUO Liqian, WU Jiayu, CHEN Rui, et al. Monoclonal antibody-based serological detection of Rice stripe mosaic virus infection in rice plants or leafhoppers [J]. Virologica Sinica, 2020, 35(2): 227234.
[11]VALLI A, LPEZMOYA J J, GARCA J A. Recombination and gene duplication in the evolutionary diversification of P1 proteins in the family Potyviridae [J]. Journal of General Virology, 2007, 88(3): 10161028.
[12]TATINENI S, QU Feng, LI Ruhui, et al. Triticum mosaic poacevirus enlists P1 rather than HC-Pro to suppress RNA silencing-mediated host defense [J]. Virology, 2012, 433(1): 104115.
[13]陳春峰. 亚细胞定位维持甘蔗线条花叶病毒P1蛋白抑制子活性和致病性的作用机制[D]. 扬州: 扬州大学, 2019.
[14]袁小环, 李青. 血清学方法和分子生物学方法检测植物病毒研究进展[J].热带农业科学, 2001(6): 6368.
[15]王国鲁, 王德亚, 于成明, 等. 烟草丛顶病毒ORF1蛋白的多克隆抗体制备及应用[J]. 植物病理学报, 2016, 46(1): 6371.
[16]ZHANG Kun, CHEN Chunfeng, XU Hongmei, et al. Rapid and sensitive identification of the SCSMV-infected sugarcane based on immune-detections [J]. 植物病理学报, 2020, 50(4): 479488.
[17]VISWANATHAN R, KUMAR V G, KARUPPAIAH R, et al. Development of duplex-immunocapture (Duplex-IC) RT-PCR for the detection of Sugarcane streak mosaic virus and Sugarcane mosaic virus in sugarcane [J]. Sugar Tech, 2013, 15(4): 399405.
(责任编辑:杨明丽)
