牛肝菌碳水化合物活性酶基因和次生代谢物合成基因的预测和比较分析
2021-12-30田霄田云霞汪威薛治峰薛笑然龚禹瑞姬梦琳田青霖张树竹
田霄 田云霞 汪威 薛治峰 薛笑然 龚禹瑞 姬梦琳 田青霖 张树竹*
(1 昆明市农业科学研究院,云南 昆明 650000;2云南大学农学院资源植物研究院,云南 昆明 650000)
牛肝菌Boletus是担子菌亚门Basidiomycotina、层菌纲Hymenomycetes、伞菌目Agaricases、牛肝菌科Boletaceae、牛肝菌属Boletus真菌,在生态系统的物质和能量循环中扮演着重要角色,对维护生态平衡和保护生物多样性起着至关重要的作用[1]。牛肝菌少数有毒或有苦味,大多数可以食用,并富含人体所必需的氨基酸、维生素、微量元素和生物碱(如腺嘌呤、胆碱和腐胺)。牛肝菌还具有很高的药用价值,具有散热排毒、补血养气、追风散寒、放松筋骨等功效,对贫血、头昏等症状也有治疗作用。但只有极少数牛肝菌可以在实验室条件下成功培养,绝大多数都无法在人工环境中生长,因此,探究牛肝菌的环境适应性和营养品质的遗传基础,对牛肝菌的栽培和利用具有重要意义。
真菌的碳水化合物活性酶(carbonhydrateactive enzymes,CAZymes)组分及含量与其生活方式密切相关。不同家族的CAZymes可以催化不同类型的碳水化合物的合成与代谢,其中一些直接参与寄主植物细胞壁的降解[2]。真菌通过分泌细胞壁降解酶(cell wall degrading enzymes,CWDEs)分解植物细胞壁组分,从而获取生长和繁殖所需的营养物质[3],其中纤维素酶、半纤维素酶、果胶酶和木质素酶属于碳水化合物活性酶家族中的糖苷水解酶(GHs)、碳水化合物酯酶(CEs)、多糖裂解酶(PLs)和辅助活性(AAs)家族[4]。已有研究表明,真菌的CAZymes和CWDEs的种类和数量可以体现出真菌对于不同类型的植物生物量和生活方式的适应和偏好[5]。牛肝菌属于共生营养模式真菌,通过降解寄主中的木质纤维素获取主要碳源营养,其CWDEs以木质纤维素降解酶为主[6]。尽管牛肝菌的基因组已公布,但对其CAZymes和CWDEs基因数量和种类并未进行具体分析[7]。明确牛肝菌CAZymes和CWDEs的编码基因的数量和类型可以从基因组水平解释牛肝菌碳源环境适应性,进而为人工驯化和模拟自然环境栽培牛肝菌提供理论依据[8]。
真菌的次生代谢物主要由聚酮合成酶(polyketide synthase,PKS)、非核糖体多肽合成酶(nonribosomal peptide synthetase,NRPS)、氢化酶、氧化酶和转运蛋白等共同调控合成[9]。目前已知的真菌次生代谢物有苯丙素类、醌类、萜类、甾体、有机酸、生物碱等,具有食药用活性[10]。牛肝菌作为重要食药用真菌,已分离到的次生代谢产物有黄酮、多酚、甾体及萜类化合物等[11]。除了具有食药用活性,这些次生代谢物还可帮助食用菌响应环境变化,促进寄主植物快速生长,提高寄主植物的环境适应能力,在环境保护和生态修复方面也有着广阔的研究价值[12]。因此,挖掘牛肝菌基因组中蕴藏的次生代谢物合成的基因信息,可为研发具有潜在食药用价值的新活性化合物提供参考[13]。
1 材料与方法
1.1 牛肝菌的基因组数据获取和基因预测
研究所用的9种牛肝菌的基因组数据均从美国国立生物技术信息中心(National Center for Biotechnology Information,NCBI)数据库下载所得,具体基因组ID和组装信息见表1。所选9种牛肝菌已涵盖目前NCBI和美国能源部联合基因组研究中心(Joint Genomelnstitute,JGI)数据库中已公布的牛肝菌属基因组数据,且在我国滇黔桂地区皆有生长。利用GeneMark-ES软件对基因组序列进行基因预测,得到对应基因组gtf、cds和pep文件[14]。
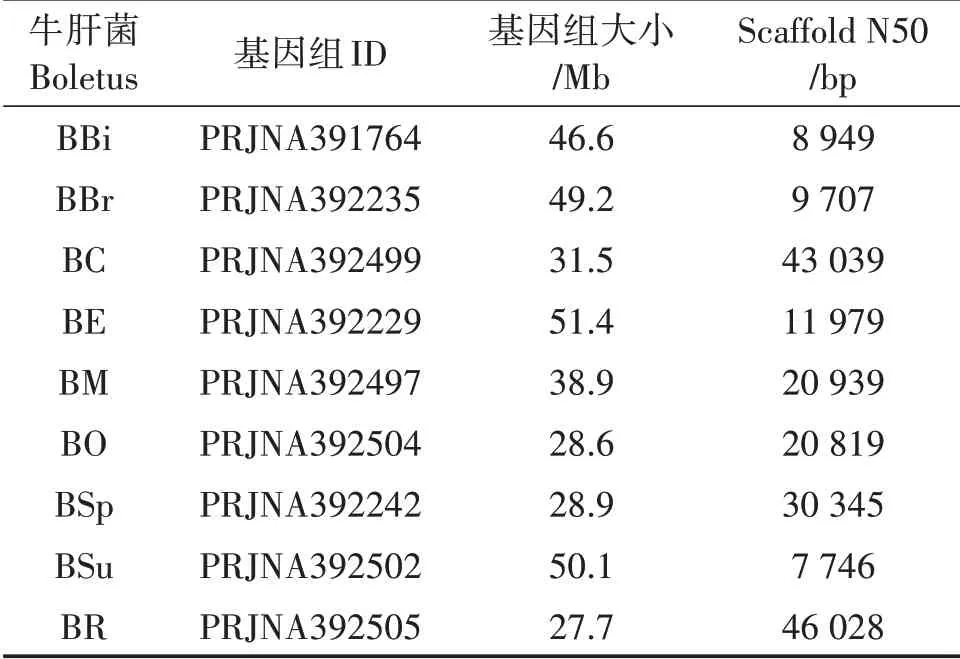
表1 9种牛肝菌基因组信息
1.2 生物信息学分析方法
1.2.1 CAZymes注释
利用碳水化合物活性酶Carbohydrate-Active enZYmes Database(CAZy)数据库对9种牛肝菌基因组进行CAZymes注释,BLAST比 对E value阈值为1e-5[15]。比对成功的基因根据CAZymes催化活性分属到糖苷水解酶(glycoside hydrolases,GHs)、碳水化合物酯酶(carbohydrate esterases,CEs)、多糖裂解酶(polysaccharide lyases,PLs)、糖基转移酶(glycosyl transferases,GTs)、辅 助 活 性(auxiliary activities,AAs)和碳水化合物结合域(carbohydrate-binding modules,CBMs)6个家族。
1.2.2 CWDEs分析
根据CAZymes based ranking of fungi(CBRF)网站[16]中对植物细胞壁降解酶的分类,并结合CAZymes家族和注释信息,对牛肝菌细胞壁降解酶进行统计和分析。
1.2.3 次生代谢产物合成基因的预测
利用微生物次级代谢物合成基因簇注释数据库antiSMASH 5.0(https://antismash-db.secondarymet abolites.org/)对9种牛肝菌次生代谢物合成基因簇进 行 注 释[17]。Cluster Blast、Known Cluster Blast、SubCluster Blast、Active Site Finder、TTA codon detection、TTA密码子检测、次级代谢物簇同源组预测和特定簇等注释采用默认比对参数。
2 结果与分析
2.1 牛肝菌CAZymes基因的注释与分析
通过CAZy数据库的注释得知,9种牛肝菌的CAZymes基因数量分别为296(BBi)、315(BBr)、302(BC)、347(BE)、327(BM)、314(BO)、327(BSp)、43(BSu)、302(BR),分别分类到GHs、CEs、GTs、AAs、CBMs、PLs家族中(图1)。9种牛肝菌根据CAZymes基因数量从高到低排序:BE>BM>BSp>BBr>BO>BR>BC>BBi>BSu。BE的CAZymes基因数量最多,其降解碳源能力最强,对不同碳源环境适应性最高,可能更容易被人工驯化,而BSu的CAZymes基因数量最少,其降解碳源能力最弱,对不同碳源环境适应性最差,可能较难被人工驯化。
9种牛肝菌CAZymes家族中,GHs和GTs家族基因数量最多,每种牛肝菌GHs家族基因数量分别占整个CAZymes基因数的37.46%~42.23%;GTs家族基因数量分别占整个CAZymes基因数的33.43%~44.19%;其次为CBMs家族,分别占整个CAZymes基因数的6.98%~16.71%;PLs家族基因数量最少,分别占整个CAZymes基因数的0%~0.34%(图1)。不同牛肝菌的CAZymes家族基因数量均存在较大差异,其中AAs和CBMs家族基因数量差异明显(图1),这可能是由于不同牛肝菌品种对生境碳源适应性差异造成的。
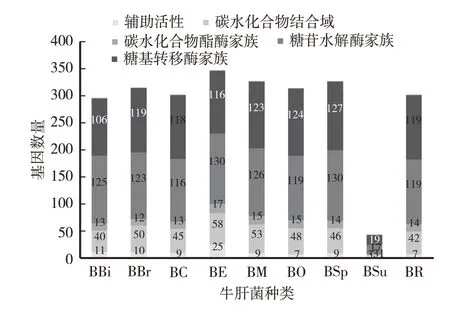
图1 牛肝菌的碳水化合物活性酶(CAZymes)家族的基因数量比较
2.2 牛肝菌细胞壁降解酶基因的预测
真菌分泌的CWDEs均属于CAZymes。根据降解底物和所属CAZymes家族,将9种牛肝菌CWDE基因分属于17种CWDEs,包括8个GH家族、1个CE家族、1个CBM家族、2个AA家族、1个GT家族(表2)。牛肝菌CWDEs主要为纤维素酶、半纤维素酶、果胶酶,并存在少量的木质素酶、淀粉酶、菊粉酶。其中,β-葡聚糖苷酶(β-glucosidase)和β-半乳糖苷酶(β-galactosidase)的基因数量最多,说明牛肝菌降解纤维素主要依靠β-葡聚糖苷酶,而降解果胶主要依靠β-半乳糖苷酶。推测牛肝菌主要以寄主细胞壁的纤维素和果胶作为主要碳源(图2)。
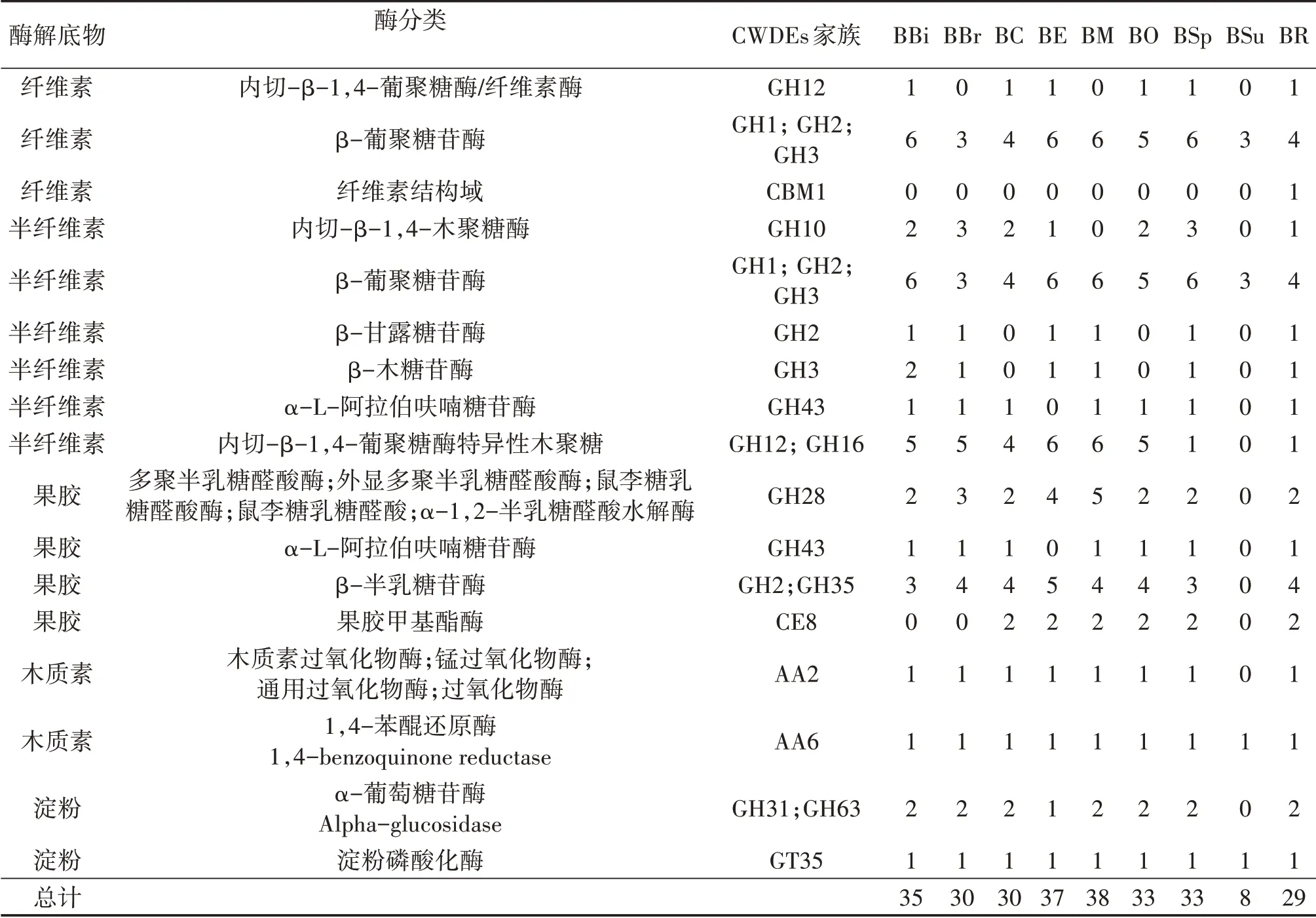
表2 牛肝菌细胞壁降解酶(CWDEs)的预测结果
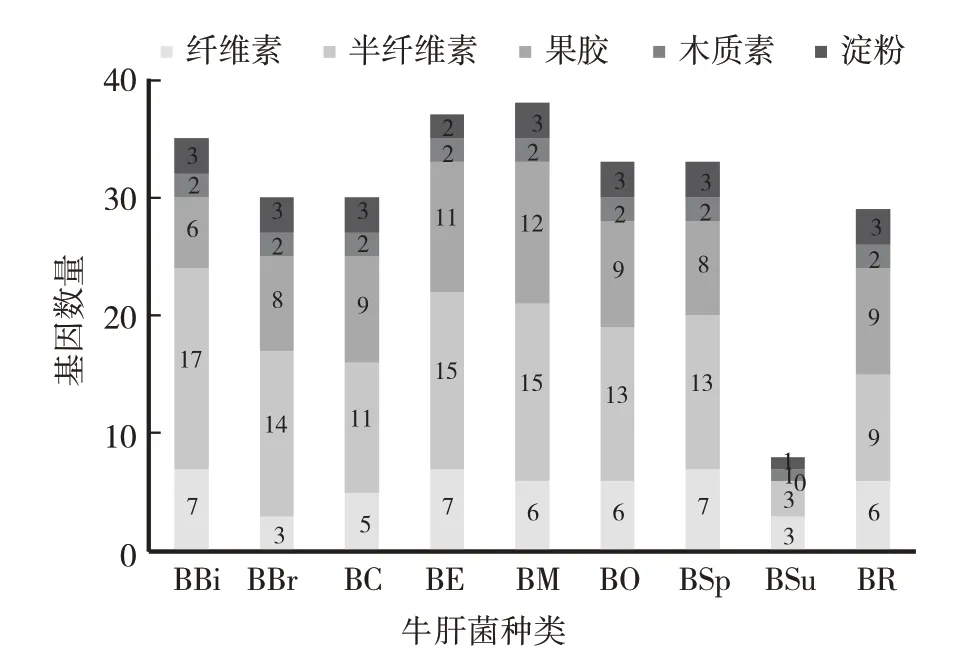
图2 牛肝菌的细胞壁降解酶(CWDEs)数量比较
9种牛肝菌中果胶酶、半纤维素酶和纤维素的基因数量存在明显差异(表2,图2)。BBi、BBr、BC、BE、BM、BO和BSp中CWDEs数量由高到低排序:半纤维素酶>纤维素酶>果胶酶;而BSu中CWDEs数量由高到低排序:纤维素酶>半纤维素酶>果胶酶,BR中CWDEs数量由高到低排序:半纤维素酶>果胶酶>纤维素酶(图2)。由此可以看出,不同牛肝菌对寄主细胞壁碳源类型具有不同偏好性,BBr、BC、BE、BM、BO、BSp和BSu倾向于与纤维素含量高的植物共生,而BR倾向于与半纤维素、果胶含量高的植物共生。另外,9种牛肝菌中木质素酶种类和数量基本一致,说明9种牛肝菌对木质素降解能力相近。
2.3 牛肝菌次生代谢物合成基因的注释和分析
通过antiSMASH数据库[18]注释,分别鉴定了9种牛肝菌的次生代谢物合成(secondary metabolismbiosynthesis,SMB)基因(表4,图3),分别为136(BBi)、187(BBr)、217(BC)、314(BE)、186(BM)、112(BO)、199(BSp)、151(BSu)、489(BR)(图3)。SMB基因类型包括了核心合成基因(表3)、转运蛋白和调控因子以及其他调控基因(图3),分别分类到6~11个次生代谢产物合成基因簇(Secondary metabolite gene clusters,SMC)(图3)。9种牛肝菌SMC类型分为萜类(Terpene)、非核糖体多肽合成酶(NRPS;NRPS-like)和I型聚酮类(T1PKS)(表4)。萜类和非核糖体多肽合成酶类化合物、9种牛肝菌中除了BM和BO,其他7种牛肝菌均能合成I型聚酮类化合物。

表3 9种牛肝菌的次生代谢物核心合成基因注释信息
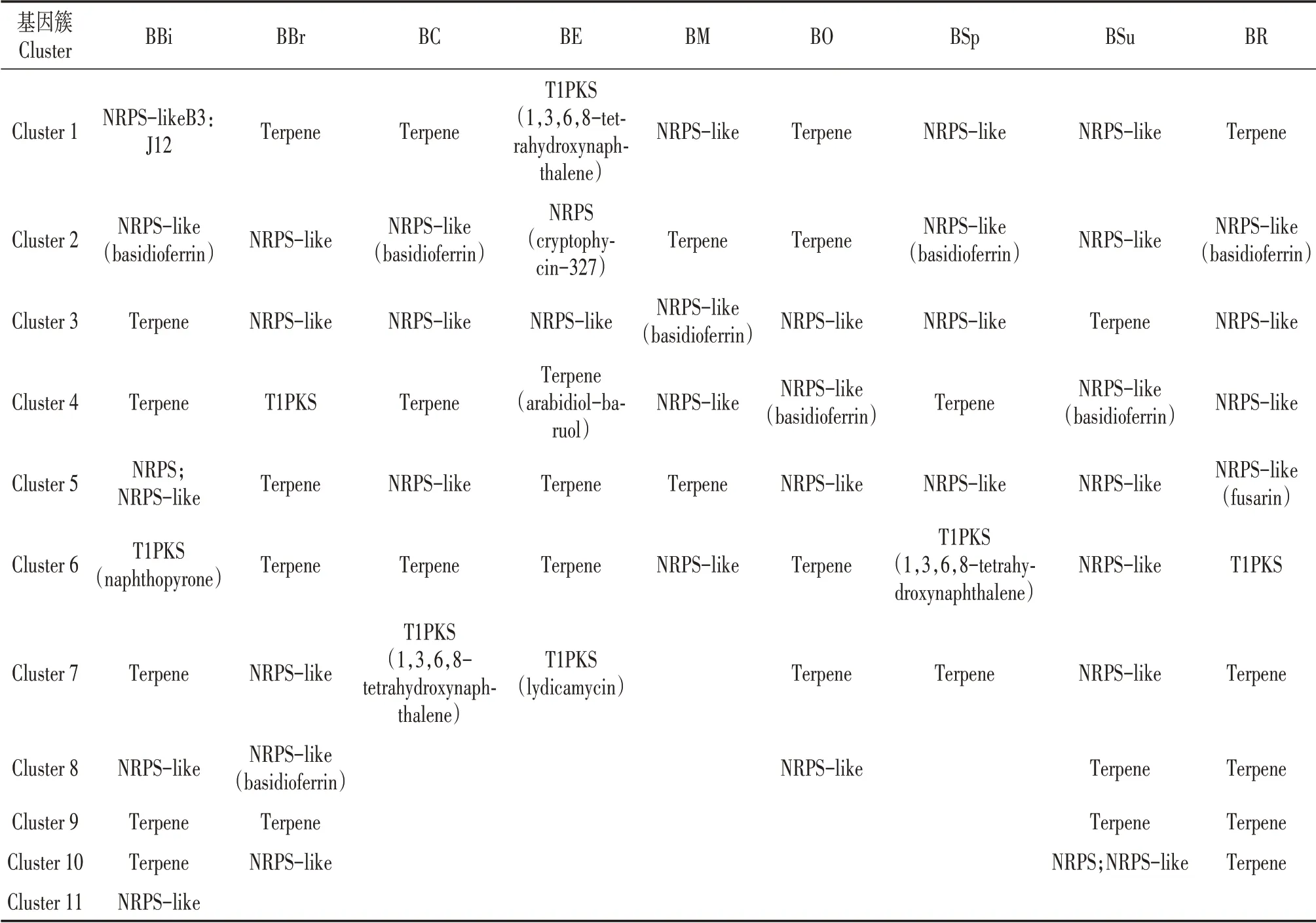
表4 9种牛肝菌的次生代谢物合成基因簇类型预测结果

图3 牛肝菌的次生代谢物合成基因数量
9种牛肝菌的SMB和SMC数量及类型均存在明显差异。BBi、BR、BBr和BSu的SMC合成次生代谢物种类较多(表4),说明这4种牛肝菌有更多种类的生物活性物质。BR的SMB基因数量最多(图3),说明其次生代谢物合成机制最为复杂。根据鉴定出的类似次生代谢物发现,除了BE,其他8种牛肝菌均能合成Basidioferrin;BC、BE和BSp均合成1,3,6,8-tetrahydroxynaphthalene;BBi能够合成萘并吡喃酮(Naphthopyrone);BE能够合成Cryptophycin、拟南芥比醇(Arabidiol)和利迪卡霉素(Lydicamycin);BR还能合成镰刀菌素(Fusarin)。说明9种牛肝菌可能具有各自特有的生物活性物质(表3)。
3 小结与讨论
牛肝菌是全球著名的野生食用菌之一,随着人们社会经济发展、生活水平的提高,牛肝菌的食药用价值及生态效益越发受到重视[19]。目前尽管已有人工栽培的牛肝菌,但尚不能满足庞大的消费市场,并且由于牛肝菌天然产物的产量低,药用研发和应用的经济成本极高。多种牛肝菌基因组的公布,将为牛肝菌有益资源的利用提供一个新的途径[7]。
牛肝菌种类多样,不同的生态环境中生长的牛肝菌基因组遗传变异较大[20]。研究根据CAZymes家族分类信息,补充了9种牛肝菌基因组CAZymes家族基因和CWDEs种类等信息,结果表明,牛肝菌的GTs、GHs、CBMs基因数量较多;CWDEs主要为纤维素酶、半纤维素酶、果胶酶,其中多聚半乳糖醛酸酶和β-1,4-葡聚糖酶基因数量较多。9种牛肝菌的CAZymes、CWDEs基因数量存在一定差异,与牛肝菌的生长方式及营养偏好性密切相关,说明不同牛肝菌品种对培养基质的要求可能存在明显差异,因而在牛肝菌驯化试验中,需要根据寄主植物细胞壁成分的差别来调整基质添加物的成分及配比。已公布的其他食用菌基因组比较研究结果表明,因寄生环境的差异,其分泌的CAZymes、CWDEs含量和种类不同[2,20-21]。若食用菌倾向于寄生富含果胶的植物组织,其基因组中果胶酶和半纤维素酶基因较多,而纤维素酶基因较少;食用菌倾向于寄生木质或禾本科植物(寄主细胞壁果胶含量少),其基因组中纤维素酶和半纤维素酶基因较多,而果胶酶基因数量较少[22]。研究表明,根据不同食用菌生长所需的碳源、氮源及微量元素,在栽培基质中添加相应的成分,可提高其菌丝体产量[23]。在哈根培养基中加入蜀葵浸出液,可培养出白牛肝菌(Boletus griseusForst)子实体[24];在果胶精氨酸培养基中加入特殊诱导物(环3’-5’-AMP和茶碱),也能够培育出白牛肝菌子实体[25]。因此,栽培BR的培养基应富含半纤维素和果胶的植物组织,而BBr、BC、BE、BM、BO、BSp、BSu须选用木质纤维素含量高的植物材料作为基质的辅助成分。
次生代谢物是食用菌在长期进化中与生态环境相互作用的产物,其与食用菌食药用价值密切相关。研究发现,牛肝菌次生代谢物质具有防癌、止咳、补气,清热解烦、养血和中等功效,对高血压、高胆固醇和高血脂等疾病有良好的调理功效[11]。真菌次生代谢产物的数量、种类与其合成的相关基因(基因簇)数量和类型显著正相关[13]。研究对牛肝菌SMB和SMC进行了注释,发现9种牛肝菌SMC种类为萜类、非核糖体肽合成酶类和I型聚酮类化合物。大型真菌中分离的单萜、倍半萜、二萜和三萜类化合物具有抗肿瘤、抗菌、抗炎、抗氧化、降血糖等药理活性[26]。聚酮类化合物具有抗氧化、抗肿瘤、免疫抑制、抗菌活性、抗炎症和抗寄生虫等生物活性[27]。非核糖体肽合成酶合成的非核糖体肽是抗生素、免疫抑制剂的重要化合物来源,具有抗菌、杀虫,降低胆固醇和抗癌等活性[28]。
9种牛肝菌的SMB基因数量、SMC数量及类型均存在明显差异,说明9种牛肝菌可能具有各自特有的生物活性物质。通过相似化合物对比发现,除了BE,其他8种牛肝菌均能合成抗病毒和抗癌的Basidioferrin[29]。BC、BE、BSp均合成1,3,6,8-tetrahydroxynaphthalene。该酶在色素合成和提高菌株抗病力方面具有重要作用[30]。BBi能够合成具有抗癌活性的萘并吡喃酮(Naphthopyrone)。萘并吡喃酮在丝状子囊菌中还具有抵御昆虫侵袭的作用[31-32]。
BE能够合成Cryptophycin、拟南芥比醇(Arabidiol)和利迪卡霉素(Lydicamycin)。Cryptophycin属于一种强效抗癌剂[33];Arabidiol是一种三萜类化合物,可使拟南芥根据自身目的塑造和调整根内和根周围的微生物群落[34],利迪卡霉素(Lydicamycin)是一种新型抗生素,对革兰氏阳性细菌具有良好抑制效果[35]。可见,BE的次生代谢产物不仅具有药用活性,还具有潜在工业利用价值。
BR能够合成植物毒素镰刀菌素(Fusarin)。该毒素属于非特异性的聚酮类植物毒素,能够破坏植物细胞的代谢机能,还对哺乳动物具有致癌性[36]。因此BR可能对人体具有潜在的毒性影响,在进行其次生代谢活性成分发酵时,需优化相关发酵条件,保证BR的食品安全性。
目前牛肝菌已分离到的次生代谢产物还有黄酮、多酚、甾体等[11],但对这些代谢产物的生物合成途径及机制的研究较少,未能与研究中未知功能的SMC及合成次生代谢物质相匹配。深入研究牛肝菌SMB和次生代谢产物的合成途径及机制,有助于进行牛肝菌活性物质的药理分析和体外合成研究,对牛肝菌天然产物的应用具有重要推动作用[37]。
