蛹虫草液体菌种发酵工艺条件优化
2021-12-30张疏雨于婷婷郝捷李剑梅谢存一柴林山朱万琴马征远
张疏雨 于婷婷 郝捷* 李剑梅 谢存一 柴林山 朱万琴 马征远
(1 辽宁省微生物科学研究院,辽宁 朝阳 122000;2 内蒙古昆明卷烟有限责任公司,内蒙古 呼和浩特 010000)
蛹虫草作为虫草属模式种,在1727年巴黎科学院院士会上,以属种名Cordyceps militarys发表[1]。根据Sung的分类系统(2007),蛹虫草隶属于真菌界Fungi、子囊菌亚门Ascomycotina、子囊菌纲Ascomycetes、粪壳菌亚纲Sordariomy、肉座菌目Hypocreales、艳虫草菌科Cordycipitaceae、狭义虫草属Cordyceps[2]。蛹虫草中的主要活性物质有虫草素、虫草酸、多糖等[3],具有抗肿瘤[4]、抗病毒[5]、抗疲劳[6]、抗菌消炎[7]、提高免疫力[8]、调节肠道微生物菌群、降血糖等功效[9]。培养基组成成分为影响蛹虫草发酵培养主要因素,接种量、摇床转速、摇瓶装液量、发酵周期和摇瓶时间等,对其菌丝体的繁殖和代谢产物的累积有直接影响。为此笔者进行接种量、摇床转速、摇瓶装液量、发酵周期等蛹虫草发酵相关条件试验,以期确定蛹虫草液体菌种培养条件,为实现规模化人工栽培蛹虫草提供技术支撑。
1 材料与方法
1.1 供试菌株及培养基
蛹虫草CMC33、L1-2和AoJ1-7菌株,均由辽宁省微生物科学研究院药用蕈菌研究室提供。供试培养基有①PDA培养基:马铃薯200 g,葡萄糖20 g,蛋 白 胨10 g,KH2PO43 g,MgSO41.5 g,维 生 素B110 mg,琼脂15 g,pH自然,水1 000 mL;②液体培养基:马铃薯200 g,葡萄糖20 g,蛋白胨10 g,KH2PO43 g,MgSO41.5 g,维生素B110 mg,pH自然,水1 000 mL;③加入培养基的营养液:MgSO41.0 g,KH2PO42.0 g,维生素B15 mg,配制成1 000 mL溶液,备用;④麦粒培养基:650 mL罐头瓶每瓶装小麦35 g,按照1∶1.7的比例添加营养液,用聚乙烯膜包裹瓶口,再用橡皮筋扎紧,于121℃下灭菌1 h,冷却,备用。
1.2 试剂及仪器设备
1.2.1 试剂
标准对照品:虫草素(北京索莱宝生物科技有限公司,纯度≥98%)。试剂:色谱乙腈、色谱甲醇、去离子水、乙醇、葡萄糖、蛋白胨、硫酸镁、磷酸二氢钾、维生素B1、玉米粉、甘氨酸等(北京化工厂有限公司,分析纯)。
1.2.2 主要仪器设备
HFsafe-1200生物安全柜(上海力申科学仪器有限公司),SPH-2102立式双层大容量恒温培养摇床(上海世平实验设备有限公司),BCD-649 WADV冰箱(青岛海尔股份有限公司),SPX-450生化培养箱[中仪国科(北京)科技有限公司],LDZX-75KBS立式高压蒸汽灭菌器(上海申安医疗器械厂),Waters2695型高效液相色谱仪(美国Waters公司),Waters2489型二极管阵列检测器(美国Waters公司),色谱柱Luna 5u C18(2)100A(250 mm×4.6 mm)(美国安捷伦科技有限公司),KQ-50DA型数控超声波清洗器(昆山市超声仪器有限公司)。
1.3 试验方法
1.3.1 蛹虫草菌丝体中虫草素含量测定
依据农业部(现农业农村部)标准NY/T 2116—2012测定菌丝体中虫草素含量。
①标准溶液的配制:称取虫草素标准品10 mg,去离子水溶解,用流动相定容至100 mL摇匀,配制成100 μg/mL虫草标准品储备液,4℃储存,备用。
②色谱条件:柱温35℃;流动相,5%乙腈,95%水;流速1.0 mL/min;检测时长20 min;紫外检测波长260 nm;进样量10 μL。
③制作标准曲线:准确吸取配置好的虫草素标准品母液0.25 mL、0.5 mL、1.25 mL、2.5 mL、5 mL、12.5 mL于25 mL容量瓶中,用去离子水定容,摇匀,得到1.00 μg/mL、2.00 μg/mL、5.00 μg/mL、10.00 μg/mL、20.00 μg/mL、50.0 μg/mL的溶液,0.22 μm微孔滤膜过滤。每个体积浓度的标准品溶液重复进样3次,得到相应峰面积,计算平均值。以虫草素体积浓度为横坐标,相应的峰面积为纵坐标,制作标准曲线,计算线性回归方程。
④样品虫草素含量测定:采用超声波提取法。称取待测菌丝体粉末1.0 g,置于25 mL容量瓶中,加入去离子水20 mL,置于超声波仪中提取3 h,取出后用去离子水定容,摇匀,过0.22 μm微孔滤膜,滤液用高效液相色谱法分析。
1.3.2 菌丝生物量测定
培养液经3层纱布过滤去上清液,收集用清水淋洗后的菌丝体,置于55℃热风循环烘箱中干燥至恒重,在干燥器中冷却到常温,称重(g),计算单位培养液中菌丝生物量:
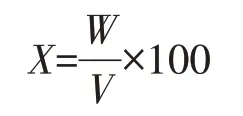
式中:X为单位培养液中菌丝生物量,g/L;W为菌丝干重,g;V为取样体积,mL。
1.3.3 菌种活化及培养
将蛹虫草CMC33(F1)菌株无菌接种于PDA斜面培养基上,于18℃避光培养7 d,获得F2代菌株。平板培养基中接入F2代菌株,(18±1)℃条件下黑暗培养至菌丝长满平板。制备摇瓶培养基:按200 mL/500 mL分装,灭菌冷却后每瓶接种直径为6 mm的菌饼3块,在培养温度18℃、摇床转速140 r/min条件下培养6 d,得到蛹虫草初始液体菌种。
1.3.4 液体发酵条件单因素试验
1.3.4.1 摇床转速试验
液体菌种接种量为4%,装液量为200 mL/500 mL,设置摇床转速为100 r/min、120 r/min、140 r/min、160 r/min、180 r/min,18℃恒温避光培养6 d,每个处理重复3次。发酵结束后,按照1.3.2方法收集菌丝体,烘干称重。计算单位培养液中菌丝生物量,测定虫草素含量。
1.3.4.2 接种量试验
在优化的摇床转速条件下,试验液体菌种接种量分别为1%、2%、4%、6%、8%、10%,装液量为200 mL/500 mL,18℃恒温避光培养6 d,每个处理重复3次。发酵结束后,按照1.3.2方法收集菌丝体,烘干称重,计算单位培养液中菌丝生物量,测定虫草素含量。
1.3.4.3 摇瓶装液量试验
在优化的接种量及摇床转速条件下,将500 mL摇瓶装液量设为80 mL、100 mL、120 mL、140 mL、160 mL、180 mL、200 mL,18℃恒温避光培养6 d,每个处理重复3次。发酵结束后,按照1.3.2方法收集菌丝体,烘干称重。计算单位(L)培养液中菌丝生物量,测定虫草素含量。
1.3.4.4 液体菌种最佳发酵周期试验
在优化的接种量、摇床转速、摇瓶装液量条件下,设液体培养时间分别为24 h、36 h、48 h、60 h、72 h、84 h、96 h、108 h、120 h,每个处理重复3次。观察菌丝长势,收集菌丝体,烘干称重。计算单位(L)培养液中菌丝生物量,测定虫草素含量。
1.3.5 栽培验证试验
将供试菌种CMC33、Y6~1、L1-2和AoJ1-7按照优化工艺条件培养液体菌种,并进行室内栽培验证试验。测定蛹虫草子实体生物性状。计算生物转化率,测定虫草素含量。每个菌株重复3次。
2 结果与分析
2.1 虫草素标准曲线
由图1、图2可知,在试验条件下,虫草素在12 min左右出现峰面积,0.01~50.00 mg/mL样品与峰面积呈良好的线性关系,虫草素的标准曲线方程为y=33 477x+13 493(R2=0.999 9)。由图2可知,所获得的菌丝体与虫草素标准对照品在相同的时间出现虫草素的特征吸收峰。
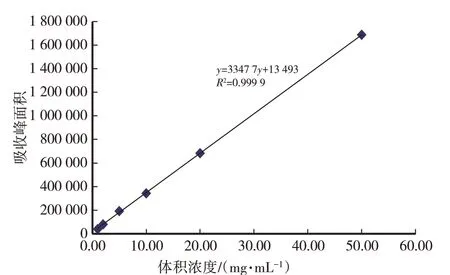
图1 虫草素标准曲线

图2 虫草素标准品及供试样品HPLC图
2.2 单因素试验结果
2.2.1 摇床转速试验结果
用摇瓶进行发酵培养时,摇床转速的快慢间接影响着发酵液中氧气溶解量。由表1、图3、图4可知,随着摇床转速的加快,菌丝生物量(干重,下同)呈先升高后降低的趋势:当转速从100 r/min上升到120 r/min时,菌丝生物量升幅不大;当转速从120 r/min上升到140 r/min时,菌丝生物量升幅较大;当转速从140 r/min上升到180 r/min时,菌丝生物量下降。摇床转速为140 r/min时,菌丝生物量、虫草素含量达最大值,因此选择140 r/min为最适宜摇床转速。
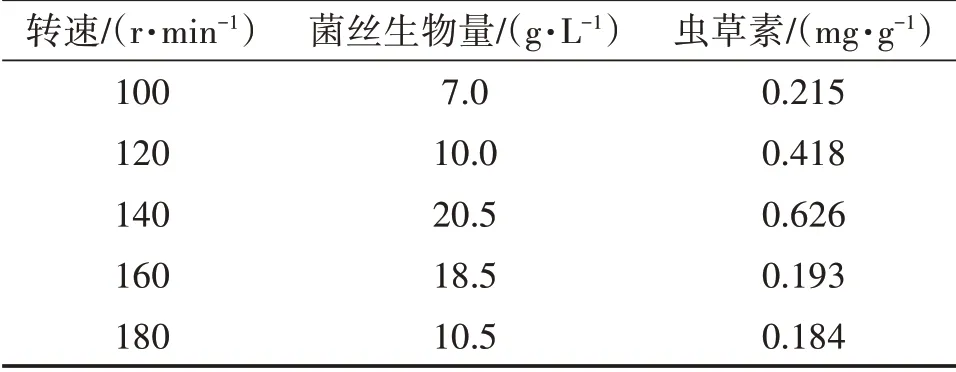
表1 摇床转速对发酵效果的影响
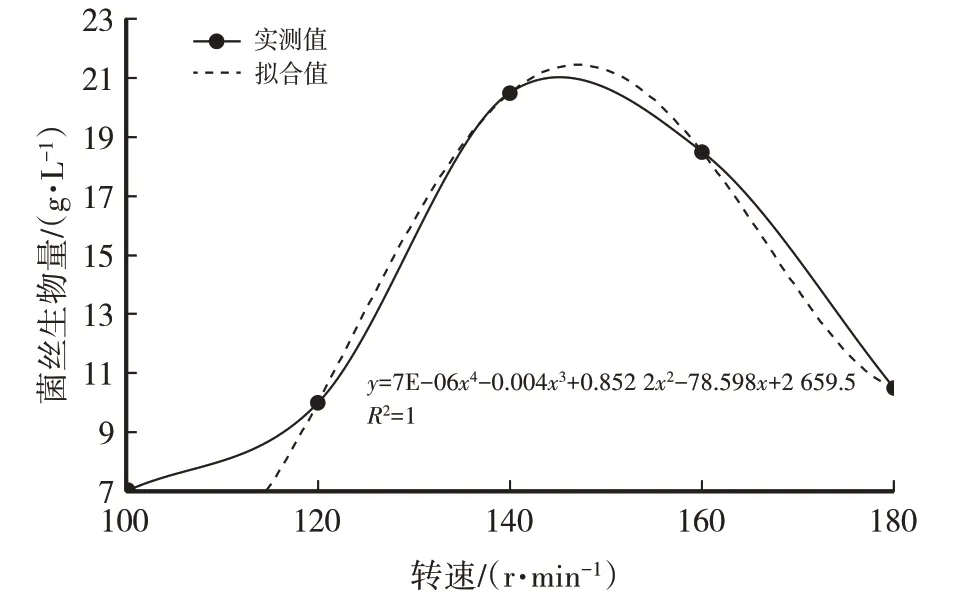
图3 摇床转速对菌丝生物量(干)影响
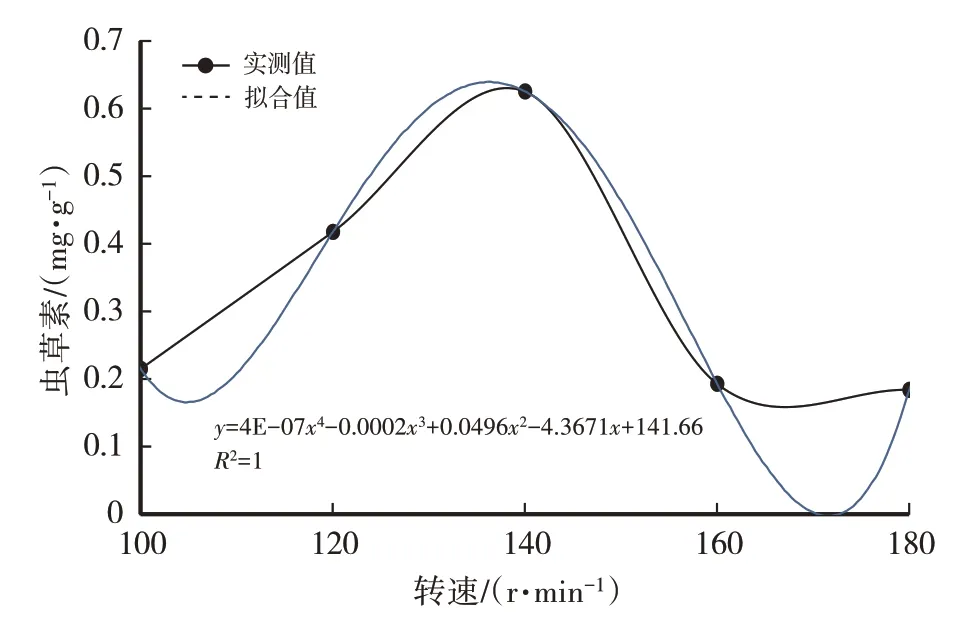
图4 摇床转速对虫草素含量的影响
经计算得菌丝生物量(y)与摇床转速(x)之间的函数关系式:y=7E-06x4-0.004x3+0.852 2x2-78.598x+2 659.5,R2=1(1),模型拟合较好。虫草素含量(y)与摇床转速(x)之间的函数关系式:y=4E-07x4-0.000 2x3+0.049 6x2-4.367 1x+141.66,R2=1,模型拟合较好。
2.2.2 接种量试验结果
由表2和图5、图6可知,菌丝生物量随接种量的增加呈先升高后降低的趋势。其原因可能是菌种在有限的营养条件下,适宜的接种量可使菌丝体生长旺盛,各营养物质的代谢与转化主要为菌丝体生长提供营养。随后,培养基的营养成分几乎完全被利用,菌丝体达最大生长限度,开始产生或外溢一些代谢副产物和中间体,其蛋白水解酶的活力逐渐升高,并出现菌丝体自溶现象,菌丝生物量降低。当接种量为8%时,菌丝生物量达最高值(22 g/L),因此选择适宜接种量为8%。

表2 接种量对发酵效果的影响
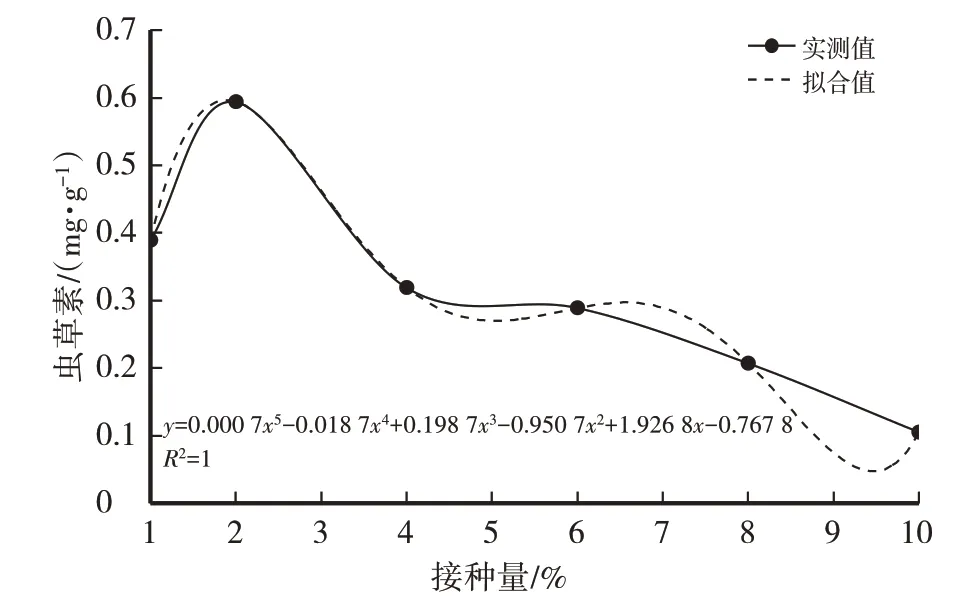
图6 接种量对虫草素含量的影响
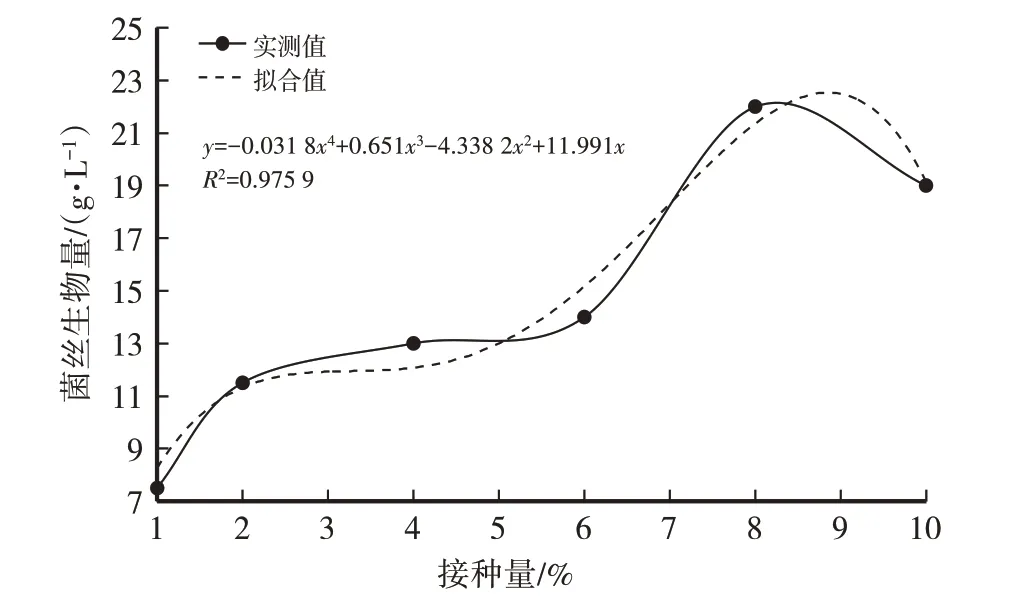
图5 接种量对菌丝生物量(干)影响
经计算得菌丝干重(y)与接种量(x)之间的函数关系式:y=-0.031 8x4+0.651x3-4.338 2x2+11.991x,R2=0.975 9(3),模型拟合较好。虫草素含量(y)与接种量(x)之间的函数关系式:y=0.000 7x5-0.018 7x4+0.198 7x3-0.950 7x2+1.926 8x-0.767 8,R2=1,模型拟合较好。
2.2.3 摇瓶装液量试验结果
装液量的多少决定了摇瓶中的通气量,从而影响菌丝体生长所需氧气的供给和发酵过程中废气的排放,摇瓶内培养基装液量过多或过少,都不利于蛹虫草菌丝体的富集培养,影响发酵结果。由表3、图7、图8可知,菌丝生物量随摇瓶装液量的增加而增加,当装液量为180 mL或200 mL时菌丝生物量相差不大,结合虫草素含量,选择装液量200 mL为最适装液量。
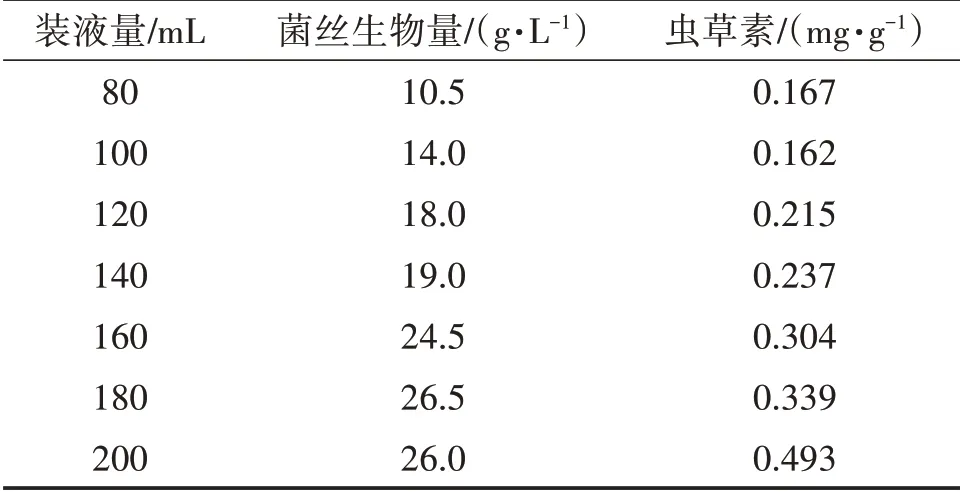
表3 装液量对发酵效果的影响
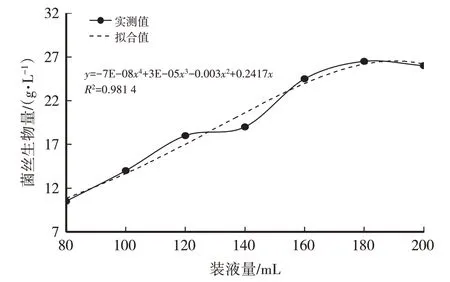
图7 装液量对菌丝生物量(干)影响
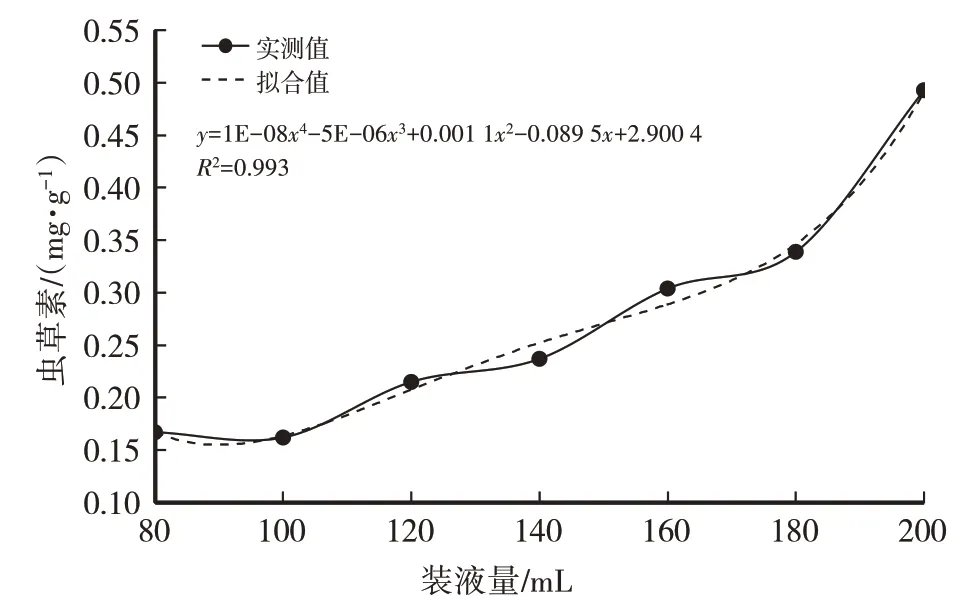
图8 装液量对虫草素含量的影响
经计算得菌丝干重(y)与装液量(x)之间的函数关系式:y=-7E-08x4+3E-05x3-0.003x2+0.241 7x,R2=0.981 4,模型拟合较好。虫草素含量(y)与装液量(x)之间的函数关系式:y=1E-08x4-5E-06x3+0.001 1x2-0.089 5x+2.900 4,R2=0.993,模 型 拟 合较好。
2.2.4 最佳发酵周期试验结果
由表4、图9、图10、图11可知,蛹虫草菌丝的生物量近似“S”形曲线。蛹虫草菌种发酵18 h开始萌发,24 h新生菌丝明显增多,发酵前48 h之内为菌丝适应期,生长缓慢,显微镜下菌丝尖端钝圆、无色、有隔,菌丝较少,长势粗壮旺盛。发酵48 h后菌丝进入对数生长期,菌丝量急剧增加,且相互缠绕形成菌球,显微镜下菌丝生长旺盛、多分枝。发酵72 h开始形成液态孢子,此时虫草素含量(0.628 mg/g)最高。发酵84~96 h时菌丝生物量最高,为15 g/L,此时液体菌种呈淡黄、均一的溶液,菌丝生长进入平台期,菌丝生物量趋于平稳,形成大量的液体孢子。发酵96 h后菌丝逐渐老化开始自溶,形成丰富的液体孢子,菌丝细胞内成分流失,菌丝生物量及虫草素含量逐渐下降。综合考虑,选择发酵时间为84~96 h为最适发酵周期。
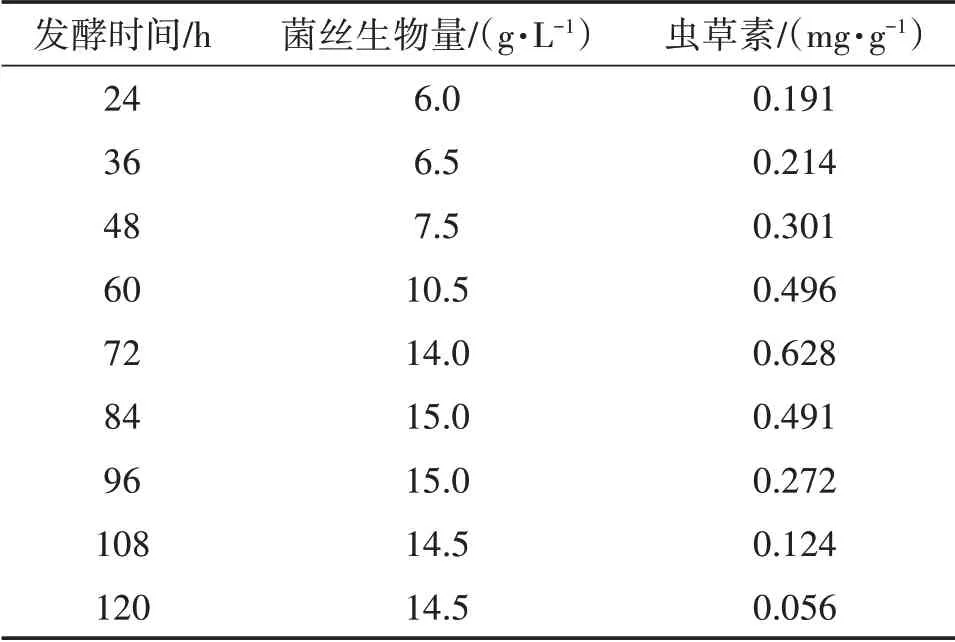
表4 不同发酵时间液体菌种菌丝生物量(干)及虫草素含量
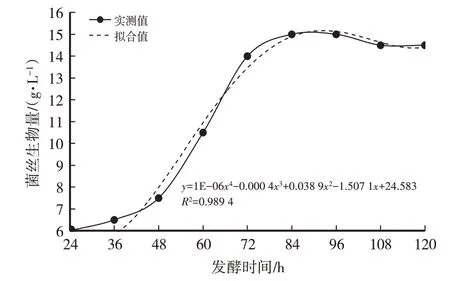
图9 发酵时间对菌丝生物量(干)的影响(生长曲线)
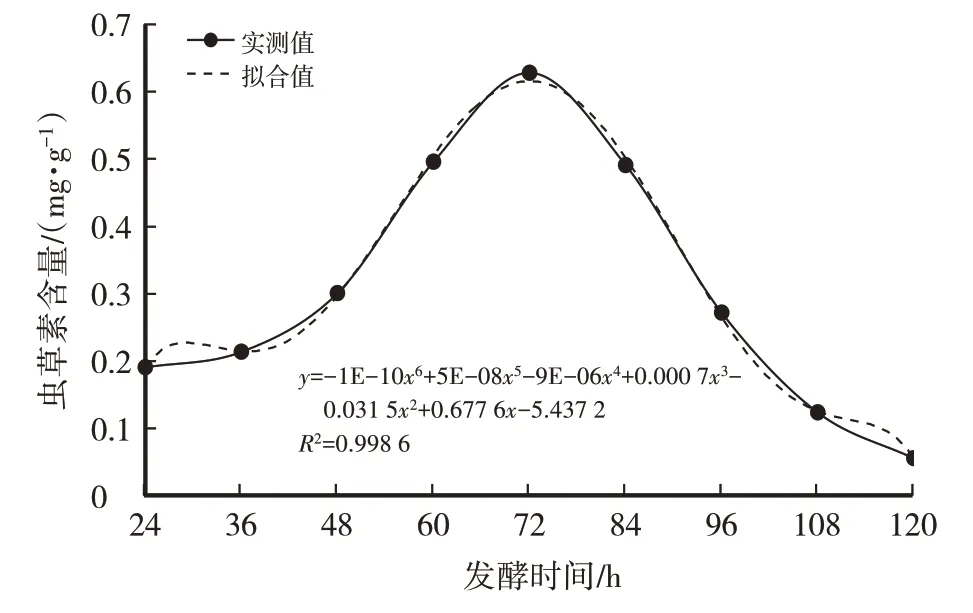
图10 发酵时间对虫草素含量的影响

图11 显微镜下不同发酵时间的CMC33菌株液体菌种显微镜观察菌丝体状态(10×40倍数)
经计算得菌丝干重(y)与发酵时间(x)之间的函数关系式:y=1E-06x4-0.000 4x3+0.038 9x2-1.507 1x+24.583,R2=0.989 4,模型拟合较好。虫草素含量(y)与发酵时间(x)之间的函数关系式:y=-1E-10x6+5E-08x5-9E-06x4+0.000 7x3-0.031 5x2+0.677 6x-5.437 2,R2=0.998 6,模型拟合较好。
2.3 栽培验证试验结果
以优化条件(摇床转速140 r/min,接种量8%,装液量200 mL,发酵周期84~96 h)培养试验菌株CMC33、L1-2和AoJ1-7液体菌种,结果表明(表5、图12、图13),供试3个菌株的液体菌种状态良好,呈淡黄色的溶液,且菌球较均匀一致,分布均匀、量适中、流动性好;优化条件培养的液体菌种栽培所得的子实体色泽金黄,条形匀称,头部略膨大、饱满,中等,子实体数适中,生物转化率均在88%以上;采用高效液相法测定子实体的虫草素含量,CMC33、L1-2和AoJ1-7虫草素含量均在3 mg/g以上。可见,优化后液体菌种发酵工艺适宜培养不同蛹虫草菌株的液体菌种。
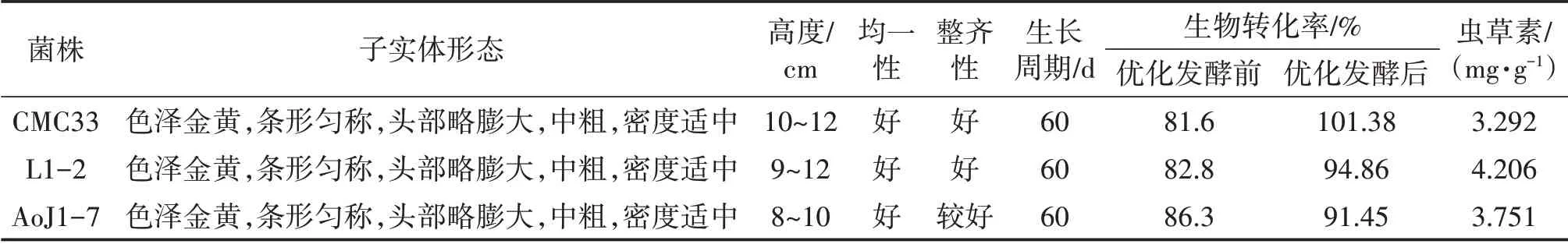
表5 供试蛹虫草菌株优化发酵培养液体菌种应用结果
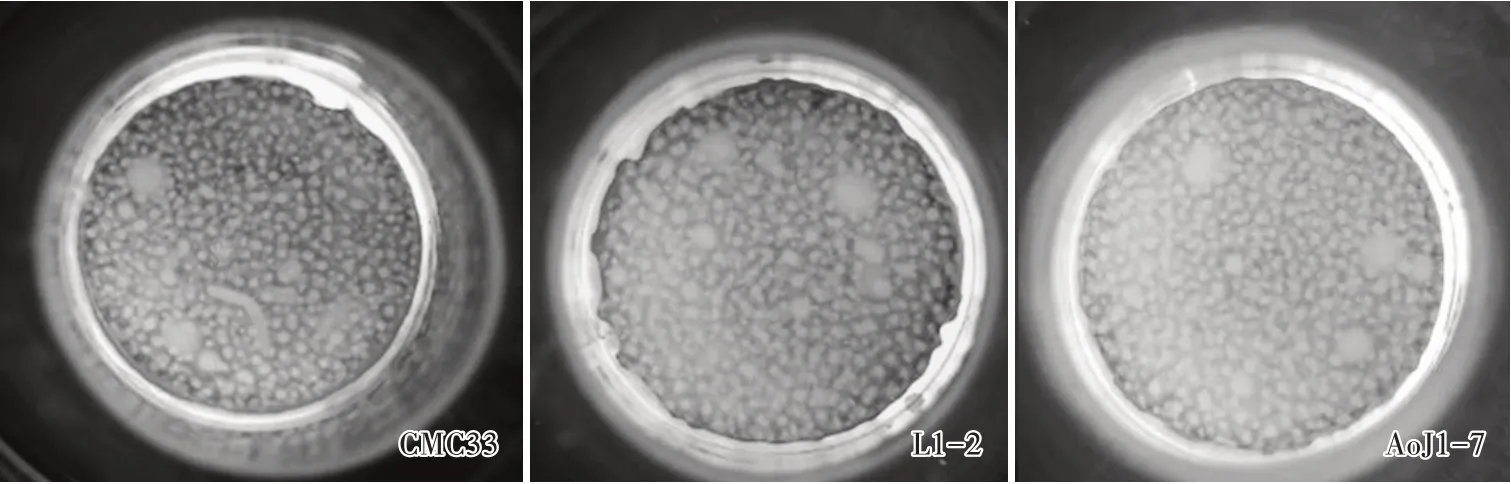
图12 供试蛹虫草菌株液体培养的菌球状态

图13 栽培验证试验长出蛹虫草子实体
3 小结
采用单因素试验方法,对蛹虫草液体菌种发酵条件进行优化,获得蛹虫草液体菌种最佳发酵条件:摇床转速140 r/min,接种量8%,装液量200 mL,发酵周期84~96 h。栽培验证试验表明,该工艺稳定可靠,可用于蛹虫草液体菌种的生产。
