广藿香水提液对3T3-L1前脂肪细胞增殖、分化和改善胰岛素抵抗的作用
2021-12-23高海云常仁旭侯林彤岳学青崔一喆
高海云,常仁旭,侯林彤,岳学青,徐 闯,崔一喆
(黑龙江八一农垦大学 动物科技学院,黑龙江 大庆 163319)
胰岛素抵抗(IR)作为我国糖尿病相关研究的热点问题,不仅是2型糖尿病(T2DM)发生的主要病理机制[1-2],还与畜牧业酮病的发生发展有密切的相关性[3]。IR主要表现在脂肪、肝脏和骨骼肌等三大外周组织,其中脂肪是率先发生IR的部位。脂肪细胞不仅是脂肪组织的主要成分,而且在调节脂肪组织能量稳态和内分泌功能中起关键作用[4-6]。而脂肪细胞分化是形成功能性脂肪以促进胰岛素敏感性和脂质代谢的关键因素[7-9]。与脂肪细胞分化密切相关的基因之一是过氧化物酶体增殖物激活受体(peroxisome proliferator-activated receptor,PPAR),根据结构的不同,PPAR可分为α、β(或δ)和γ 3种类型,其中PPARγ主要在脂肪细胞分化、IR和免疫系统中发挥重要作用,是胰岛素增敏剂噻唑烷二酮类药物(troglitazone,TZDs)作用的靶分子[10]。而在PPARγ的3种亚型中,PPARγ2与脂肪和皮脂腺细胞的分化有着密切关系[11]。PPARγ2作为脂肪细胞分化过程中重要的调节因子,它可促使成纤维细胞或骨髓间充质干细胞向成熟的脂肪细胞分化[12]。IR是指机体对胰岛素敏感性的下降,主要是由肝糖输出功能增强,脂肪组织和肌肉组织摄取葡萄糖能力减弱所导致[13]。因此调节糖脂代谢提高胰岛素敏感性,从而改善IR的药物研究至关重要。
广藿香(Pogostemoncablin,PC)又名刺蕊草、南藿香,该品为唇形科植物PC的干燥地上部分[14]。PC是中国和东南亚国家(例如马来西亚和印度)的重要传统药物,具有数千年的历史,不仅具有芳香化浊、和中呕解暑之效,还具有抗病毒活性、抗氧化、抗炎和止痛等方面的重要生物活性[15]。目前PC水提液对脂肪细胞的增殖分化以及调节IR效果上尚不明确,本研究通过PC水提液对3T3-L1前脂肪增殖和分化的影响,以及在IR状态下对3T3-L1脂肪细胞葡萄糖代谢的调节,探究PC水提液改善IR的作用。
1 材料与方法
1.1 中药提取中药PC购自大庆福瑞邦药房,称量好的中药饮片中加入10倍蒸馏水浸泡过夜后进行煎煮提取,加热至微沸,保持微沸50 min后过滤得中药液,剩余的药渣加入8倍量蒸馏水,保持微沸30 min后过滤得中药液。合并2次药液,加热浓缩至生药质量浓度500 g/L,冷却至室温,使用0.22 μm的滤器过滤,4℃保存待用。
1.2 材料3T3-L1前脂肪细胞(上海中科院);DMEM高糖培养基(美国Gibco-BRL公司);特级胎牛血清(美国Clark公司);PBS、油红O染色液、胰蛋白酶、青链霉素(Solarbio公司);二甲基亚砜(DMSO)、地塞米松、3-异丁基3-异丁基-1-甲基黄嘌呤(IBMX)均购自Sigama;胰岛素(上海源叶生物科技有限公司);四氮甲基偶氮唑盐(MTT)及小鼠甘油三酯酶联免疫试剂盒(上海朗顿生物科技有限公司);葡萄糖测定试剂盒(葡萄糖氧化酶法,南京建成生物工程研究所);PPARγ2和β-actin抗体(CST公司);HRP标记二抗(碧云天公司);显影发光液(新海基因公司)。
1.3 细胞处理
1.3.1细胞培养 将复苏好的3T3-L1前脂肪细胞培养于培养瓶中,在含10%的胎牛血清和1%青链霉素的高糖DMEM的完全培养液,37℃、5% CO2培养箱中培养。观察细胞状态,等细胞生长至对数期时进行传代。
1.3.2配制MDI 诱导剂母液 先配置母液,即将IBMX溶于DMSO配制浓度为0.05 mol/L,将地塞米松溶于无水乙醇中配制浓度为1 mmol/L,将25 mg 胰岛素溶于25 mL pH3.0的稀HCl中,质量浓度为1 g/L,3种母液配制完成,-20℃保存待用。
1.3.3细胞分组及诱导分化 诱导分化时,将以上3种母液溶于10% 胎牛血清和1%青链霉素的DMEM高糖完全培养液中,终浓度为0.5 mmol/L IBMX、1 μmol/L地塞米松和10 mg/L胰岛素,此为MDI诱导剂Ⅰ。再将胰岛素母液混匀在完全培养液中配成终质量浓度10 mg/L胰岛素为诱导剂Ⅱ。待细胞生长至80%~90%、接触抑制2 d 后开始诱导分化(第0天)并加入PC,将细胞分为对照组(只加完全培养液,不加诱导剂)、诱导分化组(加入MDI诱导剂)、 PC 0.5 g/L组(加入MDI和 0.5 g/L PC水提液)、PC 1.0 g/L组(加入MDI和1.0 g /L PC水提液)、PC 2.5 g/L组(加入MDI和2.5 g/L PC水提液)、PC 5.0 g/L组(加入MDI和5.0 g/L PC水提液)。加入MDI诱导剂Ⅰ培养48 h为第1次诱导,然后第2次诱导换诱导剂Ⅱ继续培养48 h,接着第3次诱导换只含血清和双抗的完全培养液,之后每48 h换液1次,共2次,每次换液时重新加入药物,诱导分化第8天后分化完成。
1.4 指标检测
1.4.1油红O染色 细胞诱导分化完成后,先移去旧培养基,然后用PBS洗涤2~3次,4%多聚甲醛固定1 h,固定好后用PBS洗涤后控干,再用0.5%油红O溶液染色1 h,之后用PBS洗涤2~3次,洗去多余浮色。在显微镜下观察到分化成熟的脂肪细胞形态,细胞浆内被染成红色的环状脂滴,并进行照相。照相完毕,加入异丙醇于平板混匀器上摇匀5 min,吸出每孔液体,用ELISA酶标仪检测D492 nm值。
1.4.2甘油三酯(TG) 用ELISA试剂盒检测。
1.4.3MTT法检测PC对3T3-L1前脂肪细胞增殖的影响 收集12,24,36,48 h细胞,每孔加入100 μL MTT溶液。孵育4 h,弃去旧液,每孔加入200 μL DMSO溶液,酶标仪读板,检测D450 nm值,并计算相对增殖率和抑制率。相对增殖率=(试验组D值-空白孔D值)/(对照组D值-空白孔D值)×100%,抑制率=(1-试验组平均D值/对照组平均D值)×100%(同一时间)。
1.4.4Western blot法检测3T3-L1前脂肪细胞分化蛋白PPARγ2 通过向3T3-L1前脂肪细胞样品中添加含有蛋白酶抑制剂的冷冻RIPA缓冲液来制备裂解物。漩涡震荡数下混匀混合物,再放在冰上静置裂解30 min,其中每过10 min震荡混匀1次。然后将裂解样品于4℃、14 000 r/min离心10 min,收集澄清的上清液并保存在-80℃。使用BCA试剂盒确定蛋白质浓度,根据测得浓度将样品浓度调至一致。在SDS聚丙烯酰胺凝胶(10%)上分离20 μg 的蛋白质样品,然后转移至PVDF膜上并在含有Tween-20(0.1%)和脱脂牛奶(5%的磷酸盐缓冲液)封闭液中常温封闭1 h。4℃环境下孵育一抗过夜,TBST洗涤液洗涤后室温孵育二抗30 min,洗涤后使用Protein simpie system进行显影检测,ImageJ软件分析强度,以β-actin作为内部对照。
1.4.5IR模型的建立 取分化成熟的脂肪细胞,于含0.2%BSA的培养基中过夜培养,再分为模型组和正常对照组,对照组给予常规高糖DMEM培养基,模型组给予1 mmol/L棕榈酸(PA)作用48 h,之后换含有100 nmol/L的胰岛素培养液刺激30 min 用于造模。收集细胞培养上清液,采用葡萄糖氧化酶法检测葡萄糖消耗确定是否造模成功,造模成功的细胞用于后续糖脂代谢试验。
1.4.6葡萄糖过氧化酶法检测葡萄糖消耗量 取诱导分化成熟的脂肪细胞,同时设正常对照组、IR模型组和模型组分别加入PC水提液(0.5,1.0,2.5,5.0 g/L)共6组,继续培养24 h,完成后收集各组细胞培养上清,应用葡萄糖氧化酶法测定各组残余的葡萄糖浓度,以未经培养的培养基中的浓度与之相减,计算出各孔细胞的葡萄糖消耗量。

2 结果
2.1 PC对3T3-L1前脂肪细胞增殖和抑制的影响MTT结果显示,在添加不同质量浓度PC水提液处理3T3-L1前脂肪细胞12~48 h,随着时间和质量浓度的增加,PC对细胞增殖的抑制率升高,呈一定的时间-剂量依赖关系。随着PC质量浓度的增加,细胞的增殖率均明显下降(P<0.05或P<0.01)(图1)。加入不同质量浓度的PC,随着时间的延长,对3T3-L1前脂肪的抑制率也越高,且在36 h时抑制率达到最高,此时不同质量浓度的PC抑制率分别是18%,28%,37%,47%(表1)。

表1 PC对3T3-L1前脂肪细胞的抑制作用

*.与对照组相比差异显著(P<0.05);**.与对照组相比差异极显著(P<0.01)图1 PC水提物对3T3-L1前脂肪细胞的相对增殖率的影响
2.2 细胞形态变化和PC水提液对3T3-L1前脂肪细胞脂肪含量的影响第8天诱导分化结束后,显微镜下可见对照组有少量细胞呈成熟脂肪细胞表型,有少量环状脂滴形成。而诱导分化组可见细胞大都分化为典型的成熟脂肪细胞,细胞由梭状的成纤维细胞变成圆圆的“戒状”成熟脂肪细胞,脂滴明显增多。与诱导分化组相比,PC组可见细胞脂滴数量较诱导分化组增加明显,胞浆内脂滴明显增多,部分融合成较大脂滴;随着PC质量浓度增加,细胞中出现的脂滴越多。油红染色比色结果显示,与对照组相比,不同质量浓度PC组脂滴极显著增多(P<0.01),与诱导分化组相比,5.0 g/L PC组脂滴显著增多(P<0.05)(图2)。

A.对照组;B.诱导分化组;C~F.分别为0.5,1.0,2.5,5.0 g/L PC水提物+诱导分化剂组。*.与诱导分化组相比差异显著(P<0.05);**.与诱导分化组相比差异极显著(P<0.01)。#.与对照组相比差异显著(P<0.05);##.与对照组相比差异极显著(P<0.01)。下同图2 PC水提物对3T3-L1前脂肪细胞形态变化和分化的影响(200×)
2.3 PC对成脂分化的促进作用和分化相关蛋白PPARγ2表达水平的影响ELISA检测细胞内甘油三酯(TG)含量结果显示,与对照组相比,诱导分化组细胞TG含量增加,随着PC质量浓度增加,TG水平逐渐上升,尤其2.5,5.0 g/L PC组的TG含量显著增加(P<0.05)(图3)。Western blot结果分析显示,与对照组相比,MDI诱导分化组PPARγ2蛋白表达量极显著升高(P<0.01);较MDI诱导分化组相比,不同质量浓度的PC组PPARγ2蛋白表达水平有上升趋势,1.0,2.5 g/L PC组极显著升高(P<0.01)(图4)。

图3 3T3-L1脂肪细胞内甘油三酯的含量

图4 PC水提物对3T3-L1脂肪细胞分化蛋白PPARγ2表达的影响
2.4 IR建模结果完全分化的3T3-L1脂肪细胞加入PA刺激48 h后,由表2可知,建模组的葡萄糖消耗量低于对照组,结果有极显著性差异(P<0.01)。再加入100 μmol/L胰岛素刺激细胞30 min,模型组的葡萄糖消耗量极显著低于对照组(P<0.01),证明建模成功。

表2 3T3-L1脂肪细胞IR模型的建立
2.5 葡萄糖消耗量药物干预24 h后,与对照组相比,模型组葡萄糖消耗量低于对照组,差异极显著(P<0.01)。加入PC的各组与模型组相比较,0.5,1.0,2.5,5.0 g/L的PC组有极显著性差异(P<0.01),提示PC水提液可显著提高IR脂肪细胞的葡萄糖消耗量(图5)。
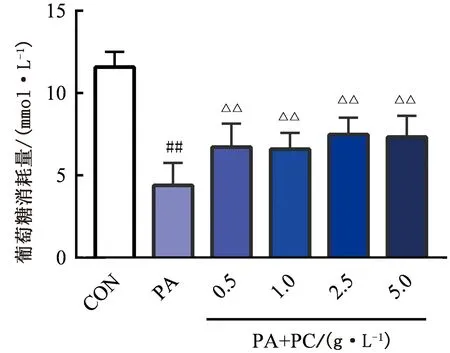
△△.与IR模型组相比差异极显著(P<0.01)图5 PC水提物对IR-3T3-L1脂肪细胞的葡萄糖消耗量的影响
3 讨论
脂肪组织主要由脂肪细胞组成,除了具有脂肪储存的作用,还作为最大的内分泌器官,所产生的脂肪细胞因子可以参与各种代谢,包括葡萄糖和脂质代谢[16]。而脂肪组织量不足会导致游离脂肪酸存储不足,从而导致血浆游离脂肪酸水平升高,进而导致肌肉和肝脏中脂肪沉积增加,最终导致IR和T2DM,因此促进前脂肪细胞向成熟脂肪细胞分化,增加脂质积累也是调节脂肪细胞胰岛素敏感性的途径之一。传统中药作为我国治疗疾病的重要方法,很多中药提取物对于改善IR可能具有卓越的疗效。
本研究采用3T3-L1前脂肪细胞作为研究对象,探讨PC水提液对3T3-L1前脂肪细胞的增殖和诱导分化的影响,以及在IR状态下对3T3-L1前脂肪细胞葡萄糖摄取的作用。研究表明,PC能够明显抑制3T3-L1前脂肪细胞的增殖,油红染色结果可发现,3T3-L1前脂肪细胞在不加诱导剂的情况下也能分化出少量脂滴,说明3T3-L1前脂肪细胞具有自分化的功能。而与诱导分化组相比PC水提液组能够显著促进3T3-L1前脂肪细胞的脂滴积累,ELISA法检测细胞内甘油三酯含量也显示,与诱导分化组相比,添加2.5和5.0 g/L 的PC组能明显增加细胞内甘油三酯蓄积,表明促进了3T3-L1前脂肪细胞的分化,增加脂质的形成。在奶牛畜牧业上,奶牛的能量代谢在过渡期往往面对着巨大挑战,在分娩前后,奶牛能量缺乏,脂肪组织脂肪动员,血浆胰岛素和葡萄糖浓度降低,脂肪组织和其他周围组织的胰岛素敏感性受损以及儿茶酚胺、生长激素和糖皮质激素的浓度增加,造成动物机体脂肪细胞脂质合成减少,脂解作用增强[17]。故促进脂质生成表明PC水提液具有增强脂肪细胞胰岛素敏感性和摄取葡萄糖的潜力。
脂肪细胞的分化还涉及一些重要转录因子表达的变化,包括过氧化物酶增殖物活化受体(PPARγ)和CCAAT/增强子结合蛋白(CCAAT/enhancer binding protein,C/EBP)家族[18]。而PPARγ被认为是脂肪细胞分化的主要调节剂,参与控制能量平衡以及脂质和葡萄糖稳态,PPARγ的激活可引起胰岛素增敏并增强葡萄糖代谢[19-20]。PPARγ突变体可加剧IR并减小脂肪细胞大小[21]。PPARγ以2种同工型蛋白的形式存在,即PPARγ1和γ2,它们的N末端因启动子的替代使用而异[22]。其中PPARγ2是合成脂肪中重要的调控因子,PPARγ2基因的表达水平是作为反映脂肪细胞分化程度的重要标志[23]。而本研究发现,应用0.5,1.0,2.5,5.0 g/L PC水提液干预细胞后,与诱导分化组相比,PC组PPARγ2蛋白表达水平升高,尤其1.0,2.5 g/L PC组的PPARγ2蛋白表达极显著上升(P<0.01);表明PC水提液通过增加PPARγ2蛋白的表达水平促进了3T3-L1前脂肪细胞向成熟脂肪细胞的分化历程。除了在脂肪形成中的关键作用外,PPARγ2还被认为在维持成熟的脂肪细胞功能中起着重要作用,该功能控制着代谢关键酶和葡萄糖转运蛋白的表达[24],因此PC水提液也可能是通过PPARγ2蛋白表达水平来改善IR状态的。并且,奶牛泌乳期,胰岛素敏感性受损会降低关键脂肪形成酶的转录和活性,限制脂肪细胞合成脂肪酸和甘油三酯的能力,从而增强脂肪组织释放FFA的作用,进一步造成体内脂肪酸紊乱,发生奶牛酮病,加重奶牛能量负平衡状态[25],因此脂肪细胞甘油三酯的储备是抵消围产期奶牛能量负平衡的主要能源,故说明PC水提液促进前脂肪细胞分化和脂质生成在减轻奶牛能量负平衡状态上有潜在价值。
建立IR模型是体外筛选改善IR药物的常用手段,可以在细胞及分子水平来研究IR的发生机制。本研究应用1 mmol/L棕榈酸为诱导剂建立IR模型,给予诱导剂后48 h,与正常对照组相比,模型组细胞葡萄糖消耗明显降低(P<0.01),提示IR后细胞葡萄糖利用率降低。结果表明,添加不同质量浓度PC水提液干预24 h后,0.5,1.0,2.5,5.0 g/L PC均能够明显促进细胞的葡萄糖消耗(P<0.01);表明PC具有改善IR-3T3-L1脂肪细胞的IR状态,提高了脂肪细胞对葡萄糖摄取和利用的能力,从体外细胞水平上说明PC具有改善IR的效果。
本研究结果表明,PC对改善IR有显著作用,为中药PC的进一步研究开发提供了试验依据,也为开发和有效利用PC在治疗T2DM奠定了基础。而IR的发生与奶牛酮病,能量负平衡的关系密不可分,故PC水提液对酮病的防治同样具有重要意义,同时PC改善体外脂肪细胞IR的作用机制及PC对葡萄糖转运率的影响及其机制尚有待进一步深入研究。
