塞尼卡病毒VP1蛋白亚单位候选疫苗小鼠免疫评价
2021-12-23曾嘉庆于成东张金勇鲁会军金宁一
孟 媛,曾嘉庆,于成东,张金勇,李 凯,高 旭,鲁会军*,金宁一*
(1.延边大学 农学院,吉林 延吉 133002;2.军事科学院 军事医学研究院 军事兽医研究所,吉林 长春 130122)
塞尼卡病毒(Seneca Valley virus,SVV)是一种具有二十面体结构、直径27~30 nm的单链正链无囊膜RNA病毒,属于小RNA病毒科塞尼卡病毒属的唯一成员[1]。VP1是小RNA病毒具有最强免疫原性的结构蛋白,能够与宿主细胞结合产生特异性免疫应答[2-3]。
自2008年以来,塞尼卡病毒病相继报道于加拿大、美国等国家,发病猪临床上呈现口鼻、蹄冠部和黏膜处溃疡、糜烂,厌食、嗜睡、发热和呕吐等症状[4-5]。病毒主要感染育肥猪和新生仔猪,其中新生仔猪的死亡率高达30.0%~70.0%,发病周期持续1~2周[6]。该病在我国于2015年首先在广东省确诊,分离株与国外病毒株的同源性为94.4%~97.1%[7]。此后该病在河南、山东、黑龙江等多省发生[8-10]。当前,SVV疫苗的研究主要集中在油佐剂灭活疫苗和减毒活疫苗,防控本病仍无商品化疫苗可用。SVV灭活疫苗具有良好的免疫效果,但疫苗生产过程中病毒灭活不彻底会引起生物安全问题。同时,减毒活疫苗也有毒力返祖的危险。此外,我国猪群缺乏对SVV的免疫屏障,大量的亚临床感染及无商品疫苗可用,增加了我国对该病的防控及净化难度。因此,迫切需要开发一种具有高安全性的SVV新型疫苗。
佐剂是一种能增强抗原特异性免疫应答的物质。佐剂与抗原结合后,可诱导较强的免疫应答。佐剂有许多潜在的好处,例如减少疫苗接种的频率和疫苗中使用的抗原的剂量,改善免疫应答,在某些情况下,提高成品疫苗的稳定性。
本研究在已制备的SVV VP1重组蛋白的基础上[11-12],联合2种佐剂进行了小鼠免疫试验,对其诱导BALB/c小鼠产生体液免疫和细胞免疫反应的能力进行了评价,探讨了其作为SVV疫苗候选株的可行性。
1 材料与方法
1.1 细胞、蛋白、毒株及试验动物原核表达的SVV VP1重组蛋白由本实验室制备并保存;Trans1-T1和E.coliBL21(DE3) 化学感受态细胞购自北京全式金公司;pET-28a(+)载体,SVV毒株及BHK-21-21细胞由本实验室保存。6周龄BALB/c小鼠购自斯贝福公司。
1.2 主要试剂尿素购自生工生物有限公司;His标签Ni2+-NTA金属螯合蛋白质纯化柱购于北京全式金公司;BCA蛋白定量试剂盒、山羊抗小鼠(HRP)标记IgG购自碧云天生物技术公司;弗式佐剂购自SIGMA公司;铝盐佐剂购自Invitrogen公司;TMB(ELISA)与终止显色液购自Solarbio公司;红细胞裂解液购自Beyotime公司;小鼠淋巴细胞分离液购自达科为公司; Mouse IFNg uncoated ELSA Kit、Mouse IL-4 uncoated ELISA Kit、Mouse IL-2 uncoated ELISA Kit均购自Thermo Fisher。
1.3 重组蛋白的纯化及定量将重组菌接种到LB培养基中,总体积2 L。37℃、200 r/min培养至D600值为0.4~0.6。收集菌液使用Ni2+-NTA金属螯合蛋白质纯化柱进行纯化蛋白,进行SDS-PAGE分析。使用BCA方法确定纯化后蛋白含量。
1.4 小鼠免疫试验小鼠30只,随机分为VP1-AL组、VP1-FCA组和PBS对照组3组,每组10只,免疫方案见表1。用VP1质量浓度为0.56 g/L的可溶性蛋白,联合氢氧化铝佐剂与弗式佐剂进行小鼠免疫,试验组免疫抗原剂量50 μg/只,进行腿部肌肉注射100 μL/只,首免后14 d进行二免。

表1 小鼠免疫试验
1.5 免疫效果评估
1.5.1特异性抗体 采用ELISA方法检测免疫后VP1特异性抗体,包被VP1蛋白5.7 mg/L,经5%脱脂乳封闭后,加入血清(采集的血清10倍比稀释,1∶20~1∶2×106)37℃孵育1 h;经PBST洗板后,加入HRP标记的山羊抗小鼠(1∶10 000)37℃孵育30 min;使用PBST洗板,加入TMB显色液常温避光作用15 min后,加入ELISA终止液。酶标仪测定 450 nm 处的D值,并根据P/N值计算其特异性抗体效价。
1.5.2中和抗体 将血清56℃灭活 30 min,以二倍倍比稀释至 1∶2 048,并加入100 TCID50的病毒抗原,每孔50 μL,在37%孵育30 min。调整BHK-21细胞浓度为 5×105个/mL,以100 μL/孔接种至96孔培养板培养,观察3 d,记录病变孔。使用Reed-Muench法计算中和抗体效价。
1.5.3小鼠淋巴细胞的分离 每组随机取3只小鼠,断颈处死后浸泡于75%的乙醇中 15 min,于超净台中研磨分离小鼠脾脏细胞,计数备用。
1.5.4T淋巴细胞亚群检测 取分离得到的淋巴细胞 1×106个于1.5 mL EP 管中,按说明书分别加入PE/Cy5anti-mouse CD3ε、FITC anti-mouse CD4、anti-mouse CD8a,而后加100 μL荧光洗液将细胞均匀混悬,于4℃避光孵育30 min,离心后使用PBS重悬,向 EP 管中加入200 μL荧光固定液,均匀混悬后转移至流式管,于流式细胞仪检测 CD3+CD4+与 CD3+CD8+细胞数。
1.5.5淋巴细胞增殖 取分离得到的淋巴细胞加至96孔细胞培养板中,每孔50 μL(细胞数为1×105个),向细胞中分别加入50 μL的RPMI-1640、50 μL 的ConA(5 mg/L)以及50 μL SVV病毒(MOI=1),分别作为对照组、非特异性刺激组以及特异性刺激组,每个样品做3个重复。将96孔板置于CO2恒温培养箱中于37℃下继续培养72 h,而后每孔加10 μL(5 mg/L)WST-1 溶液,继续培养4 h,使用酶标仪检测其450 nm 的D值。
计算刺激指数(SI),公式:SI=(刺激孔D450值-空白对照孔D450值)/(对照孔D450值-空白对照孔D450值)。
1.5.6细胞因子检测 采集小鼠免疫后14,28,49 d 的血清100 μL,参照Mouse IFNg uncoated ELISA Kit、Mouse IL-4 uncoated ELISA Kit、Mouse IL-2 uncoated ELISA Kit说明书进行细胞因子的检测。
1.5.7数据的统计分析 本研究采用 GraphPad Prism 软件进行数据分析及绘制图表。当P<0.05表示具有显著性差异,P<0.01表示具有极显著性差异。
2 结果
2.1 重组蛋白纯化及定量结果VP1重组蛋白经Ni2+-NTA金属螯合蛋白质纯化柱纯化,透析前后的纯化VP1蛋白SDS-PAGE结果见图1,重组蛋白相对分子质量约为3.5×104。经BCA蛋白定量检测法可得蛋白含量为2.4 g/L。
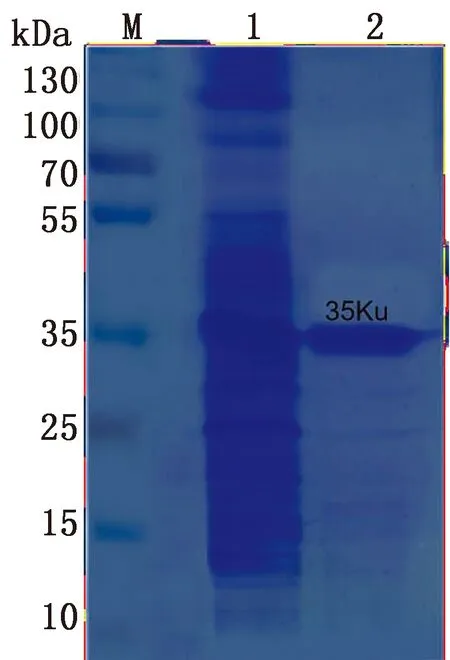
M.蛋白分子质量标准;1.VP1纯化前;2.VP1纯化后图1 透析后的纯化VP1重组蛋白SDS-PAGE分析
2.2 特异性抗体的检测结果检测每组不同小鼠间血清中VP1蛋白特异性抗体,由图2可知,VP1-FCA组与VP1-AL组抗体水平始终高于PBS组,一免后7 d 各试验组均呈上升趋势,试验组抗体水平始终高于PBS组,二免后14 d,VP1-FCA组、VP1-AL组特异性抗体效价分别达到最高值1∶163 840,1∶5 120,PBS组特异性抗体效价是1∶8(P<0.01)。

图2 免疫小鼠特异性抗体效价检测
2.3 中和抗体的检测结果检测小鼠血清中和抗体,由图3可知,VP1-FCA组与VP1-AL组抗体水平始终高于PBS组,一免后14 d各试验组均呈上升趋势,试验组在二免后7 d时中和抗体效价极显著高于PBS组(P<0.01),VP1-FCA组达到最高值(1∶512),PBS组的中和抗体效价是1∶12。在二免后14 d时VP1-AL组达到最高值(1∶1 024),PBS组的中和抗体效价是1∶16(P<0.01)。

图3 免疫小鼠中和抗体效价检测
2.4 T淋巴细胞的亚群检测分离二免后与三免后小鼠的脾淋巴细胞,并检测 CD3+CD4+,CD3+CD8+淋巴细胞亚群的数量,对其结果进行分析。由图4可知,二免后试验组的CD3+CD4+细胞亚型与CD3+CD8+细胞亚型水平均高于PBS组。其中VP1-AL组CD3+CD4+T细胞的水平高于PBS组1.94倍(P<0.01),VP1-FCA组CD3+CD4+T细胞的水平高于PBS组1.92倍(P<0.05)。由图5可知,VP1-FCA组CD3+CD8+T细胞的水平高于PBS组1.49倍(P<0.05),VP1-AL组CD3+CD8+T细胞的水平高于PBS组1.40倍(P<0.01)。二免后试验组的CD3+CD4+和CD3+CD8+T淋巴细胞亚群升高。由此可知亚单位疫苗可诱导体液免疫和细胞免疫,选择合适的佐剂可提高亚单位疫苗的免疫原性。
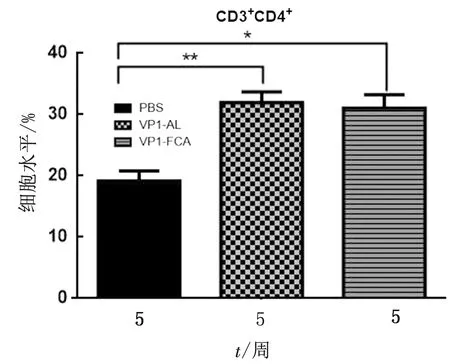
*表示与PBS组相比较差异显著P<0.05;**表示与PBS组相比较差异极显著P<0.01。下同图4 35 d小鼠免疫CD3+CD4+T淋巴细胞亚群

图5 35 d小鼠免疫CD3+CD8+T淋巴细胞亚群
2.5 淋巴细胞增殖试验二免后处死小鼠并取其脾脏,分离淋巴细胞,进行淋巴细胞增殖试验。由图6可知,二免后VP1-FCA组与VP1-AL组的SI值均约是PBS组1.4倍(P<0.05)。试验结果表明:SVV VP1亚单位疫苗可提高小鼠细胞免疫应答水平,并且在加强免疫后,使用氢氧化铝佐剂的亚单位疫苗其免疫应答水平显著提高。

图6 淋巴细胞增殖试验检测结果
2.6 细胞因子的检测结果
2.6.1细胞因子IL-4的检测 结果见图7。在小鼠一免后14 d时,试验组IL-4细胞因子水平均高于PBS对照组,其中VP1-AL组是PBS 组的1.5倍(P<0.05),VP1-FCA组是 PBS 组的2.9倍(P<0.01)。二免后21 d时VP1-AL组较一免后14 d升高47%,是PBS 组的2.2倍(P<0.05)。VP1-FCA组较一免后14 d降低34%,是 PBS 组的3.0倍(P<0.01)。结果显示,VP1-AL组与VP1-FCA组能够刺激小鼠Th2类细胞因子的分泌,从而提高体液免疫水平。

图7 IL-4的检测结果
2.6.2细胞因子IL-2的检测 结果见图8。在小鼠首免后14 d时,试验组与PBS组差异不显著(P>0.05)。在二免后21 d时,VP1-AL组与首免后14 d相比有所升高,是PBS组的1.8倍(P<0.01);VP1-FCA组与首免后14 d相比变化不明显,表明VP1-FCA组IL-2水平上升不明显。

图8 IL-2的检测结果
2.6.3细胞因子IFN-γ的检测结果 IFN-γ检测结果见图9,在小鼠一免后14 d时,VP1-AL组是PBS组的4.8倍(P<0.01),VP1-FCA组是PBS组的3.5倍(P<0.01)。在二免后21 d时,各组差异不显著(P>0.05)。综合表明:试验组能够刺激小鼠 Th1 类细胞因子的分泌,从而提高细胞免疫水平。

图9 IFN-γ的检测结果
3 讨论
近年来,塞尼卡病毒病正从国内猪新发传染病到常见病过渡,在多省出现疫情,呈扩大趋势,而且病毒有基因重组的风险,引起的毒株复杂多变,使得SVV可能会对我国的养猪业造成巨大的经济损失。由于SVV尚未被列为必须检测的猪传染病,因此国内外贸易可能会加剧SVV在不同国家与地区的传播[13]。同时,已从小鼠、小鼠粪便、苍蝇及环境样品中检测出SVV,这表明SVV具有较高的传染风险[14]。
由于亚单位疫苗是将免疫原注入到体内,引起动物机体的免疫应答,且亚单位疫苗的安全性好、不良反应低,可用于不宜使用活毒疫苗的情况,如妊娠母猪。而灭活疫苗免疫所需剂量大,次数多,成本较高;灭活过程中可能损害抗原表位导致免疫效果降低;并且研制灭活疫苗的重要前提是选取高病毒滴度的种子毒,以提高该疫苗诱导的体液免疫水平。YANG等[15]研制出首例SVV疫苗,使用的油佐剂灭活疫苗所需的抗原剂量较大,且当剂量减少时未能完全保护。此外,该灭活苗的中和抗体效价相对较低,最高只达到了1∶128。减毒活疫苗虽然免疫效果较灭活疫苗较为理想,但是疫苗毒遗传性状的稳定及安全性使其大规模生产传代受到限制。SHARMA等[16]开发了SVV减毒活疫苗,虽然免疫效果良好,但是在免疫后出现了病毒血症,并在分泌物中检测出核酸阳性。李帅等[17]进行了对口蹄疫疫苗的稳定、免疫活性与颗粒佐剂的研究,采用首免后14 d进行二免,激发机体产生了较强免疫力,因此本研究采用相似免疫时间点进行探究。此外,鉴于口蹄疫病毒(FMDV)与SVV同属于小RNA病毒科,且FMDV的疫苗研究较为丰富且成功,这为SVV候选疫苗研发指明了方向,如重组腺病毒载体疫苗、以纳米材料为佐剂的新型病毒样颗粒疫苗及多肽疫苗等[18-20]。
大肠杆菌载体是常用于重组蛋白表达的宿主菌,其具有培养简单、成本低廉可快速大量生产的特点。本研究旨在制备SVV亚单位疫苗,利用纯化的VP1蛋白联合弗氏佐剂、氢氧化铝佐剂免疫小鼠进行评价,并从特异性抗体、中和抗体、T 淋巴细胞增殖、T 淋巴细胞亚群、细胞因子 (IL-2、 IL-4、IFN-γ)进行免疫评估。结果表明,特异性抗体加强免疫后抗体水平显著增加,二免后14 d达到最高(1∶163 840),试验组显著高于PBS组(P<0.05),各疫苗佐剂组间差异不明显(P>0.05)。中和抗体检测显示试验组抗体水平始终高于PBS组,初免后2周各试验组均呈上升趋势,试验组在二免后7,14 d时中和抗体效价显著高于PBS组(P<0.05)。细胞亚群水平检测表明佐剂能够促进CD4+T、CD8+T分化为Th1、Th2细胞,其中VP1-AL组免疫效果较好;淋巴细胞增殖试验显示各佐剂特异性刺激组SI值均高于PBS组(P<0.05),且VP1-AL组SI值最高;检测细胞因子IL-4的结果表明,VP1-AL组与VP1-FCA组均能够刺激小鼠Th2 类细胞因子的分泌,从而提高体液免疫水平。检测细胞因子IL-2与IFN-γ的结果表明,VP1-AL组与VP1-FCA组能够刺激小鼠 Th1 类细胞因子的分泌,从而提高细胞免疫水平。鉴于,全世界猪群中只存在1种SVV血清型[21],而且铝盐佐剂与弗式佐剂VP1亚单位疫苗免疫小鼠能够诱导机体产生细胞免疫及体液免疫,因此VP1-AL组与VP1-FCA组候选疫苗可能成为预防与控制SVV传播的有力工具。
