间歇浸没植物生物反应器培养栀子愈伤组织及产藏红花素条件研究
2022-02-15金磊磊李泽坤金慧朱星扬张保钱蒋海侠陈集双
金磊磊 李泽坤 金慧 朱星扬 张保钱 蒋海侠 陈集双




摘要:为建立栀子愈伤组织的间隙浸没植物生物反应器高通量培养体系,同时探讨诱导剂对栀子愈伤组织中藏红花素合成的影响。以MS+2.0 mg/L 6-苄氨基嘌呤(6-BA)+0.2 mg/L 萘乙酸(NAA)+30 g/L蔗糖为增殖培养基,在40 d的培养时期内,栀子愈伤组织在植物生物反应器中生长状况良好,增殖系数呈升高趋势。对不同培养时间(20、30、40 d)和添加诱导剂处理的栀子愈伤组织中的藏红花素含量进行检测,结果表明,随着培养时间的增加,栀子愈伤组织中的藏红花素含量显著提高,在培养40 d时达到了0.206 5 mg/g;添加CuSO4和茉莉酸甲酯(MeJA)促进了栀子愈伤组织中藏红花素的合成,单位质量栀子愈伤中的藏红花素含量显著增加,培养30 d时达到0.372 3 mg/g。
关键词:栀子;愈伤组织;藏红花素;植物生物反应器;诱导剂
中圖分类号:S567.04 文献标志码: A
文章编号:1002-1302(2022)02-0042-05
收稿日期:2021-05-16
基金项目:江苏先进生物与化学制造协同创新中心项目(编号:XTD1825);国家自然科学基金(编号:31560079)。
作者简介:金磊磊(1987—),男,浙江东阳人,硕士,实验师,从事植物细胞工程、药用植物天然产物开发方面的研究。 E-mail:jinleilei2011@163.com。
通信作者:陈集双,博士,教授,博士生导师,从事生物资源学研究。E-mail:biochenjs@njtech.edu.cn。
栀子(Gardenia jasminoides Ellis.),别称黄栀子、山栀子、林兰等,属于茜草科栀子类植物,栀子花是卫生部颁布的第1批药食两用资源。栀子作为传统中药,具有护肝、利胆、降压、镇静、止血、消肿等作用[1]。栀子含有黄酮类、有机酸酯类、多糖类、醛类、醇类、长链烷烃类等化合物成分,其中栀子果实中主要的有效成分为藏红花素(crocin)、藏红花酸和栀子苷[2]。藏红花素又名西红花苷,主要来源于藏红花的成熟花丝中,是藏红花的有色成分且是主要成分[3]。研究表明,藏红花素具有降血脂、抗肿瘤等功效。由于藏红花以柱头入药,且藏红花适宜种植区域有限,高品质的藏红花资源短缺,年产量极低。栀子繁殖以扦插和实生苗种植为主,现有资源量大,可作为制备藏红花素的植物资源。
不同品种和产地栀子果中藏红花含量不同,目前报道的栀子果中藏红花素含量均在1%以内[4-8]。石凤鸣等发现随着栀子果实的成熟,藏红花素的含量显著增加[9]。付小梅等通过研究发现,藏红花素在pH值为6.0~7.0之间最稳定并且光照、温度均能影响其稳定性[10]。陈雁等利用高效液相色谱(HPLC)法测定了不同产地栀子中的藏红花素含量,其中江西吉安的栀子果实的藏红花素含量最高,达到了0.68%[11]。据研究报道,栀子的愈伤组织中也存在微量的藏红花素。陈书安等对产藏红花素的栀子愈伤组织进行了诱导和筛选,从而筛选出产藏红花素的栀子细胞系,其中1个细胞系的藏红花素含量达0.348 mg/g[12]。
笔者所在课题组自主开发了用于植物高通量繁育的间歇浸没式植物生物反应器,前期研究表明,该系统有利于带块茎(鳞茎)的植物繁殖体、植物愈伤组织、兰科植物原球茎等的增殖扩繁,在白芨、半夏、金钗石斛等药用植物种苗和组织器官的繁育上取得了较好的应用效果[13-15]。本研究基于植物生物反应器培养系统,以期建立栀子愈伤的高通量增殖体系,并探索通过植物生物反应器持续生产栀子愈伤、产藏红花素的优化方法。
1 材料与方法
1.1 材料
2018年4月,选取固体组培瓶中培养30 d 的山栀子愈伤组织作为增殖材料,开展植物生物反应器培养体系研究及藏红花素含量检测。栀子果实为购买的药用山栀子果实。本试验在南京工业大学生物资源工程研究所开展。
1.2 植物生物反应器培养
取30 d固体预培养的愈伤组织15 g,转接至含有1 000 mL液体培养基的植物生物反应器内,于 24 ℃ 下进行暗培养,间歇浸没频率为3 min/4 h。液体培养基配方为MS+2.0 mg/L 6-苄氨基嘌呤(6-BA)+0.2 mg/L萘乙酸(NAA)+30 g/L蔗糖,pH值为5.8。在培养基中添加CuSO4、 茉莉酸甲酯(MeJA)进行藏红花素合成诱导试验,设置2种添加方式:500 μmol/L CuSO4、500 μmol/L CuSO4+100 μmol/L MeJA,处理组和空白对照均重复接种3个植物生物反应器。
1.3 栀子愈伤的细胞结构观察
将植物生物反应器培养30 d的愈伤组织放入1%的NaCl溶液中,于120 r/min、28 ℃下摇瓶培养2 d。取少量愈伤组织细胞用中性红染色,放于光学显微镜下观察。
1.4 栀子愈伤增殖系数的测定
栀子愈伤在反应器中培养30 d后,观察其生长情况并统计分析。用分析天平称量栀子愈伤的鲜质量。栀子愈伤增殖系数的测定公式:
栀子愈伤增殖系数=培养30 d后栀子愈伤的鲜质量-转接时栀子愈伤的鲜质量转接时栀子愈伤的鲜质量。
1.5 藏红花素的提取
将不同培养处理的栀子愈伤组织以及栀子果实样品置于60 ℃恒温烘箱中5~6 h 至恒质量后研磨得粉末。称取粉末样品1 g,用50%甲醇稀释倒入50 mL离心管中,超声破碎30 min。再放入振荡培养箱中室温振荡提取2 h,3 500 r/min转速下离心20 min,取上清液。向离心沉淀物中加入10 mL 50%的甲醇,继续再振荡提取1 h,离心后再次回收上清液。将2次上清液合并,于50 ℃旋转蒸发,50%甲醇(色谱级)溶解浸膏,定容至10 mL,保存备用。
1.6 藏红花素的检测
液相色谱检测前,将50%甲醇溶解的样品通过0.22 μm有机滤膜过滤。
1.6.1 液相色谱条件的选择
色谱柱选用Innoval AQ C18 色谱柱(250 mm×4.6 mm,5 μm);流速设置为0.7 mL/min;检测波长为440 nm;柱温为25 ℃;流动相:甲醇与水体积比为53 ∶47;進样量为10 μL。
1.6.2 液相色谱标准曲线的建立
用分析天平精密称取藏红花素标准品0.005 g,用50%甲醇稀释配成0.5 mg/mL藏红花素标准品母液。取藏红花素标准品母液0.5、1.0、2.0、4.0、5.0 mL至5 mL容量瓶中,配成浓度分别为0.05、0.10、0.20、0.40、0.50 mg/mL的标准品溶液。检测时进样 10 μL,重复3次,测定完后,建立和绘制标准曲线及线性回归方程(横纵坐标分别为溶液浓度和出峰面积)。
1.6.3 数据分析
取处理好的栀子愈伤样品和对照样品按照“1.6.1”节中设定的液相色谱条件进行检测,并按照“1.6.2”节中建立的标准曲线,将与标准品同一出峰时间的峰面积换算成甲醇溶解液中的藏红花素含量,再根据以下公式,计算得到样品和对照品中的藏红花素含量。A为根据标准曲线计算到的浓度(mg/mL),粉末质量为1 g栀子愈伤干质量。
样品中藏红花素含量(mg/g)=A×10 mL甲醇定容体积1 g栀子愈伤粉末质量。
试验数据通过SPSS 20.0进行方差分析。
2 结果与分析
2.1 栀子愈伤的植物生物反应器培养体系
栀子愈伤组织的质地结构疏松,随着培养时间的增加,愈伤块逐步增大,颜色从白色变为淡黄色,与固体组培培养的愈伤状态一致;栀子愈伤组织团整体呈淡化黄色,表面较为光滑湿润,见少量丝状毛刺(图1-A)。由于细胞重叠不易将其平铺展开,遂取少量愈伤放于摇瓶培养将细胞分散,加入1%NaCl溶液可以让愈伤组织失水,以便观察细胞结构。在光学显微镜下,单个愈伤细胞呈长条状,中间无隔膜,细胞壁较薄(图1-B)。
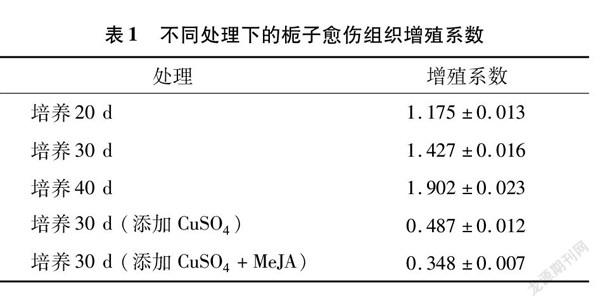
从增殖系数来看(表1),不添加CuSO4,当培养时间为40 d时,增殖系数达到1.902。培养20 d时,增殖系数最低,为1.175。由此可知,在40 d的培养时期内,栀子愈伤组织在植物生物反应器中增殖状态良好,且仍有继续增殖的趋势(图2-A、图2-B)。
添加CuSO4和MeJA后,在植物生物反应器中培养30 d栀子愈伤细胞团颜色基本呈褐色(图2-C、图2-D),愈伤细胞团的数量比对照培养组少,愈伤组织增殖缓慢。添加500 μmol/L CuSO4的栀子愈伤增殖系数为0.487,添加2种诱导剂的栀子愈伤增殖系数为0.348(表1)。由此可知,添加一定浓度的MeJA、CuSO4对栀子愈伤的生长具有抑制作用,不利于愈伤组织的增殖。
2.2 产藏红花素培养条件的优化
2.2.1 藏红花素标准曲线的建立
根据不同浓度藏红花标准品的HPLC检测峰图数据,绘制藏红花素浓度的标准曲线(图3),并得到计算公式:y=64 584.0x-1 407.9,r2=0.998 1。其中,y为峰面积,mAu·s;x为藏红花素含量,mg/mL。
2.2.2 不同处理栀子愈伤组织中的藏红花素含量
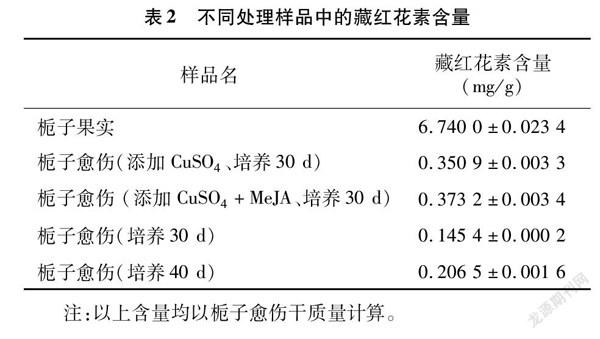
试验中发现,固体培养30 d和反应器培养20 d的样品峰面积太小,含量达不到检测下限。除此之外,栀子果实、植物生物反应器中培养30、40 d,以及添加CuSO4和MeJA后培养30 d的栀子愈伤的提取物中均有明显的藏红花素检测峰。本试验中藏红花素的出峰时间为(4.4±0.1) min(图3)。
根据标准曲线计算进样样品中藏红花素含量,并利用“2.2.1”节中的计算公式换算各个样品中藏红花素的质量浓度。不同样品中的藏红花素含量见表2。
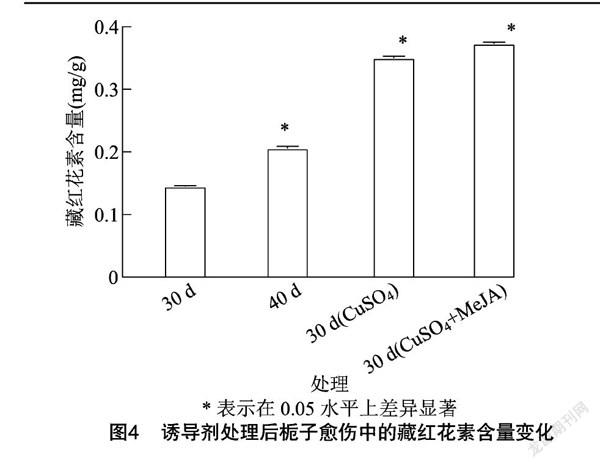
由表2可知,栀子果实中的藏红花素含量为6.74 mg/g,与相关研究报道的栀子果实中藏红花素含量[9]基本一致。植物生物反应器中培养30 d的愈伤组织中藏红花素含量为0.145 4 mg/g,40 d为0.206 5 mg/g,二者间差异显著(图4)。添加诱导剂处理后,藏红花素含量显著增加,其中添加CuSO4处理后藏红花素含量为0.350 9 mg/g,2种诱导剂组合处理为0.373 2 mg/g(表2),相较不添加诱导剂的处理中藏红花素含量差异显著。由此可得,诱导剂的添加能显著提高栀子愈伤中藏红花的含量。
3 讨论与结论
本试验建立了栀子愈伤的植物生物反应器高通量扩繁体系,并分析了不同培养时间(20、30、40 d)和诱导剂处理的栀子愈伤组织中的藏红花素含量。以固体组培瓶中培养30 d的栀子愈伤为增殖材料,在培养基为MS+2.0 mg/L 6-BA+0.2 mg/L NAA+30 g/L蔗糖,pH值为5.8的条件下,植物生物反应器中栀子愈伤的增殖状态良好,增殖系数高,优于同期的固体培养。同时,培养40 d的单质量栀子愈伤的藏红花素含量显著高于培养20、30 d的栀子愈伤组织,表明在一定的培养时期内藏红花素含量随愈伤的增殖而积累。诱导剂可促进栀子愈伤组织中藏红花素合成,添加CuSO4和MeJA 2种诱导剂时,单质量栀子愈伤中的藏红花素含量显著增加,达到0.372 3 mg/g。
按照结实情况,栀子分为药用栀子和赏花栀子。广泛种植的赏花栀子(如重瓣栀子、大花栀子)只开花不结果;山栀子及其变种水栀子为主要的药用栀子品种,由于栽培条件、品种资源和生产加工方式的制约,其栽培和利用尚未形成规模,影响了藏红花素等活性物质的制备和开发应用。植物细胞工程手段为藏红花素的快速高效生产提供了可行的技术方案。已有相关研究利用选育的藏红花细胞系和栀子细胞系来制备藏红花素[12,16],并有研究利用固液2步法来提高栀子愈伤组织中藏红花素的产量[17]。本试验利用植物生物反应器培养栀子愈伤组织,表现了较高的增殖效率,且培养周期短,不受土地、环境、季节的影响,具备生产藏红花素的潜力。
本试验结果表明,栀子愈伤中藏红花素含量明显低于栀子果实中的含量;添加诱导剂在一定程度上抑制了愈伤组织的增殖,实际每罐植物生物反应器的栀子愈伤产量较低,影响了藏红花素收率。后续试验将根据反应器中栀子愈伤的生长状态和藏红花素含量积累规律,重点研究植物生物反应器的培养条件优化,如生长激素浓度、诱导剂组合和诱导剂添加时间等,探讨栀子愈伤组织在植物生物反应器中的有效培养周期以及藏红花素的有效积累时间,以期建立持续制备藏红花素的高产体系。
参考文献:
[1]任治军,张立明,何开泽. 栀子主要成分的提取工艺及药理研究进展[J]. 天然产物研究与开发,2005,17(6):831-836,803.
[2]潘 媛,李隆云,王 钰,等. 我国主要栀子栽培资源分布与综合利用调查[J]. 天然产物研究与开发,2019,31(10):1823-1830.
[3]袁丽红,陆玉婷,黄 晶. 藏红花愈伤组织诱导和褐化抑制[J]. 南京工业大学学报(自然科学版),2009,31(6):21-26.
[4]杨 艳,汤玉喜,唐 洁,等. 药食两用黄栀子果实有效成分及其与农艺性状的相关性[J]. 中南林业科技大学学报,2019,39(1):15-19.
[5]Chen Q C,Zhang W Y,Youn U,et al. Iridoid glycosides from gardeniae fructus for treatment of ankle sprain[J]. Phytochemistry,2009,70(6):779-784.
[6]段 启,陈华师. HPLC法测定不同产地栀子中藏红花素的含量[J]. 中药新药与临床药理,2010,21(3):299-301.
[7]吴 敏,谷令彪,刘华敏,等. 栀子果油及藏红花素的分步萃取研究[J]. 食品科技,2017,42(1):231-235.
[8]倪勤学,高前欣,徐志丰,等. 2种栀子果主要经济性状及栀子果仁油成分分析[J]. 中国粮油学报,2017,32(10):78-84.
[9]石凤鸣,王文君,陈 雏,等. 栀子指纹图谱及不同生长期西红花苷和栀子苷含量的研究[J]. 时珍国医国药,2011,22(8):1874-1876.
[10]付小梅,王峥涛. 西红花苷-1的稳定性研究[J]. 食品科学,2012,33(5):71-73.
[11]陈 雁,杨中林,张雷红,等. HPLC法同时测定栀子中藏红花素和藏红花酸的含量[J]. 内蒙古中医药,2011,30(2):64-65.
[12]陈书安,王晓东,赵 兵,等. 产藏红花素栀子愈伤组织的诱导和筛选[J]. 中国生物工程杂志,2006,26(6):50-54.
[13]陈集双,张本厚. 高通量植物生物反应器及其在遗传资源挖掘中的应用[J]. 生物资源,2020,42(1):117-123.
[14]张保钱,樊小宽,金磊磊,等. 利用植物生物反应器培养白及种苗的动力学模型[J]. 科技通报,2019,35(9):35-42.
[15]张 杰,张本厚,贾明良,等. 利用间歇浸没植物生物反应器进行半夏组培快繁的研究[J]. 科技通报,2018,34(1):95-100.
[16]Chen S,Wang X D,Zhao B,et al. Screening of Crocus sativus L.callus lines for crocin production [J]. Chinese Bulletin of Botany,2004,39(4):455-460.
[17]郭志剛,邓 颖,刘瑞芝. 固液两步法的藏红花素生物合成[J]. 清华大学学报(自然科学版),2003,43(12):1609-1612.
