引起肉种鸡产蛋下降的新型坦布苏病毒的分离和鉴定
2021-12-23刘红祥刘秋云任衍倍刘建涛王群义宋姗姗杜元钊
刘 东,刘红祥,刘秋云,任衍倍,李 彬,刘建涛,王群义,刘 平,宋姗姗,杜元钊
(青岛易邦生物工程有限公司 动物基因工程疫苗国家重点实验室,山东 青岛 266032)
2010年4月以来,在我国浙江、福建、上海、山东等养鸭集中区,陆续暴发了一种以蛋鸭、种鸭采食、产蛋大幅度下降,肉鸭、成鸭、肉鹅等共济失调、神经症状为主要特征的疾病,经鉴定病原为坦布苏病毒,该病毒传播迅速、蔓延范围广,给我国养鸭业带来巨大损失[1-4]。随着疫病的发展,坦布苏病毒易感宿主逐渐扩大,不仅可以感染水禽鸭、鹅,也可以感染鸡、鸽子、麻雀等,研究表明,蛋鸡也可感染坦布苏病毒并引起产蛋下降。陈仕龙等[5]从产蛋下降的蛋鸡群分离到坦布苏病毒,动物回归试验也表明坦布苏病毒可以导致鸡群产蛋下降。张敬峰等[6]也从临床表现产蛋下降的蛋鸡群鉴定到1株坦布苏病毒。
近年来坦布苏病毒感染家禽现象逐渐增多且有蔓延趋势,本研究首次从我国产蛋下降的肉种鸡群中分离到新型坦布苏病毒,并通过动物回归试验证明新型坦布苏病毒可以引起肉种鸡群产蛋下降。因此开展新型坦布苏病毒的流行病学调查对该病的防控和公共卫生安全具有重要意义。同时本研究通过对新型坦布苏病毒流行病学调查,在病毒特性、遗传谱系、血清学感染规律、动物攻毒试验方面取得初步进展,为新型坦布苏病毒的疫苗研究和疫病防控等提供大量数据支持。
1 材料与方法
1.1 样本来源病料、血清来自广东、江苏、湖北、广西、福建等地出现产蛋下降的肉种鸡场。
1.2 试剂与耗材PCR试剂和Marker为TaKaRa产品;RT-PCR试剂为湖南艾克瑞产品;50 X TAE buffer为上海生工产品;Goldview核酸染料为labest产品;琼脂糖为康为世纪产品;核酸提取试剂盒为杭州博日产品;ELISA试剂盒来自上海兽医研究所、美国(IDEXX)爱德士公司等。
1.3 仪器与设备超净工作台(北京东联哈尔仪器);离心机(eppendorf);核酸提取纯化仪(杭州博日);电泳仪(北京六一);凝胶成像仪(上海培清科技);移液器(eppendorf);生化培养箱(上海精宏)。
1.4 细菌分离无菌采集发病场鸡只肝脏、卵巢、输卵管等组织样本接种胰蛋白胨大豆琼脂培养基(TSA+血清),置于37℃温箱中培养。
1.5 分子生物学
1.5.1PCR和RT-PCR检测 采集临床出现降蛋鸡只的气管、肝脏、脾脏、肾脏等组织,剪碎、研磨、冻融、离心处理,采用全自动核酸提取试剂盒进行组织DNA和RNA的提取,分别设计鸡传染性支气管炎病毒、新城疫病毒、减蛋综合征病毒、滑液囊支原体、禽流感病毒、坦布苏病毒的引物进行PCR和RT-PCR检测,引物由生工生物工程(上海)股份有限公司合成,引物序列与扩增片段大小以及目的基因见表1。

表1 引物序列和扩增目的片段大小以及目的基因
PCR反应条件为:98℃预变性2 min;98℃变性10 s,60℃退火15 s,72℃延伸1.5 min,共32个循环;72℃延伸5 min。
RT-PCR反应条件为:50℃反转录30 min,95℃预变性3 min;95℃变性30 s,55℃退火35 s,72℃延伸1.5 min,共32个循环;72℃延伸5 min。
PCR扩增产物于1%琼脂糖凝胶电泳检测,使用凝胶成像仪观察和记录结果。
1.5.2坦布苏病毒E基因克隆测序分析 将1.5.1检测疫病中的阳性目的条带进行胶回收,回收产物与pMD18-T载体进行连接,连接产物转化DH5α感受态细胞,在37℃温箱内培养过夜;挑取单个白色菌落,37℃摇床培养8 h以上,经菌液PCR鉴定的阳性菌液,送至生工生物工程(上海)股份有限公司进行测序,将测序结果进行比对分析,序列比对采用MegAlign程序,进化树采用邻接法(MEGA6.0软件)构建。
1.6 病毒分离
1.6.1SPF鸡胚分离 将送检的组织样本剪碎、研磨、冻融、离心(12 000 r/min,10 min)后取上清,经0.22 μm的滤器过滤后,通过绒毛尿囊膜接种9日龄SPF鸡胚,每个鸡胚0.2 mL,每日照胚,若鸡胚死亡,观察胚体变化,收获胚体和尿囊液经处理后继续传代,连传3代;若鸡胚未死亡,则在第6天采集胚体、尿囊液等经处理后继续传代,连传3代。对收取的尿囊液和胚体采用PCR和RT-PCR方法检测鸡传染性支气管炎病毒、新城疫病毒、减蛋综合征病毒、滑液囊支原体、禽流感(H9N2)、坦布苏病毒。
1.6.2细胞分离 采用CEF、DF-1细胞同时进行细胞分离,当细胞长到80%~90%后按2%接种1.6.1中经0.22 μm的滤器过滤后的上清,每日观察细胞病变,当细胞病变达80%以上时收获,进行传代,连传3代;若无细胞病变则每3 d传代1次,连传3代。收取F3代细胞培养上清液采用PCR和RT-PCR方法检测鸡传染性支气管炎病毒、新城疫病毒、减蛋综合征病毒、滑液囊支原体、禽流感(H9N2)、坦布苏病毒。
1.7 血清学检测
1.7.1ELISA检测 采集不同地域的发病鸡群、假定健康群、育成阶段等肉种鸡群的血清,采用坦布苏病毒抗体检测试剂盒进行检测。将待检血清进行10倍稀释,取抗原包被板,将稀释后的血清、阴性对照和阳性对照,按照每孔0.1 mL加入到抗原包被板中,置于37℃温箱中孵育1 h;弃去孔中液体,加入洗涤液0.3 mL,作用3 min,弃去洗涤液,重复3次;每孔加入单克隆抗体0.1 mL,37℃孵育1 h;弃去孔中液体,加入洗涤液0.3 mL,作用3 min,弃去洗涤液,重复3次;每孔加入TMB底物溶液0.1 mL,轻摇2 s,室温下避光显色10 min;每孔加入终止液0.05 mL,置酶标仪上测定各孔D值。
1.7.2HI检测 采集不同地域的不同发病阶段鸡群、假定健康群、育成阶段等肉种鸡群的血清按照兽药典(2015)进行ND、H9、H5 Re-11、H5 Re-12、H7 Re-3抗体的检测,测定发病前后HI抗体变化情况。
1.8 动物回归试验将SPF产蛋鸡采用口服、肌注、点眼的方式感染1.7.1中分离到的F3代坦布苏病毒,每种方式0.4 mL,接种20只;同种方式采用生理盐水设置对照组,在无菌隔离器中饲养,每天统计产蛋及蛋质量情况,连续观察20 d。攻毒组和对照组于攻毒后第7和14天各取2只剖杀,观察剖检病变并采集病料采用RT-PCR方法进行坦布苏病毒的检测,同时在第3,7,14天采集喉头和泄殖腔棉拭子采用RT-PCR方法进行坦布苏病毒的检测。
2 结果
2.1 细菌学检测结果将不同地域送检的组织样本(肝脏、卵巢、输卵管)等病料接种胰蛋白胨大豆琼脂培养基(TSA+血清),培养48 h,无明显细菌生长(表2)。

表2 送检样本细菌分离结果
2.2 分子生物学结果
2.2.1PCR和RT-PCR结果 对临床出现疑似降蛋的肉种鸡群,无菌采集样本(气管、肝脏、脾脏、肾脏)利用PCR和RT-PCR方法进行鸡传染性支气管炎病毒、新城疫病毒、减蛋综合征病毒、滑液囊支原体、禽流感(H9N2)、坦布苏病毒的检测,结果从广东、广西、福建、湖北、江苏等地疑似发病的肉种鸡组织样本中均检测到坦布苏病毒,电泳结果见图1,阳性率为20%~41.6%(表3)。对以上地区育成阶段鸡群采集样本检测坦布苏病毒均为阴性(表4),以上发病群样本与育成阶段未发病群样本均未检测到鸡传染性支气管炎病毒、新城疫病毒、减蛋综合征病毒、滑液囊支原体、禽流感(H9N2)等病毒。

表3 发病鸡群坦布苏病毒检测果 份

表4 育成阶段鸡群坦布苏病毒检测结果 份
2.2.2坦布苏病毒E基因克隆测序分析结果 将坦布苏病毒阳性PCR产物进行克隆测序,与参考毒株(表5)进行比对分析。E基因核苷酸同源性比对结果表明,本研究从肉种鸡上分离到的坦布苏病毒的同源性彼此为97.6%~99.3%,与泰国毒株的同源性最高,为97.0%~98.8%,与中国Ⅰ分支参考毒株的同源性为86.2%~88.3%,与中国Ⅱ分支参考毒株的同源性为86.9%~89.3%,与马来西亚Ⅰ分支参考毒株的同源性为87.4%~88.9%,与马来西亚Ⅱ分支参考毒株的同源性为86.1%~88.7%(表6)。进化树分析发现,本研究分离到的坦布苏病毒单独处于一个亚分支,并与泰国参考毒株处于一个大分支,与马来西亚和中国参考毒株分别属于不同的分支(图2)。

图2 坦布苏病毒E基因核苷酸进化树分析

表5 本研究所用坦布苏病毒参考序列

表6 本研究分离的坦布苏病毒与参考毒株核苷酸同源性 %

M.DL2000的Marker;6,11,12,16,21,24,27,29,33,36,40,42,44,45,50,54,62,64,68,69,73,77号.样本为阳性;80号.为阴性对照;81号.为阳性对照。图1 坦布苏病毒电泳结果
2.3 病毒分离结果
2.3.1SPF鸡胚分离结果 送检组织接种9日龄SPF鸡胚,F1代部分鸡胚在接种5 d后出现死亡,随着培养代次的增加,鸡胚死亡时间逐步提前(表7)。观察胚体变化,死亡鸡胚胚体发育小、充血,爪子干瘪僵挺,绒毛尿囊膜发白增厚(图3)。分别收取胚体和尿囊液,采用PCR和RT-PCR方法检测鸡传染性支气管炎病毒、新城疫病毒、减蛋综合征病毒、滑液囊支原体、禽流感(H9N2)、坦布苏病毒,结果F1-F3代中胚体和尿囊液均检测到坦布苏病毒阳性,未检测到鸡传染性支气管炎病毒、新城疫病毒、减蛋综合征病毒、滑液囊支原体、禽流感(H9N2)。
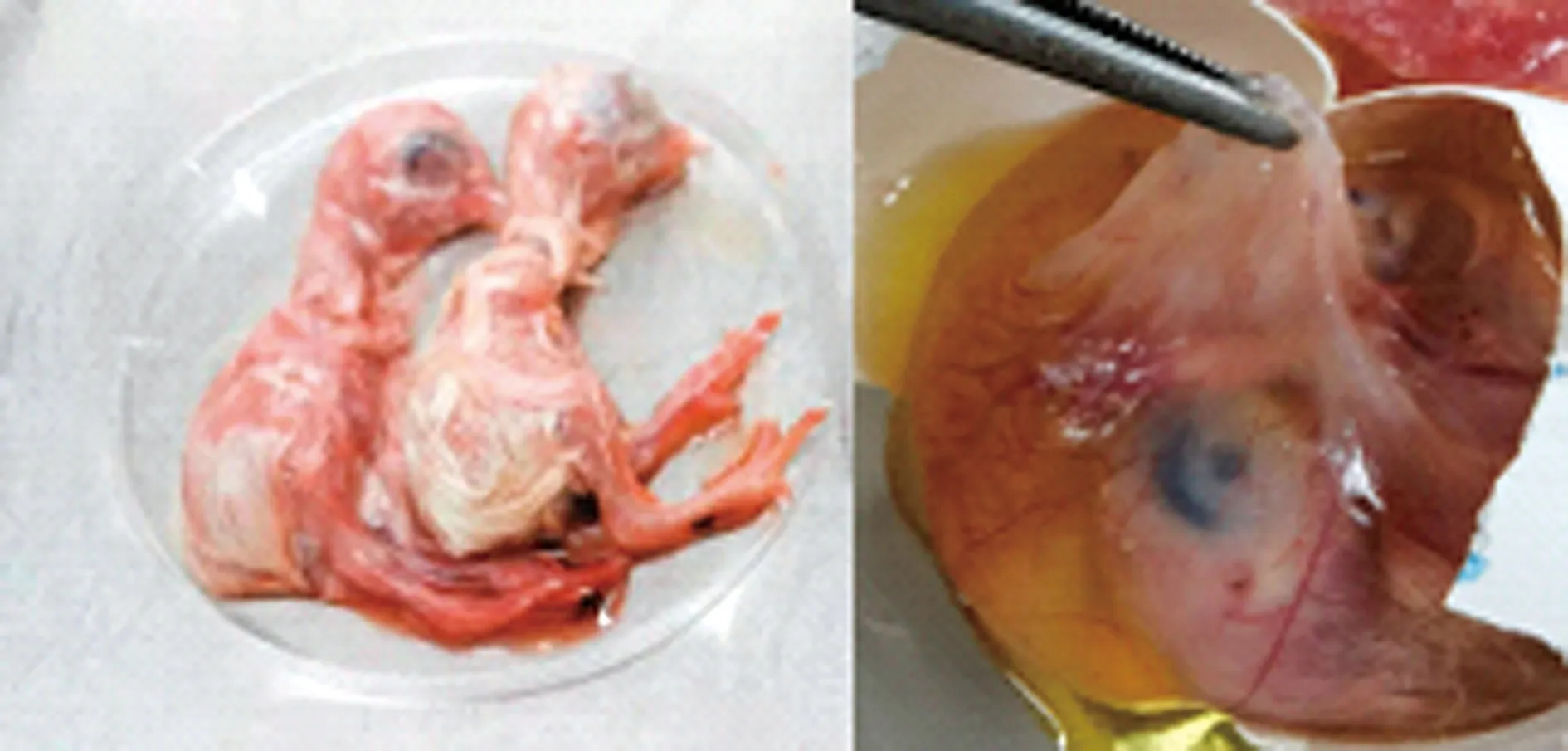
图3 胚体病变(左)及绒毛尿囊膜病变(右)

表7 SPF鸡胚病毒分离结果
2.3.2细胞分离 将送检样本接种DF-1细胞,结果DF-1细胞在接种96 h后出现病变,细胞聚堆,圆缩,死细胞增多,随着病变增多,细胞裂解(图4)。对F3代细胞培养液采用PCR和RT-PCR方法检测传染性支气管炎病毒、新城疫病毒、减蛋综合征病毒、滑液囊支原体、禽流感(H9N2)、坦布苏病毒,结果除检测到坦布苏病毒阳性外,其他均为阴性。
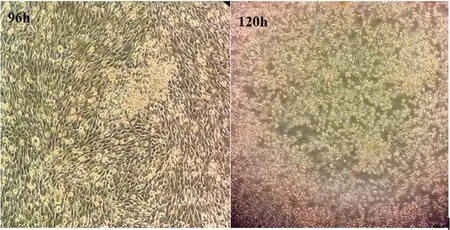
图4 培养96 h后(左)及120 h后(右)的细胞病变
2.4 血清学结果
2.4.1ELISA检测结果 采用ELISA检测方法,对疑似降蛋鸡群采集血清进行坦布苏病毒抗体的检测,结果显示坦布苏病毒抗体阳性率为6.67%~32.6%(表8);同时采集以上地区场内假定健康群与育成阶段鸡群血清,坦布苏病毒抗体显示阳性率明显偏低,为0~6.6%(表9,10)。

表8 发病肉种鸡群坦布苏病毒抗体结果 份

表9 假定健康群肉种鸡群坦布苏病毒抗体结果 份

表10 育成阶段肉种鸡群坦布苏病毒抗体结果 份
2.4.2HI结果 采用HI检测方法,对送检的不同时间段发病群血清样本进行检测,结果ND、H9、H5 Re-11、H5 Re-12、H7 Re-3等抗体无显著变化,无异常。
2.5 动物回归试验结果将分离到的坦布苏病毒感染SPF产蛋鸡,结果攻毒组在攻毒后第1~8天的产蛋量明显低于对照组,并于攻毒后第9~20天停止产蛋,对照组产蛋正常(图5)。

图5 试验期间攻毒组和对照组产蛋情况
与第7和14天每组各解剖2只,显示攻毒组和对照组均无明显病理病变,分别采集攻毒组鸡只各组织进行带毒分析,结果显示攻毒后7 d除了气管与肺脏检测阴性外其他组织均检测到坦布苏病毒,攻毒后14 d各组织均未检测到坦布苏病毒(表11)。

表11 各组织带毒情况
在攻毒后第3,7,14天分别采集喉头和泄殖腔棉拭子进行坦布苏病毒的检测,结果显示第3天喉头与泄殖腔检测坦布苏病毒均为阴性,第7天喉头和泄殖腔多数检测到坦布苏病毒阳性(阳性率80%~100%),第14天喉头和泄殖腔拭子均为阴性(表12),与组织中坦布苏病毒带毒规律一致。

表12 攻毒期间鸡群排毒情况
整个试验期间对照组和攻毒组鸡群均未出现明显症状,且攻毒组蛋壳、蛋黄、蛋清质量与对照组无明显差异(图6,7)。

1,2号.为对照组鸡蛋;3~5号.为攻毒组图6 对照组和攻毒组蛋壳质量

01.为对照组;04.为攻毒组图7 对照组和攻毒组蛋黄、蛋清质量
3 结果
坦布苏病自2010年暴发以来,给我国养禽业特别是水禽业造成了重大损失,随着疫苗的研究、开发、应用,在蛋鸭、种鸭方面取得明显防控效果,但对临床以共济失调、瘫痪、神经症状为主要特征的商品群如肉鸭、肉鹅等仍有较大危害。随着坦布苏病毒易感宿主范围的扩大,近年来蛋鸡群特别是肉种鸡群感染坦布苏病毒报道逐渐增多,对家禽的危害也逐渐凸显[7-9]。
本研究首次从我国出现产蛋下降的肉种鸡中分离到坦布苏病毒,通过动物回归试验发现,坦布苏病毒能够造成鸡群明显降蛋,证明坦布苏病毒是造成本次肉种鸡群产蛋下降的主因;通过测序分析可见肉种鸡中分离到的坦布苏病毒与泰国毒株亲缘关系较近(97.0%~98.8%),与我国水禽流行毒株亲缘关系较远(86.2%~89.3%);通过病原学与血清学检测可见,发病鸡群坦布苏病毒抗体转阳率显著(6.67%~32.6%),假定健康鸡群与育成阶段鸡群坦布苏病毒抗体个别出现转阳情况(0~6.6%),但并没有病原阳性检出,仍需通过大量流调数据佐证,同时确定血液循环抗体对开产后鸡群的保护率;通过临床病原学检测并结合SPF蛋鸡攻毒试验排毒规律可见,消化系统、生殖系统坦布苏病毒检出率相对偏高,带毒时间为7~10 d,同时结果也显示攻毒14 d后剖检鸡只未检测到坦布苏病毒阳性且鸡群不再排毒,但产蛋率未恢复,故坦布苏病毒感染鸡群后是间歇性排毒还是一过性排毒,仍需进一步探讨研究。
坦布苏病毒为黄病毒科黄病毒属成员,多以节肢动物(如蚊和脾等)为传播媒介[10],由于易感品种的宽泛,新型坦布苏病毒在不同家禽品系中抗体阳性率、临床表症相关性、带毒排毒率、临床危害程度等仍需通过相关流调工作进一步研究以确定感染规律,密切关注坦布苏病毒的跨种感染规律也具有重要的公共卫生学意义。随着坦布苏病毒危害性加大,加强对不同易感宿主坦布苏病毒的分离鉴定及其遗传变异等研究对于该病的监测和防控具有重要意义。
