PRRSV感染原代和传代PAM的比较转录组学分析
2021-12-23周艳荣郝婉君柯文婷肖少波方六荣
周艳荣,郝婉君,卫 莹,李 洋,柯文婷,肖少波,方六荣
(华中农业大学 动物医学学院 农业微生物学国家重点实验室,湖北 武汉 430070)
猪繁殖与呼吸综合征(porcine reproductive and respiratory syndrome,PRRS)是由PRRSV引起的严重危害养猪业发展的传染病之一,主要表现为母猪繁殖障碍、新生仔猪死亡和生长猪呼吸道疾病,给养猪业造成了巨大的经济损失[1]。当前,PPRS普遍通过疫苗免疫的方式进行防控,但PRRSV变异速度快,新毒株的不断出现与演化增加了PRRSV的多样性和复杂性,给本病的防控带来了巨大困难和更多的挑战。因此,深入研究PRRSV与宿主的相互作用机制,挖掘调控PRRSV增殖的新型宿主蛋白,进一步解析PRRSV的致病机理,对PRRS的防制有重要的指导意义。
PRRSV的主要靶细胞为巨噬细胞,其中原代猪肺泡巨噬细胞(PAM)被广泛应用于PRRSV研究。由于PAM的分离过程较为繁琐,不能传代,且存在较强的异质性,导致了其应用的局限性,因此需要替代PAM的传代细胞系。目前已有研究人员通过SV40大T抗原敲除PAM的抑癌基因,从而将其永生化,但却导致PRRSV受体CD163的表达模式发生改变,因此不支持PRRSV感染[2]。在此基础上,LEE等[3]通过外源导入猪源CD163,获得了对PRRSV易感的传代PAM细胞系。另外,CALVERT等[4]利用PB转座系统将外源CD163导入PAM,也成功获得了传代PAM细胞系。但以上细胞系的CD163均是外源性的,与原代PAM仍存在较大的差异。为了解决这个问题,在通过SV40大T抗原永生化PAM后,王同云等[5]利用流式细胞术筛选得到了高表达CD163的细胞株,并命名为传代猪肺泡巨噬细胞(IPAM)。试验表明IPAM保留了PAM对PRRSV的高度易感性,且感染率高于PAM。与其他PAM传代细胞系比较[1-4,6],IPAM的优点在于其CD163来源于母细胞。因此,IPAM可能是一种优良的PAM替代细胞模型,但是目前并不清楚两者在PRRSV感染时是否存在应答差异。
转录组测序技术能够获得特定状态下转录本的结构、数量等信息[7],在PRRSV的研究中应用广泛,如利用转录组测序技术揭示PRRSV感染诱导宿主免疫应答的分子细节[8-9];研究PRRSV编码蛋白的功能[10];比较PRRSV不同毒株的致病性以及分析其与宿主的互作机制[11-12];筛选抗PRRSV猪[13];评估PRRSV疫苗的免疫效果等[14-15]。但对PRRSV感染原代和传代PAM后转录谱的比较研究尚未见报道。
本研究通过比较转录组学技术,一方面探索PRRSV对IPAM易感性高于PAM的原因,以期发现调控PRRSV增殖的关键因子;另一方面比较PAM和IPAM在感染PRRSV后的应答差异性和相似性,为PAM传代细胞系在科学研究中的实用性和真实性提供理论依据。
1 材料与方法
1.1 细胞和病毒PAM为本实验室分离并保存,IPAM由哈尔滨兽医研究所蔡雪辉教授惠赠。PAM和IPAM均在含10%胎牛血清(FBS,PAN-Seratech)的RPM-1640培养基(Hyclone)中,于37℃和5% CO2条件下培养。PRRSV WUH3株为本实验室分离并保存。
1.2 主要试剂PRRSV N蛋白的单克隆抗体由本实验室制备并保存;绿色荧光(Alexa Fluor 488)标记驴抗小鼠IgG购自Jackson ImmunoResearch公司;细胞核荧光染料DAPI购自碧云天生物技术有限公司;总RNA提取试剂Trizol购自Omega公司;反转录试剂盒购自Roche公司;Real-time PCR试剂(SYBRTMGreen PCR Master Mix)购自Applied Biosystems公司。
1.3 主要软件及生物学数据库主要软件有:HISAT2比对软件、IGV软件、StringTie软件、subread软件、Cytoscape软件和DESeq2软件;分子生物学分析软件包括:DNAman、DNAuser、Primer 5.0、Graphpad Prism、Image J、ViiATM7 system、FV10-ASW 3.1 Viewer和Image Lab等。
生物学数据库:Biomart数据库、CDD数据库、Ensembl数据库、GO数据库、KEGG数据库、NCBI COG/KOG数据库、STRING数据库、Uniprot数据库和AnimalTFDB数据库。
1.4 PRRSV一步生长曲线的绘制将PRRSV WUH3株(MOI=10)分别接种PAM和IPAM,于接种后0,6,9,12,15,18,21,24,36 h分别收集病毒悬液,参照文献[16]的方法测定PRRSV的TCID50,从而绘制一步生长曲线。
1.5 间接免疫荧光试验(IFA)检测PRRSV感染率将PRRSV(MOI=10)分别接种PAM和IPAM,同时设置未接毒的空白对照。分别于接毒后6,9,12,15 h固定细胞,参照文献[16]的方法,通过间接免疫荧光试验分别检测PRRSV在PAM和IPAM中的感染率,其中一抗和二抗分别为PRRSV N蛋白的单克隆抗体和绿色荧光标记驴抗小鼠IgG。
1.6 转录组测序样品的准备共设置4组:PRRSV(MOI=10)感染的PAM组(PAMv)和IPAM组(IPAMv)、未接种PRRSV的PAM对照组(PAMm)和IPAM对照组(IPAMm),每组3个重复。PRRSV感染PAM和IPAM 12 h后,通过Trizol法提取总RNA,用于转录组测序。
1.7 建库测序与数据分析对检测合格的RNA样品进行建库测序,由北京诺禾致源科技股份有限公司完成;数据质控合格后,对表达水平进行定量,然后以FDR校正的padj < 0.05且|log2(FoldChange)| > 1.5作为差异表达基因的筛选标准,统计各组间差异表达基因,进行后续分析。
1.8 实时荧光定量PCR验证转录组学数据荧光定量PCR引物如表1。

表1 本研究中所用的荧光定量PCR引物
2 结果
2.1 PRRSV在PAM和IPAM中的感染动力学分析
2.1.1PRRSV感染PAM和IPAM的一步生长曲线 将PRRSV(MOI=10)分别接种PAM和IPAM,于感染后0,6,9,12,15,18,21,24,36 h收集病毒悬液,测定TCID50,绘制一步生长曲线。结果发现PRRSV在PAM和IPAM中的增殖曲线相似,但在感染早期(15 h前),PRRSV在PAM中的增殖滴度低于IPAM,并以感染后12 h的差异最为显著,而在感染中晚期(15 h后)无明显差异(图1A)。
2.1.2PRRSV在PAM和IPAM上的感染率 将 PRRSV(MOI=10)分别接种PAM和IPAM,同时设置未接毒的空白对照组(Mock),利用间接免疫荧光试验(IFA)比较了感染早期PRRSV在2种细胞中的感染率。结果显示,在感染早期,PRRSV在IPAM中的感染率明显高于PAM(图1B,C,D)。

A.PRRSV感染PAM和IPAM的一步生长曲线;B.IFA检测PRRSV在PAM中的感染情况;C.IFA检测PRRSV在IPAM中的感染情况;D.PRRSV在PAM和IPAM中的感染率统计图1 PRRSV在PAM和IPAM中的感染动力学
2.2 差异表达基因的筛选结合感染动力学差异分析结果,选取PRRSV感染后12 h的PAM和IPAM,进行转录组测序分析。主成分分析(PCA)结果显示,各组组内样本均相对集中,说明样本的重复性较好;同时发现,IPAMv与IPAMm之间的主成分差异较PAMv与PAMm之间的主成分差异大,说明PRRSV感染对IPAM基因表达模式的影响大于PAM(图2A)。利用DESeq2软件进一步对转录组数据进行统计学分析,分别比较PAMv与PAMm、IPAMv与IPAMm之间mRNA表达量的差异,并以FDR校正的padj < 0.05且|log2(FoldChange)| > 1.5作为差异表达基因的筛选标准,统计各组间差异表达基因的数量。如图2B~D所示,与未感染组(IPAMm)比较,PRRSV感染IPAM(IPAMv)后共产生4 316个差异表达基因,其中上调和下调的差异表达基因分别为2 578,1 738个;与未感染组(PAMm)比较,PRRSV感染PAM(PAMv)后共得到1 285个差异表达基因,其中上调和下调的差异表达基因分别为812,473个。PRRSV感染2种细胞后产生了315个共有差异表达基因,其中上调和下调的差异表达基因分别为159,25个。
2.3 差异表达基因的GO功能注释和KEGG信号通路富集分析采用clusterProfiler软件对PRRSV感染PAM和IPAM后的差异表达基因进行GO分析,结果发现PAM中的差异表达基因主要调控免疫系统进程(immune system process)、免疫应答(immune response)和去磷酸化(dephosphorylation)等生物过程(BP),主要分布于细胞外区域(extracellular region)和中间纤维(intermediate filament)等细胞组分(CC)中,主要与细胞因子活性(cytokine activity)和受体结合(receptor binding)等功能分子(MF)相关(图3A);IPAM中的差异表达基因主要调控囊泡介导转运(vesicle mediated transport)和有机酸代谢过程(organic acid metabolic process)等生物过程,主要分布于细胞质(cytoplasm)和蛋白质复合体(protein complex)等细胞组分中,主要与氨酰基-tRNA连接酶(aminoacyl t-RNA ligase)和连接酶活性-形成碳氧键(ligase activity,forming carbon-oxygen bonds)等功能分子相关(图3B)。将PRRSV感染PAM和IPAM后的差异表达基因进行KEGG信号通路富集分析,结果表明PAM中的差异表达基因优先富集在细胞因子受体相互作用(cytokine-cytokine receptor interaction)、轴突导向(axon guidance)、MAPK和TNF等免疫相关信号通路(图3C);IPAM中的差异表达基因优先富集到脂肪酸代谢(fatty acid metabolism)、三羧酸循环(TCA circle)、IL-17、蛋白运输(protein export)和碳代谢(carbon metabolism)等代谢相关信号通路(图3D)。以上结果提示,PAM的免疫相关差异表达基因多于IPAM,而IPAM的代谢相关差异表达基因多于PAM。
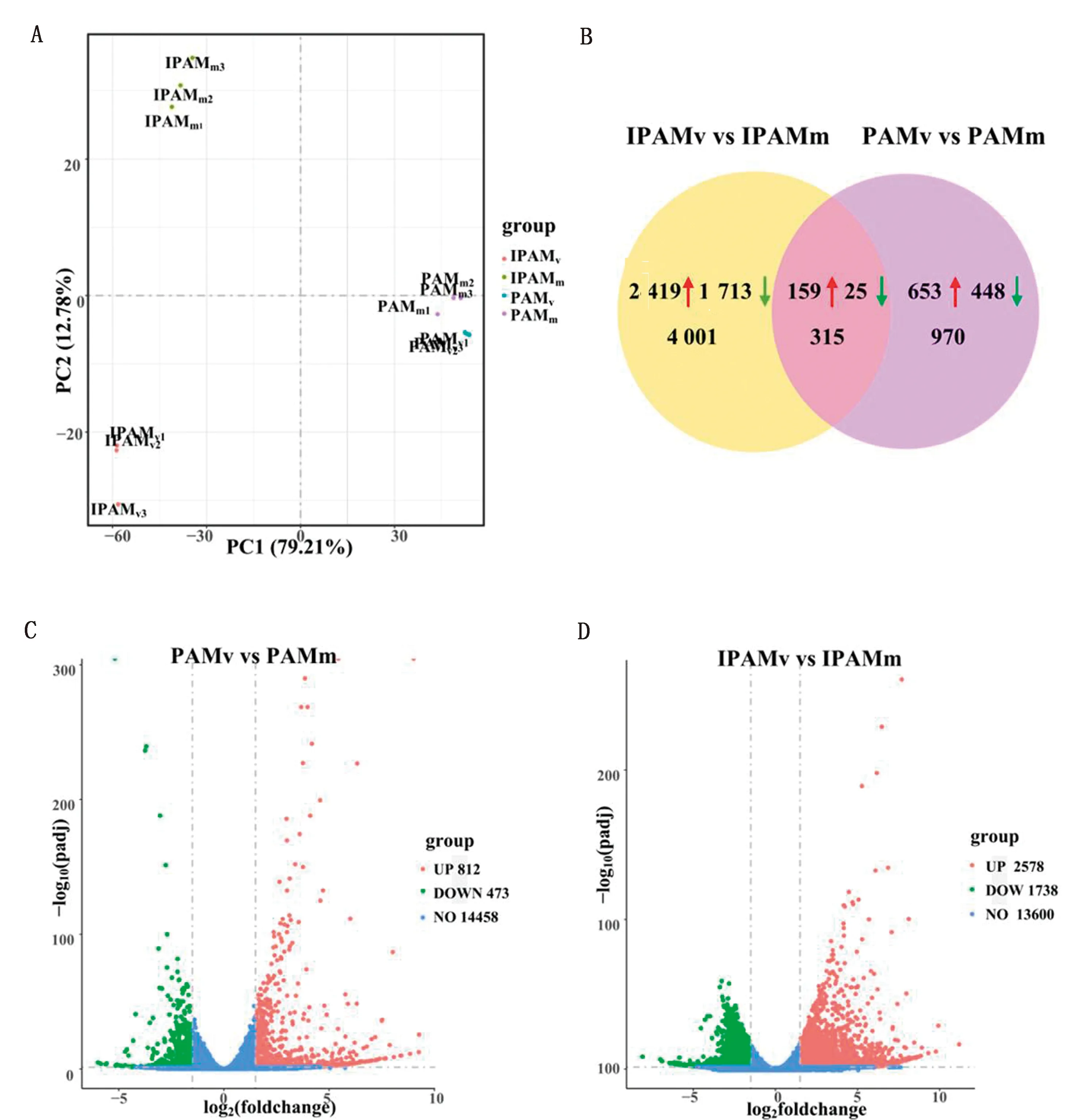
A.PAM和IPAM的主成分分析; B.PRRSV感染PAM和IPAM的差异表达基因数量;C.PRRSV感染PAM的差异表达基因火山图;D.PRRSV感染IPAM的差异表达基因火山图图2 PAM和IPAM差异表达基因的总体分析
2.4 PAM和IPAM共有和特有差异表达基因的GO和KEGG富集分析为了探讨PRRSV感染PAM和IPAM后差异表达基因的相似性和差异性,对2种细胞共有和特有的差异表达基因进行筛选,并进一步对其进行GO和KEGG富集分析。
GO功能注释发现,2种细胞共有的差异表达基因优先富集到免疫应答(immune response)、免疫系统进程(immune system process)和水解酶活性调控(regulation of hydrolase activity)等生物过程;优先富集到细胞黏附(cell adhesion)和细胞外区域(extracellular region)等细胞组分;优先富集到细胞因子活性(cytokine activity)、细胞因子受体结合(cytokine receptor binding)和受体结合(receptor binding)等功能分子(图4A)。

A.PAM差异表达基因的GO功能分析; B.IPAM差异表达基因的GO功能分析;C.PAM差异表达基因的KEGG信号通路富集分析;D.IPAM差异表达基因的KEGG信号通路富集分析图3 PAM和IPAM差异表达基因的GO和KEGG富集分析
KEGG富集分析发现,2种细胞共有的差异表达基因优先富集到TNF、MAPK、IL-17等免疫相关信号通路;PAM特有的差异表达基因优先富集到花生四烯酸代谢(arachidonic acid metabolism)、细胞因子受体互作(cytokine-cytokine receptor interaction)和MAPK等信号通路,IPAM特有的差异表达基因优先富集到脂肪酸代谢(fatty acid metabolism)、脂肪酸降解(fatty acid degradation)、缬氨酸/亮氨酸/异亮氨酸降解(valine,leucine and isoleucine degradation)等代谢相关信号通路(图4B)。

A.PAM和IPAM共有差异表达基因的GO功能分析;B.PAM和IPAM特有和共有(Intersection)差异表达基因的KEGG富集分析图4 PAM和IPAM特有和共有差异表达基因的GO和KEGG富集分析
2.5 引起PAM和IPAM中PRRSV感染率差异的潜在机制分析
2.5.1细胞周期相关基因 研究表明,细胞周期相关基因参与调控PRRSV增殖[17]。对2种细胞中细胞周期相关的差异表达基因进行统计分析,发现PRRSV感染IPAM后,大部分与细胞周期相关的基因下调表达,如在细胞周期调控中发挥重要作用的BUB1B(mitotic checkpoint serine/threonine kinase B)、BUB3(mitotic checkpoint protein)、CDK2(cyclin-dependent kinase 2)和HDAC1(histone deacetylase 1)等基因(图5A),而在PAM中这些基因大多上调表达,说明PRRSV感染IPAM后可能通过细胞周期阻滞积极调控PRRSV增殖,从而导致比PAM更高的感染率。
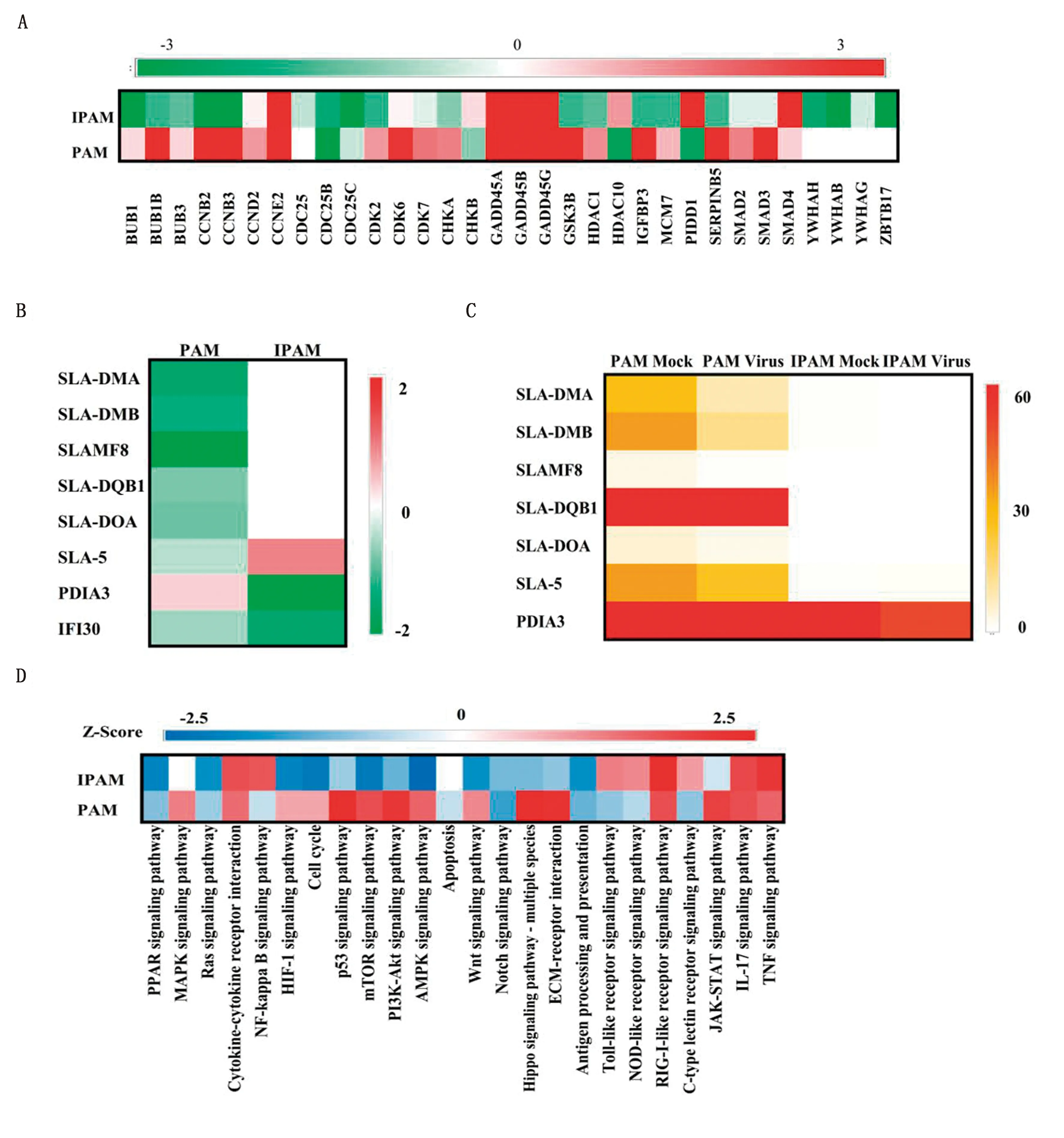
A.细胞周期相关差异表达基因的分析; B.抗原递呈相关差异表达基因的表达趋势;C.抗原递呈相关差异表达基因的表达丰度; D.免疫相关信号通路分析图5 PAM和IPAM中差异表达基因的功能及免疫相关信号通路分析
2.5.2抗原递呈相关基因 猪源MHC(major histocompatibility complex)分子也被称为SLA(swine leukocyte antigen)分子,在抗原递呈过程中发挥关键作用。对PRRSV感染2种细胞后产生的差异表达基因进行分析,发现PRRSV感染PAM后,MHC-Ⅰ类和MHC-Ⅱ类分子(SLA-DMA、SLA-DMB、SLAMF8、SLA-DQB1、SLA-DOA和SLA-5)以及参与调控抗原加工和递呈过程的IFI30(lysosomal thiol reductase)均下调表达;而在IPAM中,只有IFI30以及参与细胞信号转导、MHC组装、T细胞TCR信号通路调控等多种生物学过程的PDIA3(protein disulfide isomerase family A member 3)下调表达,SLA分子并无显著变化(图5B)。进一步对2种细胞中SLA分子的表达丰度进行统计分析,结果显示无论是否接种PRRSV,在IPAM中均未检测到SLAMF8、SLA-DQB1和SLA-DOA的表达,SLA-DMA、SLA-DMB和SLA-5的表达丰度均极低,PDIA3在IPAM中的表达丰度也显著低于PAM(图5C)。以上结果说明,抗原递呈相关基因在IPAM中的缺失或者低丰度表达可能导致IPAM中的免疫应答反应较弱,最终PRRSV能够建立更高的感染率。
2.5.3免疫相关信号通路的分析 运用生物通路分析法(IPA),对PRRSV感染2种细胞后免疫相关信号通路的差异性进行了分析。IPA结果显示mTOR、PI3K-Akt、AMPK、Wnt、Hippo、Toll-like receptor和NOD-like receptor等信号通路相关基因在PAM和IPAM中存在相反的表达趋势(图5D)。这进一步说明PRRSV感染PAM和IPAM后存在免疫应答差异,从而导致PRRSV在2种细胞中的感染率差异。
2.6 差异表达基因的验证随机挑选出11个差异表达基因,包括LIF(leukemia inhibitory factor)、CXCL10(C-X-C motif chemokine ligand 10)、CDC25B(cell division cycle 25B)、TRIM65(tripartite motif containing 65)、CH25H(cholesterol 25-hydroxylase)、TNFAIP3(TNF alpha induced protein 3)、CD74(major histocompatibility complex class Ⅱ invariant chain)、RELB(RELB proto-oncogene,NF-kB subunit)、TRAF2(TNF receptor associated factor 2)、E2F2(E2F transcription factor 2)和CCL20(C-C motif chemokine ligand 20),通过实时荧光定量PCR(qRT-PCR)分别检测PRRSV感染PAM和IPAM后,对其mRNA水平的影响。结果显示,qRT-PCR结果和转录组测序(RNA-Seq)结果趋势一致(图6)。
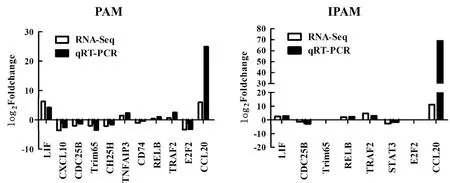
图6 实时荧光定量PCR验证差异表达基因
3 讨论
PRRSV引起的PRRS自暴发以来给全球养猪业带来了巨大的经济损失[18]。PRRSV感染的靶细胞是巨噬细胞,其中PAM是开展PRRSV体外研究的最佳细胞模型。但PAM不能传代,因此亟需 PAM的替代细胞系。目前已有多株PAM的传代细胞系被报道,但PRRSV受体基因均是外源导入的[10],而IPAM中的PRRSV受体CD163来源于母细胞(PAM),避免了外源基因插入导致的潜在副作用。
天然免疫反应在宿主抵抗病毒感染中发挥重要作用。通过与Innate DB中的免疫相关参考基因库比对,发现PRRSV感染PAM和IPAM后大部分的共有免疫相关差异表达基因的表达趋势相同,说明2种细胞在PRRSV感染后的免疫应答具有一定程度上的相似性。另外,有少部分基因呈现相反的表达趋势,如CD209、CD27和HERP(homocysteine-inducible ER stress protein)等(数据未显示)。其中,CD209基因与先天免疫系统相关,且编码跨膜受体,可识别包括寄生虫和病毒在内的多种病原体[19-20]。研究表明,逆转录病毒(人类免疫缺陷病毒(HIV)、猿免疫缺陷病毒和猫免疫缺陷病毒)、黄病毒科病毒(登革热病毒、西尼罗河病毒和丙型肝炎病毒(HCV))和丝状病毒科病毒(埃博拉病毒和马尔堡病毒)等囊膜病毒均可利用CD209作为病毒的识别和黏附受体,进而促进病毒感染[21-23]。CD209也是PRRSV的潜在受体之一[24]。本研究发现,PRRSV感染IPAM后上调CD209的mRNA水平,这可能是IPAM中PRRSV感染率较高的原因之一。
CD27是一种共刺激免疫检查点受体,其配体CD70属于肿瘤坏死因子(TNF)配体家族。CD27-CD70在病原微生物的感染过程中发挥双重作用,在感染早期促进机体的免疫应答,抵抗病原微生物的感染;在感染晚期破坏机体产生的抗体,导致免疫缺陷。CD27-CD70在抗病毒免疫反应中也发挥着重要作用[25]。在本研究中发现,PRRSV感染PAM后上调CD70的mRNA水平,而感染IPAM后下调CD70的mRNA水平,这是否会导致PRRSV在2种细胞中的增殖差异也是值得进一步探讨的。
HERP是内质网应激诱导表达的内质网膜蛋白,通过促进Ⅰ型干扰素(IFN-α和IFN-β)和Ⅲ型干扰素(IFN-λ1)表达发挥广谱抗病毒作用,能够抑制肠道病毒71型、仙台病毒、甲型流感病毒和水疱性口炎病毒等多种RNA病毒的增殖[26]。PRRSV为单股正链RNA病毒,且对干扰素敏感。本研究发现,在PAM中PRRSV上调表达HERP,而在IPAM中下调表达HERP,说明HERP的差异表达可能是导致PRRSV在PAM中感染率较低的因素之一,但仍需要进一步的实验验证。
值得注意的是,趋化因子类基因在IPAM中严重缺失。趋化因子在免疫细胞发育、定位及免疫应答过程中发挥重要作用,能在宿主细胞内形成快速且直接的抗病毒反应,从而抵抗病原微生物的感染。此外,部分趋化因子也可作为病原微生物进入宿主细胞的辅助受体[23]。因此,趋化因子在病毒感染过程中发挥复杂且重要的作用。如CCL3L1低表达的人群对乙型肝炎病毒、HCV和HIV更易感[27-30]。本研究发现,在PAM中CCL3L1的表达丰度最高,且PRRSV感染显著上调CCL3L1的mRNA水平;而在IPAM中,无论是否感染PRRSV,均未检测到CCL3L1的表达。那么,CCL3L1的缺失是否导致IPAM对PRRSV更易感?这个问题值得进一步研究和探讨。
本研究通过转录组学技术,比较了PRRSV感染PAM和IPAM后宿主应答的差异性和相似性,为PAM传代细胞系在PRRSV相关研究中的使用提供了理论依据;并分析了PRRSV在IPAM中感染率高于PAM的可能原因,发现了调控PRRSV增殖的潜在宿主基因,为抗病毒研究提供了新思路。
