冠状动脉慢性完全闭塞合并分叉病变介入干预策略及围术期并发症分析
2021-12-17郭云飞彭红玉赵烨婧柳景华
郭云飞 彭红玉 赵烨婧 柳景华
在冠状动脉分叉病变行经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)过程中,如何保持分支正常血流是一项技术挑战。常规病变PCI术中分支闭塞比例为4.5%~26.0%,分支闭塞可能会导致围术期急性心肌梗死,进而诱发心力衰竭、心律失常,甚至危及患者生命[1-4]。冠状动脉慢性完全闭塞(chronic total occlusion,CTO)病变合并分叉病变发生率高达25.8%~47.0%,其介入治疗复杂性和围术期风险则更进一步增加[5-8]。除了斑块移行和界嵴移位等影响分支血流因素,CTO病变介入过程中导丝进入纤维帽后走行于内膜下,引起冠状动脉夹层及血肿,可能是导致分支血流减慢甚至闭塞的主要因素之一。CTO合并分叉病变行PCI过程中分支保护策略相关报道较少。本研究旨在分析CTO合并分叉病变PCI术后出现分支闭塞的预测因素,探讨分支保护策略,并评估分支闭塞与围术期并发症的关系。
1 对象与方法
1. 1 研究对象
本研究为前瞻性队列研究,从2015年1月至2018年7月于首都医科大学附属北京安贞医院心内科行PCI的3472例患者中,根据入选标准和排除标准,筛选出CTO病变行PCI的患者675例,从中连续入选CTO合并分叉病变患者245例,其中男213例(86.9%),平均年龄(58.0±11.2)岁。入选标准:(1)CTO-PCI术后即刻获得造影成功患者;(2)CTO闭塞段近端或远端5 mm范围内存在直径≥2.0 mm分支;(3)年龄18~80岁;(4)签署知情同意书。排除标准:(1)急性心肌梗死(<1个月);(2)纽约心脏病协会(New York Heart Association,NYHA)心功能分级Ⅳ级。根据介入术中及术后分支血流情况,将245例患者分为闭塞组[分支的心肌梗死溶栓治疗试验(thrombolysis in myocardial infarction,TIMI)血流分级<Ⅲ级,21例]和非闭塞组(分支的TIMI血流分级Ⅲ级,224例)。PCI术中任何时间点或术后即刻出现分支TIMI血流分级<Ⅲ级,均归为分支闭塞组。即使术中发现分支闭塞,采用球囊扩张或支架置入等补救措施,术后即刻分支恢复TIMI血流分级Ⅲ级的患者,同样归为分支闭塞组。
1. 2 研究方法
所有患者在术前完善血常规、生化、肌钙蛋白、超声心动图等检查,并接受双联抗血小板治疗。入组患者经桡动脉和(或)股动脉入径行PCI。穿刺成功后,所有患者均接受肝素100 IU/kg或比伐芦定0.75 mg/kg负荷剂量并在PCI过程中维持1.75 mg/(kg · h)。术中每30 min检测1次活化凝血时间使其保持300 s以上,必要时可临时追加肝素20 IU/kg或比伐芦定0.3 mg/kg,术后维持使用比伐芦定4 h。仔细研读冠状动脉造影资料,若有必要,可同时进行双侧造影。由术者决定采用正向或逆向开通CTO策略及分叉病变处理策略。术后所有患者均接受阿司匹林(100 mg、每日1次)联合氯吡格雷(75 mg、每日1次)或替格瑞洛(90 mg、每日2次)治疗。术后48 h所有患者复查肌酸激酶-同工酶、肌钙蛋白、血红蛋白和血清肌酐。使用专用的分叉软件CAAS工作站(5.10版;Pie Medical Imaging B.V.)进行定量冠状动脉分析(图1)。测量的参数包括参考血管直径、参考血管狭窄的百分比、病变长度以及冠状动脉主支和分支之间的角度。
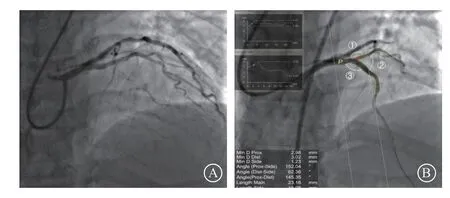
图1 冠状动脉血管造影和定量冠状动脉分析 A.左前降支中段的慢性完全闭塞,纤维帽近端有粗大对角支发出;B. 二维定量冠状动脉分析的结果,①Angle(Prox-Side):近端主支和分支夹角;②Angle(Dist-Side):远端主支和分支夹角;③Angle(Prox-Dist):主支近端和远端夹角
1. 3 定义
CTO定义为冠状动脉完全闭塞3个月以上,且远端血流为TIMI分级0级[9]。同侧桥侧支可以向闭塞段远端提供正向血流,被误认为是功能性闭塞。这需要通过多角度造影,对闭塞血管逐帧读图来仔细鉴别。采用日本多中心CTO注册评分(multicenter CTO registry of Japan,J-CTO)评估CTO病变的复杂性[10]。CTO合并分叉病变定义为CTO病变近端或远端纤维帽5 mm范围内存在重要分支(直径≥2.0 mm)。使用Medina分型评估基线处的分叉解剖[11]。分叉类型被分为真性分叉[包括Medina(1,1,1)、(1,0,1)和(0,1,1)]和非真性分叉[Medina(1,1,0)、(1,0,0)、(0,1,0)和(0,0,1)]。围术期并发症包括全因死亡、急诊冠状动脉旁路移植术、冠状动脉穿孔、围术期心肌梗死、对比剂肾病和大出血。围术期心肌梗死定义为介入术后肌钙蛋白升高超过正常上限的3倍。冠状动脉穿孔定义为需要紧急治疗的穿孔,包括采用球囊封堵、覆膜支架置入、心包穿刺术和栓塞治疗(包括弹簧圈、脂肪、明胶海绵等)。 对比剂肾病定义为PCI后48 h血肌酐水平较基线水平增加0.5 mg/dl或25%以上。大出血定义为BARC分型3、4或5型出血事件[12]。
1. 4 统计学分析
所有数据采用SPSS 25软件进行分析,计量资料以均数±标准差(±s)表示,组间比较采用两独立样本t检验或Mann-WhitneyU检验。计数资料以例数和百分比表示,组间比较,预期频率≥5采用χ2检验;否则,采用Fisher确切概率检验。多因素分析采用logistic回归模型。以P<0.05为差异有统计学意义。
2 结果
2. 1 两组患者基线临床资料
闭塞组和非闭塞组患者性别、年龄、左心室射血分数、闭塞时间、既往心血管病史及心血管疾病危险因素(如吸烟、高血压病、糖尿病、高脂血症等)比较,差异均无统计学意义(均P>0.05,表1)。
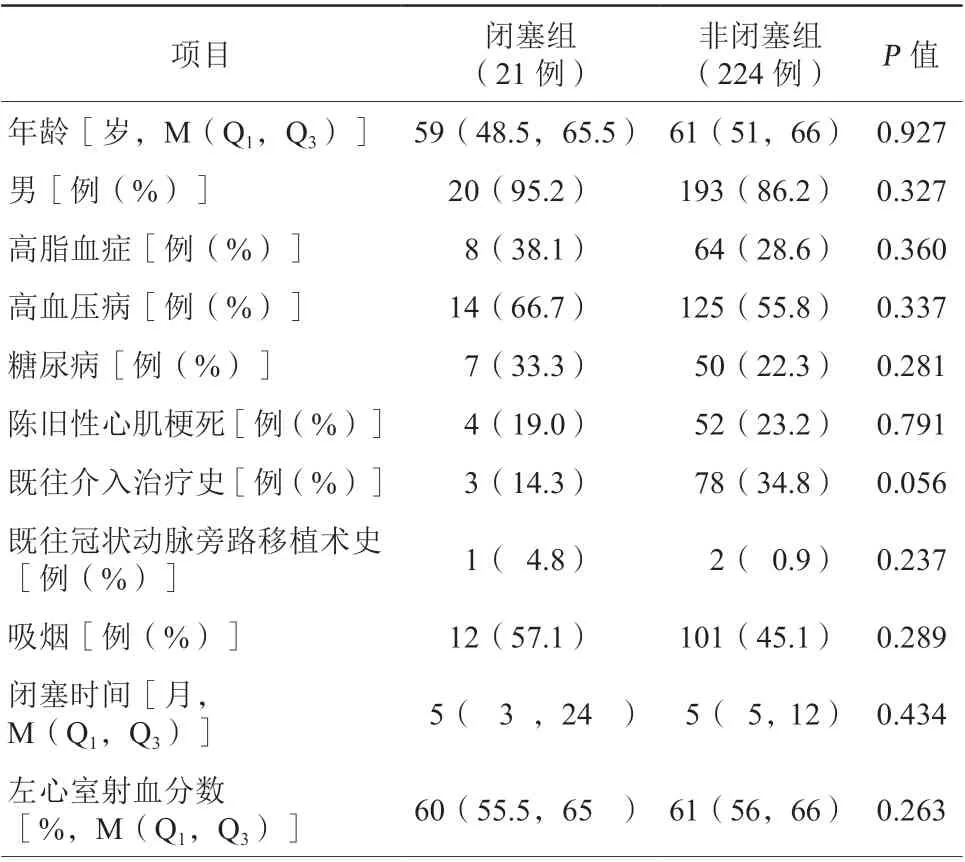
表1 两组患者临床资料比较
2. 2 两组患者血管造影特征
分叉病变多见于近端纤维帽附近(77.1%,189/245),且左前降支分叉病变最常见(63.7%,156/245)。在闭塞组中,真性分叉病变比例更高(71.4%比26.8%,P<0.001)。此外,闭塞组基线分支参考血管直径较小[2.2(2.1,2.3) mm比2.3(2.1,2.6) mm,P=0.038],且分支开口狭窄程度更高[56.0%(18.5%,71.5%)比30.0%(8.0%,50.0%),P=0.017]。两组患者CTO靶血管、病变血管数量、支架内再狭窄及J-CTO积分比较,差异均无统计学意义(均P>0.05,表2)。
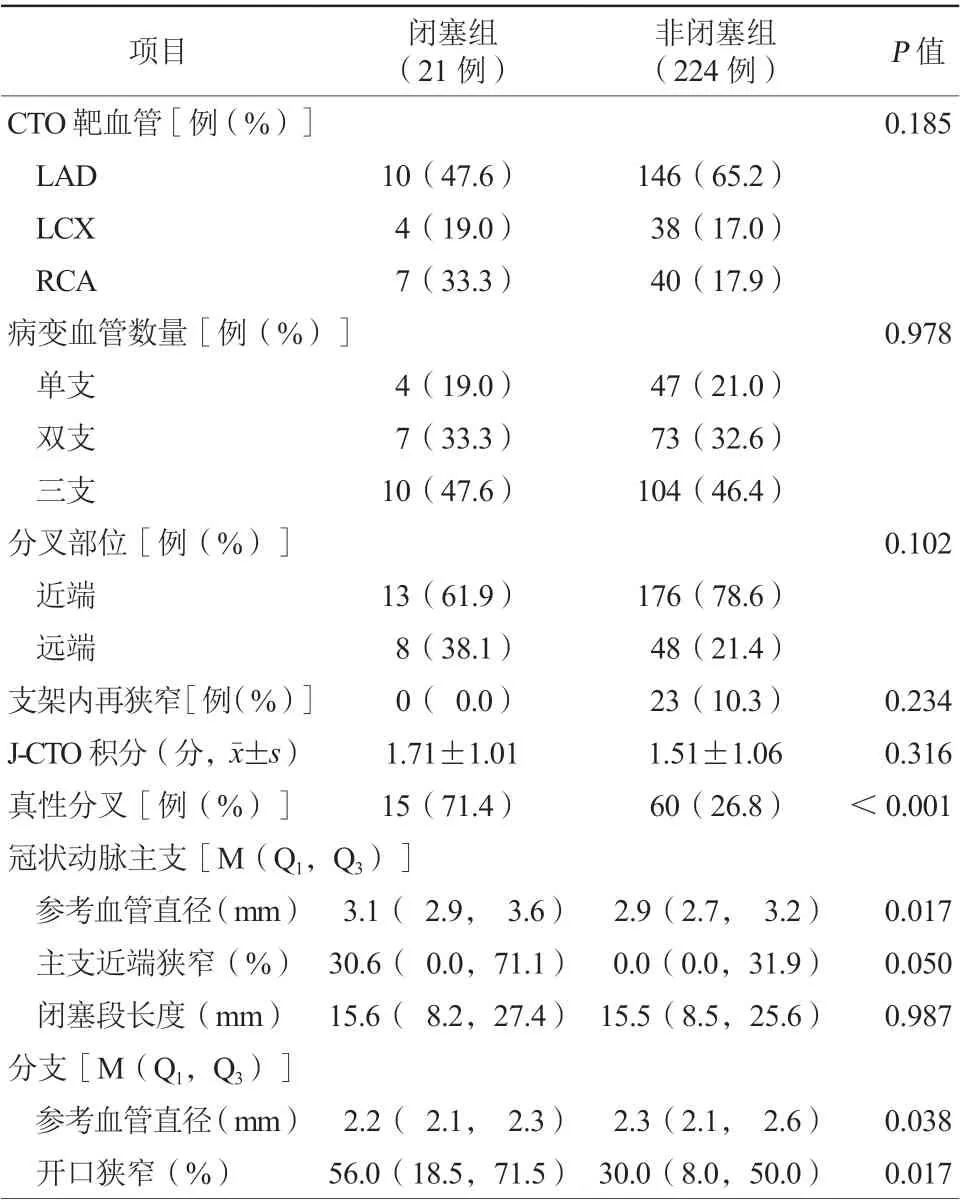
表2 两组患者造影特征比较
2. 3 两组患者介入过程中的数据情况比较
245例患者中158例(64.5%)在PCI过程中没有对分支进行保护,而44例(18.0%)分支保留导丝,31例(12.7%)对分支病变进行预扩张,仅12例(4.9%)患者采用双支架置入。与非闭塞组比较,闭塞组分支无导丝保护比例更高(85.7%比62.5%,P=0.034)。此外,闭塞组逆向开通技术(33.3%比7.1%,P<0.001),尤其逆向内膜下夹层再入(retrograde dissection re-entry,RDR)技术使用比例更高(19.0%比4.0%,P=0.017)。闭塞组较非闭塞组更多采用双侧冠状动脉造影(52.4%比24.6%,P=0.006)。两组患者近端主支与分支角度、远端主支与分支角度及主支近端与远端角度比较,差异均无统计学意义(均P>0.05,表3)。
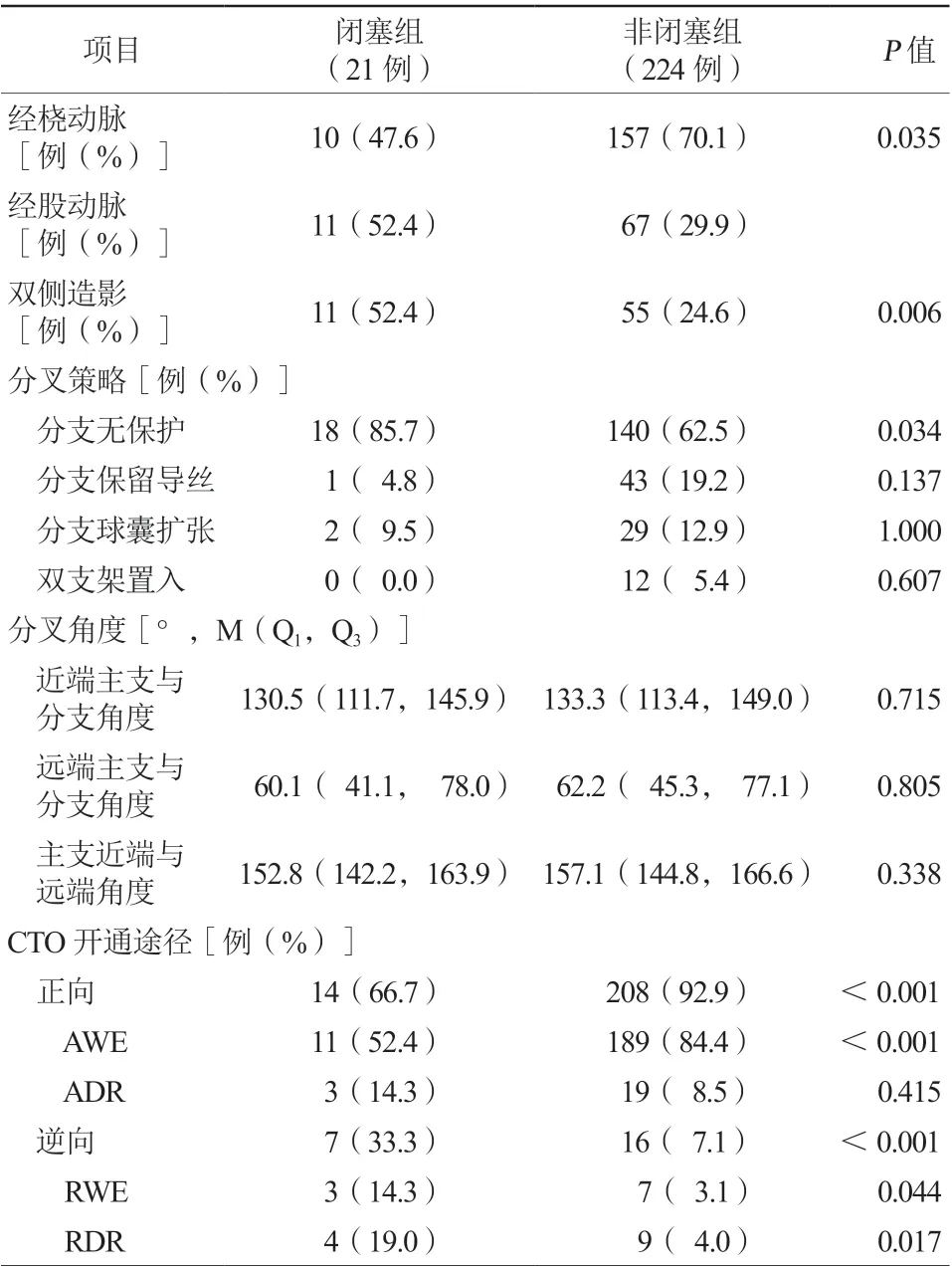
表3 两组患者介入过程比较
2. 4 分支闭塞独立预测因素
对所有重要的临床因素和血管造影变量进行单因素logistic回归分析。与分支闭塞相关的因素包括既往介入治疗史、闭塞长度、主支参考血管直径、分支参考血管直径、分支无保护、分支开口狭窄≥50%、主支近端狭窄≥50%以及内膜下夹层再入技术等8个变量均达到P<0.10。将此8个变量纳入回归模型中。在多因素logistic分析中,分支无保护[比值比(odds ratio,OR)4.61,95%可信区间(conf idence interval,CI)1.25~17.04,P=0.022]、分支开口狭窄≥50%(OR5.37,95%CI1.93~14.98,P=0.001)、主支近端狭窄≥50%(OR2.93,95%CI1.01~8.49,P=0.047)和采用内膜下夹层再入技术(OR4.25,95%CI1.29~13.99,P=0.017)是分支闭塞的独立预测因素(表4)。
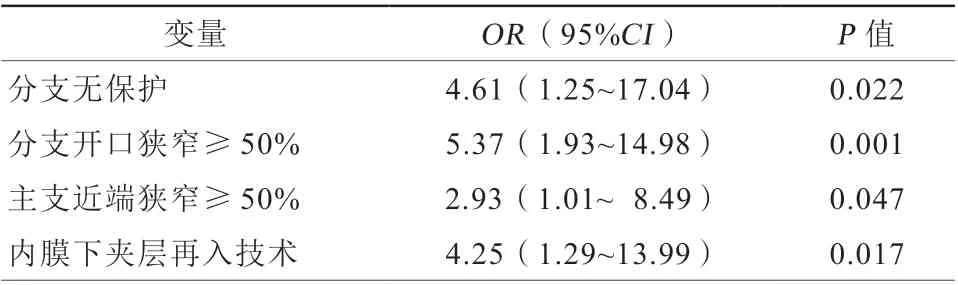
表4 分支闭塞的logistic 多因素分析
2. 5 围术期并发症的结果分析
共有30例患者(12.2%)发生围术期并发症。闭塞组的围术期并发症发生率为33.3%(7/21),非闭塞组为10.3%(23/224)(P=0.007)。闭塞组围术期心肌梗死发生率较非闭塞组更高(19.0%比5.4%,P=0.037)。此外,闭塞组中出现2例(9.5%)大出血及1例(4.8%)对比剂肾病。在非闭塞组中,有4例(1.8%)患者出现大出血,有2例(0.9%)患者发生了对比剂肾病(表5)。两组间冠状动脉穿孔发生率比较差异无统计学意义。两组患者中均无急诊冠状动脉旁路移植和围术期死亡病例。单因素logistic分析提示围术期心肌梗死与分支闭塞相关(OR4.16,95%CI1.21~14.29,P=0.024,表6)。
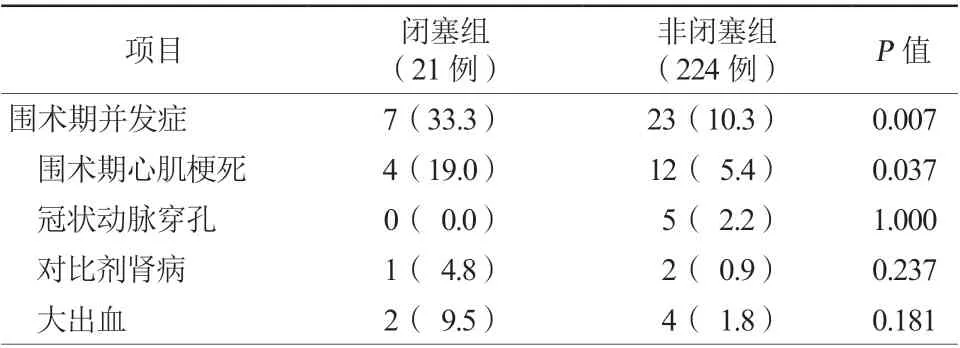
表5 两组患者围术期并发症比较[例(%)]
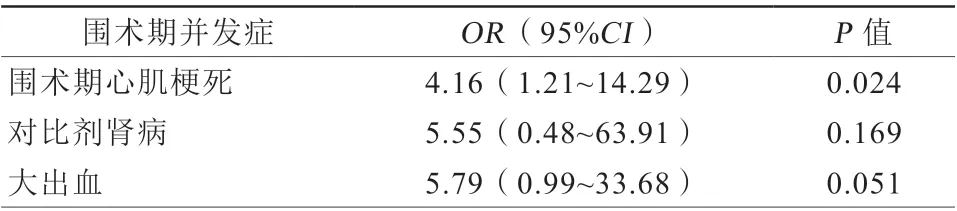
表6 分支闭塞与围术期并发症关系
3 讨论
非CTO冠状动脉分叉病变的发生率及其治疗方法已被广泛报道[1-4,13-14],而目前对于CTO合并分叉病变研究较少,且具有明显局限性。例如分支直径的定义过于严格(低至1.0 mm),难以评估分支闭塞对临床结果的影响[15],而样本量较小无法得出明确的结论[15-16]。此外,既往研究采用肉眼评估冠状动脉直径大小、分叉病变部位和分叉结果,可能会存在一定程度的测量偏差[5]。因此,本研究入选直径较大分支(≥2.0 mm),采用定量冠状动脉分析精确测量冠状动脉直径、分叉角度等参数,入选更多CTO病变患者。本研究显示36.3%CTO病变在闭塞段前后5 mm范围内合并分叉病变,与既往研究结果类似[5,17]。
3. 1 主支近端和分支开口狭窄≥50%是分支闭塞的危险因素
已有对非CTO分叉病变研究显示,分支开口狭窄≥50%是分支闭塞的独立危险因素[13,18-19]。除此之外,分支病变长度和直径也和分支闭塞相关。一项应用血管内超声研究显示,分支弥漫动脉粥样硬化斑块病变发生分支闭塞情况多于局限狭窄病变[20]。本研究结果显示,在CTO合并分叉病变中,主支近端狭窄≥50%(OR2.93,95%CI1.01~8.49,P=0.047)和分支开口狭窄≥50%(OR5.37,95%CI1.93~14.98,P=0.001)是预测分支闭塞的独立危险因素。Koo等[21]采用血管内超声进行的一项研究表明,主支分叉近端狭窄及分支开口斑块是分叉病变中分支闭塞的独立预测因子。在PCI术中,对病变部位进行球囊扩张时,斑块会沿血管长轴方向发生移行,这种现象称球囊扩张的“铲雪效应”。当斑块位于分叉处时,扩张主支血管病变,由于这一效应,有可能造成分支血流受限或闭塞。此外,主支支架置入术后嵴的移位也是分支阻塞的可能原因。
3. 2 分支无保护独立预测的分支闭塞
目前,大多数分叉病变都采用了单支架策略[1-2,13]。然而,主支支架置入术后分支闭塞是最严重的介入并发症之一。CTO合并分叉病变引起分支闭塞机制不同于常规分叉病变,CTO病变再通过程中导丝常常进入内膜下引起冠状动脉夹层和壁内血肿,对CTO病变术后分支闭塞起关键作用。本研究显示分支无保护是分支闭塞的独立预测因素(OR4.61,95%CI1.25~17.04,P=0.022)。在进行CTO闭塞开通之前,应在分支预留导丝,以最大程度地降低分支闭塞的风险。即使主支支架置入术后分支发生闭塞,分支拘禁的导丝指引也有助于新的导丝穿支架网眼再次进入分支,完成导丝交换[22]。此外,分支预扩张有助于减少主支支架置入后分支闭塞,并有助于导丝再次进入。同时采用拘禁球囊技术,扩张分支球囊和主支支架球囊可防止斑块移动和嵴移位。分支球囊扩张后,如果分支结果不令人满意,则可以选择双支架策略,例如T支架技术、Culotte或反向Crush技术。因此,当采用单支架策略治疗CTO合并分叉病变时,建议在重要的分支中常规保留导丝。
冠状动脉壁内血肿压迫分支是导致分支闭塞的主要因素之一。介入术前三维重建CT血管造影有助于了解闭塞段血管走行,指导术中造影体位及投射角度选择,减少血肿风险。术中分支使用血管内超声识别近端纤维帽位置,有助于导丝走行内膜下时重新回到真腔,优化支架置入、扩张和定位,并指导逆向导丝进入CTO病变近端血管真腔,减少内膜血肿形成。此外介入术中尽可能采取对侧造影,避免正向推注对比剂所致血肿形成或扩大。另外,Crossboss-Stringray系统应用产生小的内膜下夹层,并穿刺进入血管真腔,相较于传统Knuckle导丝技术,可缩小内膜下血肿范围。上述方法均有助于限制CTO-PCI术中血肿形成,进而减少分支闭塞风险。
3. 3 内膜下夹层再入技术对CTO合并分叉病变再通的影响
正向导丝升级技术是最常用的CTO病变穿越技术(67%~77%)[23-24],尤其适用于较简单的CTO病变。但是,正向导丝升级技术并不适用于长的、钙化的或迂曲成角CTO病变。在近些年来,内膜下夹层再入技术包括正向内膜下夹层再入技术和RDR技术被越来越多用于CTO介入治疗,成功率逐渐提高。据报道目前CTO病变的造影成功率达到80%以上[25-27]。CTO-PCI经常使用头端坚硬的导丝,容易进入内膜下假腔,出现冠状动脉夹层或导丝通过“真-假-真”途径进入远端真腔。主支血管中夹层和假腔直接影响PCI术后分支血流。应用正向或逆向内膜下夹层再入技术时导丝进入内膜下空间,然后使用专用导丝或专用系统再进入冠状动脉真腔。然而,该技术可能导致冠状动脉内夹层和壁内血肿,压迫分支开口,进而导致分支的丢失。此外,通过内膜下置入支架常常导致分支闭塞(图2)。在本研究中,使用内膜下夹层再入技术是分支闭塞的独立预测因素(OR4.25,95%CI1.29~13.99,P=0.017)。常规内膜下夹层再入技术易产生长段夹层,例如内膜下寻径重回真腔技术(the subintimal tracking and reentry,STAR)与分支丢失率高相关。目前新型专用器械及技术的出现(例如CrossBoss-Stingray系统或Guideliner Reverse CART)最大程度限制夹层延展并减少血管损伤,从而降低分支闭塞风险[9,28]。
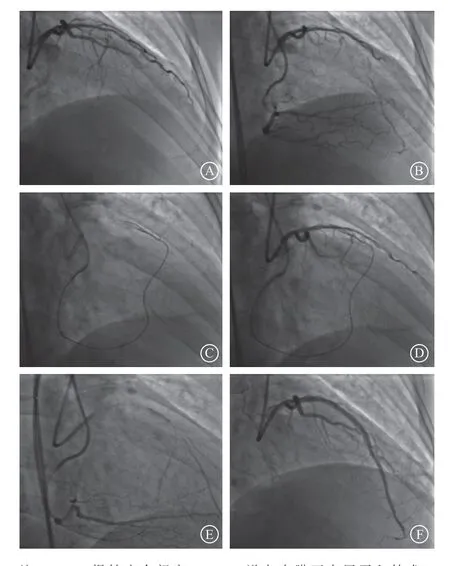
图2 采用内膜下夹层再入技术开通CTO 病变,术后出现分支闭塞A.左前降支中段CTO 病变,近端纤维膜帽中有粗大的对角支发出;B.右冠状动脉提供对侧侧支循环;C.逆向导丝通过室间隔侧支,闭塞段内采用RDR 技术;D.RDR 技术突破近段纤维膜,进入近段真腔;E.分支无导丝保护,主支行球囊扩张;F.主支置入支架后,出现分支血流受限(TIMI 血流分级Ⅰ级)
3. 4 分叉角度与分支闭塞无明确相关性
主支和分支之间的夹角是否是分支阻塞的危险因素尚有争议。既往研究表明,若分叉角度小于90°,对主支进行预扩张会发生嵴位移,而狭窄的分叉度是主支支架置入术中分支闭塞的预测因素[29]。但是COBISⅡ研究[13]显示,对于非CTO分叉病变,分叉角度不影响分支的最终TIMI血流分级及PCI术后长期临床结果。本研究并未发现闭塞组和非闭塞组之间的主支与分支角度存在显著性差异,进一步logistic回归分析显示分叉角度并非分支闭塞的独立预测因素。夹层和壁内血肿是CTO-PCI后导致分支闭塞的重要原因,可能减弱了分叉角度对分支的影响。
3. 5 分支闭塞与围术期并发症之间关系
相对于常规病变,CTO-PCI的成功率较低,且围术期并发症发生率较高[7-8,17]。在本研究中,围术期并发症发生率为12.2%(30/245),包括围术期心肌梗死(6.5%)、大出血(2.4%)、穿孔(2.0%)和对比剂肾病(1.2%)。闭塞组的围术期并发症发生率更高(33.3%比10.3%,P=0.007)。造成这种差异的主要原因是重要分支闭塞导致心肌坏死,引起围术期心肌梗死发生率较高(19.0%比5.4%、P=0.037)。有报道显示,分支闭塞会增加围术期心肌梗死的风险,尤其是当将主支支架置入以及使用夹层再入技术时[15]。本研究显示分支闭塞与围术期心肌梗死相关(OR4.16,95%CI1.21~14.29,P=0.024)。
3. 6 CTO-PCI与最佳药物治疗孰优孰劣
CTO-PCI比最佳药物治疗能否降低死亡率仍有争议。新近多中心观察研究Cox生存分析显示,成功CTO-PCI较最佳药物治疗明显改善长期预后(HR0.39,95%CI0.33~0.45,P<0.001),优于PCI失败患者和接受冠状动脉旁路移植术患者(P<0.001)[30]。多项Meta分析显示CTO-PCI组有更低全因死亡(OR0.45, 95%CI0.32~0.63,P<0.001)和心血管死亡(OR0.52,95%CI0.33~0.81,P<0.01)[31-32]。但是仍有荟萃分析显示CTOPCI仅可改善患者心绞痛症状,而对全因死亡及主要不良心血管事件无明显影响[33]。CTO-PCI能否改善患者长期预后,还有待未来大型随机对照临床研究证实。
本研究有一些局限性。 首先,其非随机设计可能会引入一定程度的病例选择偏差。其次,本研究在大型心血管诊疗中心由经验丰富的术者完成,其结果并不一定适用于所有CTO术者。最后,血管造影分析不是由核心实验室进行的,而是由经验丰富的介入心脏病学专家进行的。
本研究CTO病变患者中分叉病变发生率与既往报道相似。对于介入心脏病学医师来说,在冠状动脉CTO合并分叉病变行PCI仍是一个挑战,在主支导丝穿刺纤维帽前,应预留分支导丝保护重要分支,必要时采用拘禁球囊或双支架技术,最大程度减少分支闭塞风险。主支近端狭窄≥50%、分支开口狭窄≥50%、分支无保护、内膜下夹层再入技术是预测分支闭塞的独立危险因素。分支闭塞可能导致更多的围术期心肌梗死和围术期并发症。
利益冲突 所有作者均声明不存在利益冲突
