魔芋白绢病菌菌丝生长及微菌核形成的影响因素研究
2021-12-13雷雨俊鲁小东
何 斐,王 冉,雷雨俊,崔 鸣,鲁小东
(安康学院 现代农业与生物科技学院,陕西 安康 725000)
魔芋是天南星科多年生草本植物,是目前已知的唯一能大量提供葡甘聚糖的特种经济作物[1]。魔芋葡甘聚糖在医药、食品、化工、纺织及农业等多个行业领域应用广泛[2]。我国是魔芋生产大国,魔芋产量约占世界总产量的60%[3]。陕南秦巴山区魔芋适生区面积约占全国的1/3,魔芋生产已成为安康、汉中等区域特色经济主导产业[3-4],也是秦巴山区脱贫致富的支柱产业。然而,随着种植年限的增加,病害已成为魔芋可持续生产的主要限制因素。
白绢病是近年来在魔芋种植区内发生的一种重要土传性病害,也是继软腐病后的第二大杀手[4]。魔芋白绢病菌有性型为罗氏阿太菌(Atheliarolfsii),无性世代为齐整小核菌(Sclerotiumrolfsii)[5-6]。该病害难以根治的主要原因在于齐整小核菌形成的微菌核对极端环境适应力很强,腐生性也极强[7],可长期潜伏于病残体、杂草及土壤中,成为该病反复发生的初侵染源。当外界环境适宜时,齐整小核菌菌核萌发形成菌丝,通过雨水等途径传播,并分泌细胞壁降解酶为害魔芋叶柄基部和球茎,导致其发病[5]。魔芋根际土壤是齐整小核菌微菌核形成与存在的重要介质,土壤pH、养分状况与根际分泌物等不仅对魔芋及其根际微生物生长有重要作用,对病原菌微菌核形成也会产生一定的影响。魔芋根际土壤中微菌核的数量及活性直接影响魔芋白绢病的发生与危害程度。因此,研究齐整小核菌微菌核形成的影响因素,对从微生态角度揭示魔芋白绢病发生及流行原因,以及从土壤微生态调控途径预防魔芋白绢病的发生及减轻其危害具有重要意义。目前魔芋白绢病的研究主要集中在分子鉴定和生物学特性[4,8-9]、白绢病发生危害和防治[4-6]等方面,尚无寄主植物对魔芋白绢病菌微菌核形成影响的报道。作为我国魔芋主产地,秦巴山区魔芋人工大田栽培面积和种植年限逐年增加[10],两者对魔芋白绢病菌微菌核的影响均大于其他零星种植区域。研究表明,魔芋白绢病的发生与种植年限和菌量存在一定的相关性[6]。本研究通过皿内模拟试验探究了不同培养条件、魔芋粉、魔芋球茎及根际土壤浸提液对齐整小核菌菌丝生长及微菌核形成的影响,进而确定了这些影响因素在魔芋白绢病发生及流行过程中所发挥的作用,可以为阐明秦巴山区魔芋白绢病流行机理及制定该病害的综合防治措施提供科学依据。
1 材料与方法
1.1 材料
供试病原菌齐整小核菌(Sclerotiumrolfsii),从陕西省汉中市南郑区三花石村魔芋病害生防试验田采集的白绢病发病植株中分离获得。
齐整小核菌的活化与培养采用PDA培养基[11]。
1.2 病原菌菌饼的制备
将齐整小核菌经PDA斜面转接活化后,取部分菌丝放置于PDA平板中心,在28 ℃下培养7 d,用打孔器切取直径7 mm的病原菌菌饼,备用。
1.3 培养条件对齐整小核菌菌丝生长及微菌核形成的影响
1.3.1 pH 用0.2 mol/L HCl或NaOH调节PDA培养基的pH值,制成pH值分别为5.0、6.0、7.0、8.0、9.0的供试平板,将菌饼置于平板中央,在28 ℃下培养10 d,每个处理3次重复,下同。
1.3.2 营养条件 分别制备全营养PDA(常规PDA培养基)平板、半营养PDA平板(含无菌水1 L、马铃薯100 g、葡萄糖10 g、琼脂15 g)和水琼脂平板(无菌水1 L、琼脂15 g)。将病原菌菌饼分别置于平板中央,于28 ℃培养10 d。
1.3.3 光照 将病原菌菌饼置于PDA平板中央,分别置于连续光照、连续黑暗及光暗交替(12 h黑暗+12 h光照)条件下,在28 ℃下培养10 d。
1.4 寄主对齐整小核菌菌丝生长及微菌核形成的影响
魔芋粉:新鲜魔芋球茎用自来水清洗干净,去表皮,切成0.5 cm2小块,在80 ℃下烘干,用粉碎机粉碎后过0.18 mm筛。在PDA培养基中分别加入质量浓度为0(CK)、0.5、1、2、5、10 g/L的魔芋粉,制备成含有不同质量浓度魔芋粉的供试平板。
魔芋球茎浸提液:称取去表皮、清洗晾干的魔芋球茎10 g,充分研磨后加入100 mL去离子水,混匀;将混合物置于25 ℃摇床上,以120 r/min振荡1 h,以6000 r/min离心15 min;然后取上清液,用定性滤纸过滤。为保证魔芋球茎浸提液中的活性成分不被破坏,滤出液用0.22 μm无菌滤膜过滤除菌后,将其置于4 ℃冰箱保藏备用[12]。取一定体积的魔芋球茎浸提液,分别配制含稀释0、5、10和50倍魔芋球茎浸提液的PDA培养基(编号依次为C0、C5、C10和C50),以不添加浸提液的PDA培养基为对照(CK);灭菌后冷却至60 ℃左右的PDA培养基与过滤除菌的魔芋球茎浸提液混匀,倒平板。
1.5 魔芋根际土壤浸提液对齐整小核菌菌丝生长及微菌核形成的影响
2019年6月22日在陕西省汉中市南郑区三花石村魔芋病害生防试验田中,采用五点取样法和抖根法[13]分别采集同一田块未种植作物的闲置农田土壤、第1年和连作2年的魔芋根际土壤各5份,在自然风干、去杂后,研磨过0.25 mm土壤筛。各处理分别称取混合土样100 g,加入到100 mL蒸馏水中,浸泡48 h,然后以5000 r/min离心3 min,弃沉淀,重复2次;将上清液定容至100 mL,得到1 g/mL母液;母液用0.22 μm无菌滤膜过滤除菌,然后于4 ℃冰箱保藏备用[14]。取不同处理的土壤浸提液母液,添加至灭菌后冷却至60 ℃左右的PDA培养基中,分别配制含稀释5、10、50和100倍土壤浸提液的PDA培养基,以不添加土壤浸提液的PDA培养基为对照(CK);PDA培养基与土壤浸提液混匀后倒平板。
在1.4和1.5节中的各处理供试平板制备完成后,将1.2节制备的病原菌菌饼置于平板中央,在28 ℃下培养10 d,各处理重复3次。
1.6 齐整小核菌生长状况观察及菌落与微菌核区面积测定
上述各处理病原菌平板自第3天起,每24 h观察记录生长状况1次;采用十字交叉法[15]测量病原菌菌落直径W,根据公式(1)和(2)分别计算病原菌菌丝的相对生长速率(mm/d)和绝对生长速率(mm/d)[16]:
相对生长速率=(lnWt+1-lnWt)/∆t
(1)
绝对生长速率=(Wt+1-Wt)/∆t
(2)
上式中:Wt+1表示第t+1天测量的菌落直径(mm);Wt表示第t天测量的菌落直径(mm);Δt表示两次测量菌落直径的时间差(d)。
采用Image Pro Plus 6.0软件进行图片分析,分别测定菌落总面积像素值(colony area pixels, CAP)及微菌核区面积像素值(microselerotia area pixels, MSAP)。根据菌落直径测量值计算菌落总面积(Colony Area, CA)、微菌核区面积占菌落总面积的比例(Microselerotia Proportion, MSP)及微菌核区面积(Microselerotia Area, MSA)[15],其计算公式分别为:
CA=π×(D10/2)2
(3)
MSP=MSAP/CAP×100%
(4)
MSA=CA×MSP10
(5)
式中:D10为病原菌在第10天时培养皿反面菌落直径;MSAP、CAP分别为微菌核区面积、菌落总面积的像素值;MSP10为病原菌在第10天时微菌核区面积占菌落总面积的比例。
1.7 数据处理
利用SPSS 22.0软件进行方差分析,处理间用Duncan’s法进行多重比较。
2 结果与分析
2.1 培养条件对齐整小核菌菌丝生长及微菌核形成的影响
2.1.1 pH 由表1和图1A可知,齐整小核菌在pH 5.0~9.0范围内均可生长,当pH值为7.0时菌丝相对生长速率和绝对生长速率均达到最大,分别为0.274和17.72 mm/d。当pH值升高或降低时菌丝生长有所减慢,表明偏酸性或碱性会影响齐整小核菌菌丝的生长速率,但不同pH值对菌落和微菌核面积的影响不显著。
2.1.2 营养条件 齐整小核菌在全营养PDA培养基上的相对生长速率、绝对生长速率、菌落总面积、微菌核区面积及微菌核区占菌落总面积比例均达到最大,其次为半营养培养基,而在水琼脂平板上生长最慢且不能形成微菌核,说明营养丰富更有利于齐整小核菌菌丝的生长和微菌核的形成(表1和图1B)。
2.1.3 光照 由表1和图1C可以看出,不同光照条件下齐整小核菌菌丝的相对生长速率、绝对生长速率、菌落总面积、微菌核区面积及微菌核区占菌落总面积比例均表现为:连续黑暗>光暗交替>连续光照。其中,在连续黑暗条件下,齐整小核菌微菌核区面积分别较连续光照和光暗交替条件下显著增加了99.7%和7.1%,表明连续黑暗更有利于齐整小核菌产生微菌核。
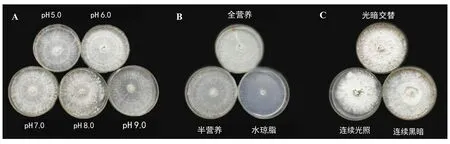
A: pH值。B:营养。C:光照。
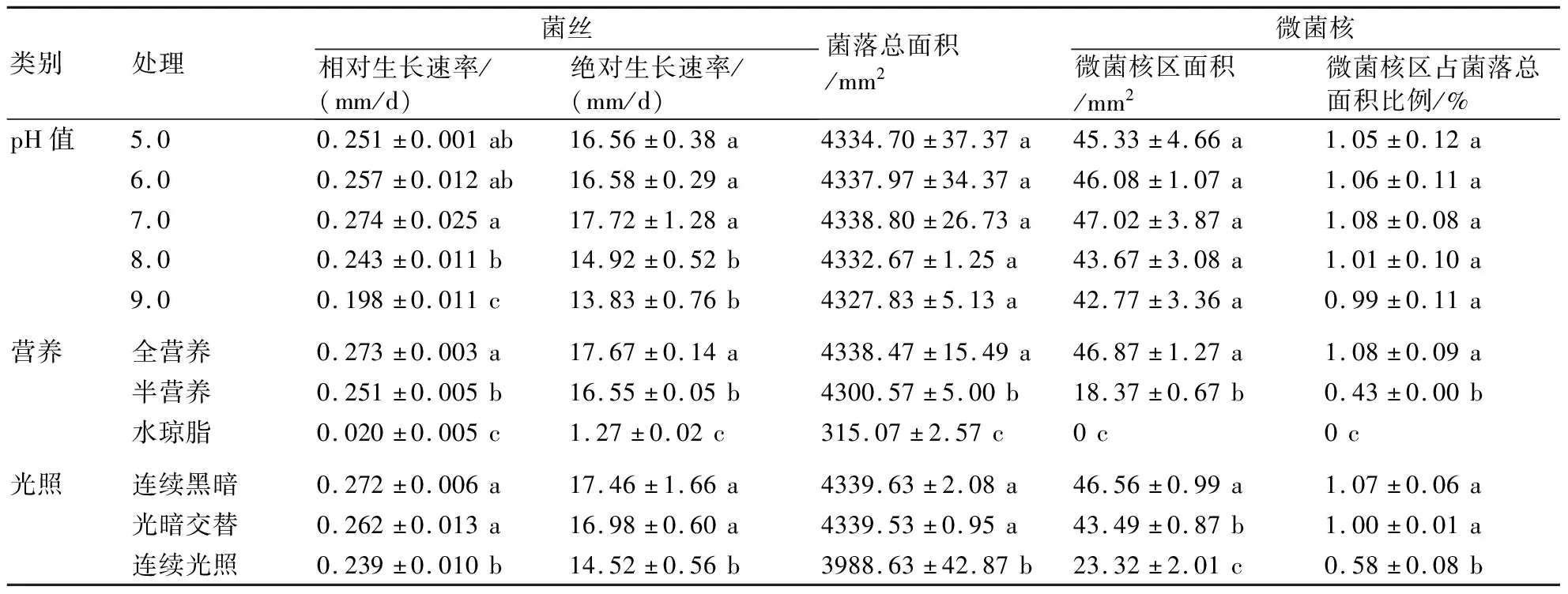
表1 培养条件对齐整小核菌菌丝生长及微菌核形成的影响
2.2 寄主对齐整小核菌菌丝生长及微菌核形成的影响
2.2.1 魔芋粉 由表2可知,PDA培养基中添加质量浓度为0.5~10 g/L的魔芋粉时,齐整小核菌菌丝的相对生长速率、绝对生长速率、菌落总面积及微菌核区面积随着魔芋粉质量浓度的升高而逐渐增加;当魔芋粉质量浓度为10 g/L时,齐整小核菌菌落的生长状况最佳。
2.2.2 魔芋球茎浸提液 由表2可知,在添加稀释0~50倍魔芋球茎浸提液的PDA培养基中齐整小核菌均可生长,其菌丝的相对生长速率、绝对生长速率、菌落总面积及微菌核区面积随着魔芋球茎浸提液稀释倍数的增加而逐渐降低。
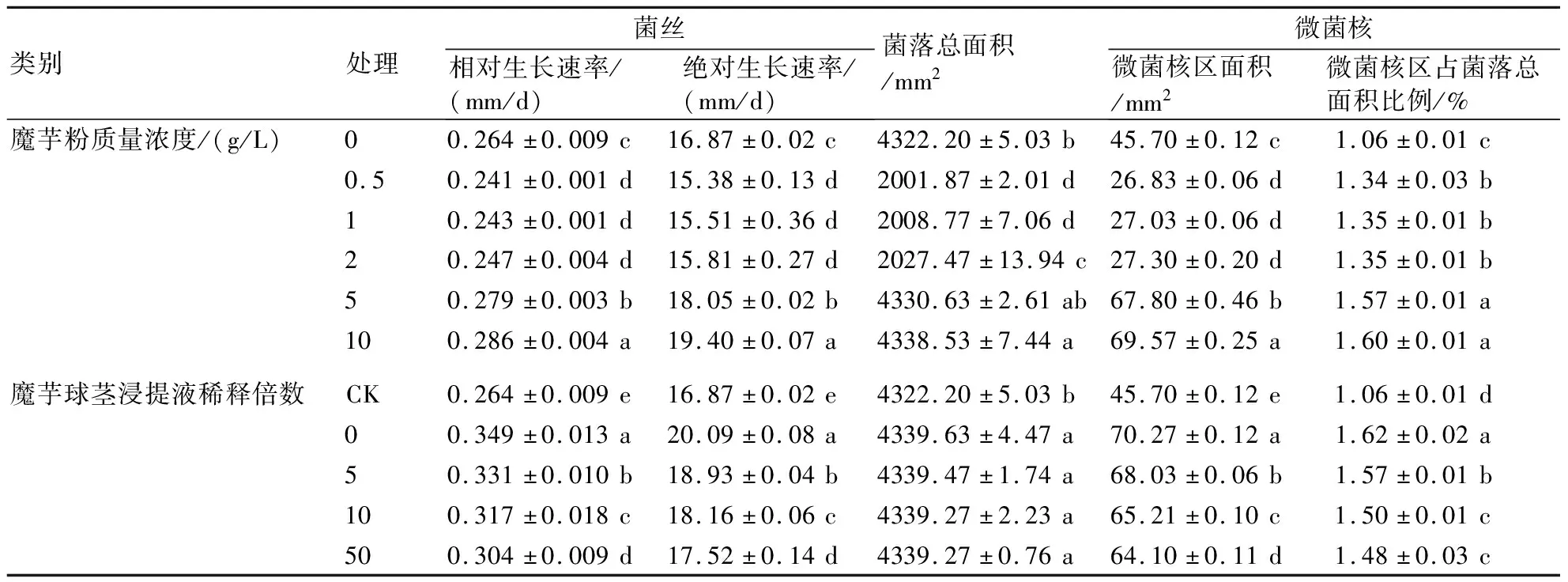
表2 魔芋粉及魔芋球茎浸提液对齐整小核菌菌丝生长及微菌核形成的影响
2.2.3 魔芋根际土壤浸提液 由表3可知,齐整小核菌在添加稀释5~100倍不同连作年限魔芋根际土壤浸提液的PDA培养基中均可生长。在相同种植年限条件下,随着土壤浸提液稀释倍数的增加,齐整小核菌菌丝的相对生长速率、绝对生长速率、菌落总面积及微菌核区面积逐渐降低。在相同稀释倍数条件下,随着种植年限的增加,齐整小核菌菌丝的相对生长速率、绝对生长速率、菌落总面积及微菌核区面积逐渐增加。土壤连作年限、土壤浸提液稀释倍数及两者的交互作用显著影响齐整小核菌菌丝的相对生长速率、绝对生长速率、微菌核区面积及微菌核区占菌落总面积的比例。
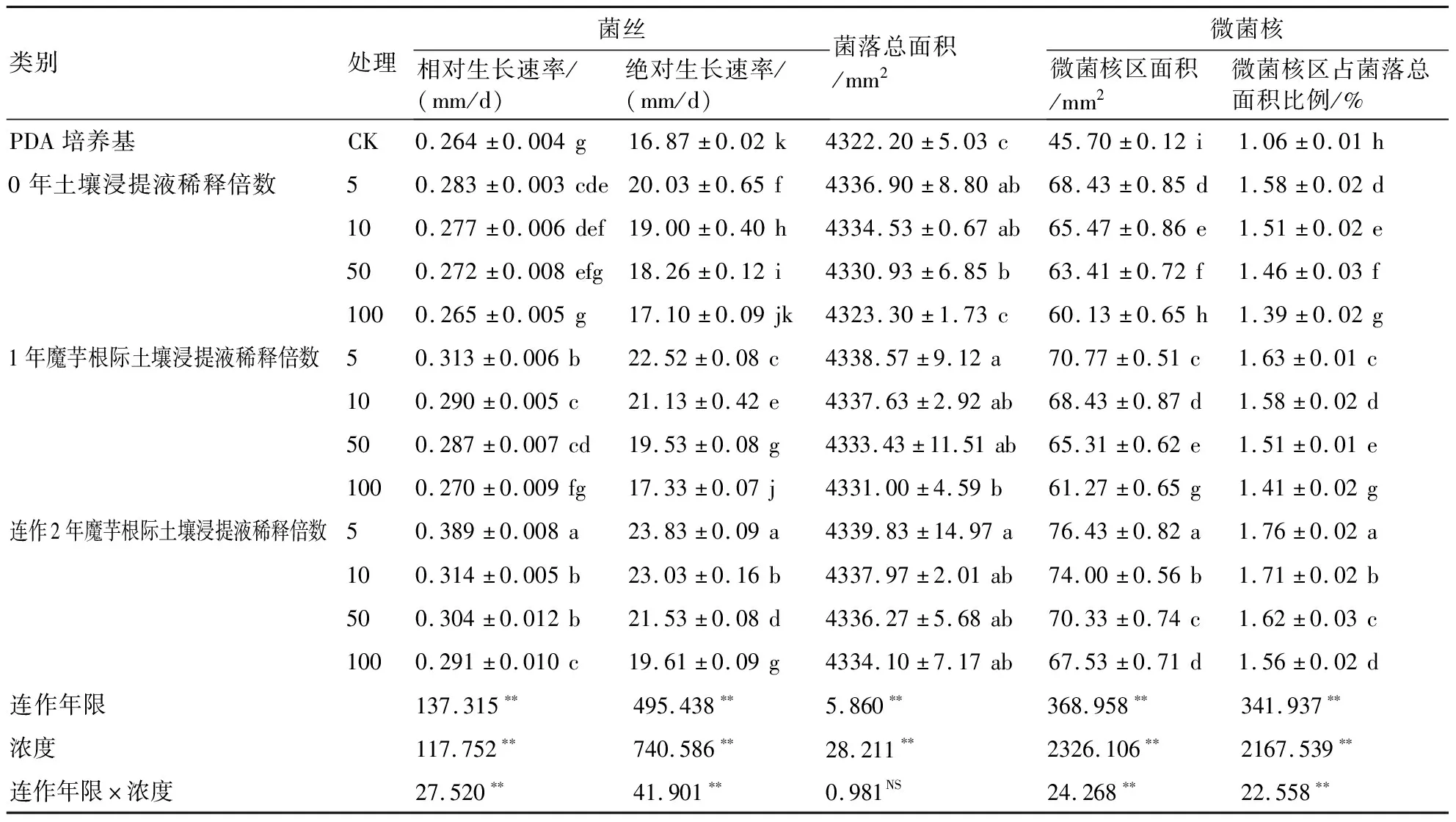
表3 魔芋根际土壤浸提液对齐整小核菌菌丝生长及微菌核形成的影响
3 讨论与结论
白绢病又称菌核根腐病、南方枯萎病、菌核性苗枯病和油菜籽病。1991年,魔芋白绢病首先在江西省宜黄县地区发生,随后陆续在全国魔芋主产区传播[4]。魔芋白绢病的发生、流行与环境条件密切相关,环境中的光照、土壤营养及pH值等都是关键的影响因子。邢梦玉等[18]研究发现,龙血树白绢病菌齐整小核菌在有无光照条件下都能生长,说明该病菌对环境适应范围较广,这与本研究的结果基本一致。通过分析光照对齐整小核菌微菌核形成的影响,发现连续黑暗更有利于其产生微菌核,在连续光照下只能产生少量微菌核,这可能与白光抑制或延迟病原真菌微菌核的形成有关[19]。
崔鸣等[6]研究发现,随着种植年限的增加,魔芋白绢病逐年加重。即种植年限与魔芋白绢病的发生存在一定的相关性,但目前尚无种植年限对魔芋白绢病菌齐整小核菌微菌核形成影响的报道。土壤作为病原菌侵染植物的主要介质之一,植物根系分泌到土壤中的酚酸等化感物质是很多病原菌的主要能源物质,对病原菌微菌核的形成与活性有重要影响[15,20]。本研究发现,连作年限及魔芋根际土壤浸提液浓度显著影响齐整小核菌菌丝的生长及微菌核的形成。不同连作年限魔芋根际土壤浸提液稀释5~100倍时,齐整小核菌均可生长,且随着土壤浸提液稀释倍数的增加、连作年限的减少,齐整小核菌菌丝的生长速率、菌落总面积和微菌核区面积亦相应降低。大量研究表明,作物根系分泌物在土壤中残留并随着种植年限增加而富集[21-22]。由此推测连作魔芋根际土壤中的根系分泌物,尤其是酚酸等化感物质可能与齐整小核菌微菌核的形成有关,这与其他作物根系分泌物促进其病原菌生长繁殖的结论[22]相似。在逆境生长条件下,微菌核是魔芋白绢病菌主要的存在方式,在无寄主的情况下也能在土壤中维持数年。连作致使魔芋根系分泌物的数量和种类发生了一定程度的变化,这可能导致魔芋根际土壤微生物的种类和数量也发生改变。不同连作年限的魔芋根系分泌物及由分泌物诱导而改变了的根际微生物又会作用于土壤,对土壤营养元素的平衡产生影响,这又会加剧由魔芋对土壤营养元素偏好吸收而造成的营养不平衡,导致魔芋生长发育不良及抗病能力下降,因而造成连作条件下魔芋白绢病发生的风险更大、概率更高,难以防治。因此,在生产实践中,应尽量采用合理轮作、间作及混种等技术,以便有效减少白绢病菌在魔芋植株残体和根际土壤中的残留,使病原菌失去寄主或生活环境恶化,从而有效降低魔芋白绢病的发生率[23]。
夏红飞等[12]研究表明,寄主根系提取物能诱导棉花黄萎病菌大丽轮枝菌微菌核形成相关基因的表达。本研究发现,一定质量浓度的魔芋粉及球茎浸提液刺激齐整小核菌菌丝生长及微菌核的形成,推测魔芋球茎中的某些成分也可能诱导病原菌菌丝和微菌核形成相关基因的表达。但魔芋球茎营养丰富,包含葡甘聚糖、粗蛋白、游离氨基酸、淀粉、可溶性糖、还原糖、生物碱、多酚氧化酶及神经酰胺等[25]多种成分,魔芋粉和球茎浸提液中具体何种活性成分在发挥作用尚不清楚,其作用机制是诱导齐整小核菌孢子萌发或芽管伸长,还是作用于细胞壁、细胞膜或细胞质等,均有待于通过进一步研究来明确。
