生成性问题在高中化学教学中的应用研究
2021-11-22吕艳
吕艳

摘要:问题是思维的源泉,更是思维的动力。目前,教师对“问题”与“问题链”的设计研究较多,而对课堂教学中“生成性问题”的研究则尚嫌不足。结合教学实践,从“精心预设”“捕捉意外”和“善待错误”等例谈高中化学课堂教学中的“生成性问题”。
关键词:生成性问题;预设;意外;错误
文章编号:1008-0546(2021)06-0029-03 中图分类号:G632.41 文献标识码:B
doi:10.3969/j.issn.1008-0546.2021.06.008
相信每位老师都听过这样的公开课:执教者根据教学内容精心预设了一系列有机联系的问题,安排好设疑的层次和梯度,不断提出问题,造成悬念,学生依次回答老师所提的问题。整个教学过程气氛活跃,学生的参与度高,知识的传递和预期的目标也得以达成。但整节课学生没有提出一个问题,好像没有一点疑问,这合理吗?
课堂教学是师生互动的过程,学生是活生生的个体,他们的许多想法、思维常常与教师有所不同,因此,自然而然就会产生许多生成性的问题。之所以没有问题,究其原因是学生在顺着教师的设计和思路演义“教案剧”,从这个意义上说,整个教学过程就变成了教师的“独角戏”。
化学新课程的核心理念是以发展学生化学学科核心素养为主旨,“发展”是一个动态的生成过程。这就要求化学课堂要以人为本,把学生从传统的“认知体”提升到“生命体”的高度,赋予课堂更多的生成性。只有有了“生成性问题”,才能构建思维的“问题链”,课堂教学才会充满活力,才能让“独角戏”转化为“交响乐”。
一、什么是“生成性问题”?
“生成性问题”是指真实的课堂教学情境中通过师生互动,在共同思考与发展中产生的超出预设的新问题。它既可以是学生根据所学知识或生活经验,对课堂学习内容提出的拓展式问题;也可以是由课堂内外的突发事件引发偶发式问题。
例如,在“钠的化学性质”教学中,学生完成钠与水反应的实验并得出结论后,教师提出:在金属活动性顺序表中,排在氢前面的金属能和盐酸反应生成氢气,那么金属钠和盐酸反应的情况如何?预设目的是让学生认识钠与稀盐酸反应比与水反应剧烈,钠块燃烧。学生讨论并用实验验证之后,预设的价值得以体现。此时学生提出:为什么钠与盐酸反应会比与水反应剧烈?这就是拓展式问题。学生在对比水和盐酸溶液的成份后得出:反应的剧烈程度和氢离子浓度有关。正当老师准备进行下一教学任务时,一位学生突然问:老师,如果盐酸的浓度越大,是不是反应越剧烈?问题一提出,就有同学小声嘀咕:“当然了,这还用问嘛。”此时,我意识到,恐怕大部分学生都应该是这样认识的,我问“同学们都是这样认为的吗?”果然,肯定的回答几乎是异口同声。这就是偶发式问题。学生实验:将一小块金属钠投入装有浓盐酸的小烧杯中,观察现象:钠粒四处游动,渐渐变缓,烧杯内有白色沉淀出现,钠粒没有出现燃烧现象。学生感到十分困惑,实验现象与预测的不一致,激发起学生探究知识的强烈愿望。师生共同讨论知:生成的白色沉淀是NaCl,NaCl的生成阻碍了Na与H2O的反应,浓盐酸挥发出来的HCl气体阻碍了Na与O2的接触,故不能燃烧。
课堂中有拓展式问题,说明学生思维活跃,学生的主体地位得以显现,是一种有意义的主动学习;在此基础上,如果又有了偶发式问题,就能提高学生的学习积极性,主动思考,是一种有生命活力的学习。
二、如何开发利用“生成性问题”?
1.精心预设
“凡事预则立,不预则废。”这里的“预”,就是预设。课堂预设是教学活动的起点和指南,它为师生确定了课堂活动的目标、内容以及实现目标的行动路径,可以使教学过程有序进行。只有课前多角度精心预设,才会有“无心插柳柳成荫”的精彩生成。
在铁及化合物的性质教学时,教材[1]对“为什么向FeSO4溶液中滴入NaOH溶液时,生成的白色沉淀会迅速转变为灰绿色,最终转变为红褐色?”的解释是:“白色的Fe(OH)2被空气里的氧气氧化成红褐色的Fe(OH)3。”事实上,实验过程中的白色沉淀往往夹杂着灰绿色,几乎分辨不出,很难观察到理想的实验现象。要求学生以此推理出上述解释,缺乏证据支撑。为此预设如下:
(1)讨论:如何来制取氢氧化亚铁?(用FeSO4溶液和NaOH溶液反应制得)
(2)实验:向一支洁净的试管中先加入一定量的FeSO4溶液,再滴入几滴NaOH溶液,观察现象。(无白色絮状沉淀生成)
(3)质疑:为什么不能观察到白色沉淀?(Fe(OH)2与O2接触被O2氧化,也有可能是溶液中可能有少量的Fe3+直接生成了Fe(OH)3所致)
(4)探究:要想觀察到明显的白色沉淀,需要创造什么条件?(无Fe3+的环境;无O2的环境)
(5)再探究:可以采取哪些措施以达到上述条件?(排除溶液中的Fe3+可以加铁粉;驱逐溶液中的溶解氧可以加热煮沸;避免与空气接触可以将胶头滴管伸入试管内、油封、试剂瓶装满等)
预设以上问题在于让学生找出不易观察到白色沉淀的原因和解决的方法。此时及时提出:能否设计一个简单实验,能较长时间观察到白色沉淀的生成?并把这个问题作为一个探究性课题留给学生以生成更多的问题。
学生的探究结果让我又喜又惊。喜的是这是梦寐以求的课程问题,能够在学生的互动中形成;惊的是有些内容是连教师也没有想到的,列举两例,与同行共赏:
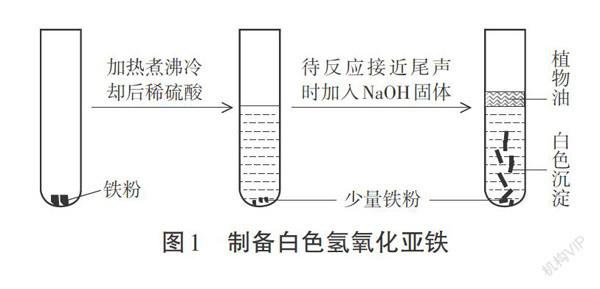
其一:在试管中加入一定量的还原铁粉,快速加入煮沸并冷却至常温的稀硫酸(使铁粉过量);待只有少量气泡冒出时,向其中滴入几滴植物油(隔绝空气),然后向试管中放入片状的NaOH固体(图1所示)。
其二:取2g未变质的FCSO4晶体,加入煮沸过的蒸馏水,振荡使其溶解,用医用针筒吸取约10mL溶液后,再吸取约10mL的NaOH溶液,观察现象。当观察到白色沉淀一段时间后,吸入空气,即可观察到白色沉淀先转变为灰绿色,后转变为红褐色。
甚至有的同学提出用摄子夹取一小块金属钠,迅速插入到盛有新配制FeSO4溶液的试管中下部。也能观察到溶液中产生气泡的同时有白色絮状沉淀生成等。
预设只是预设“问题”生成的可能性,而不是必然性,如果是明确一定会产生什么样的问题或答案,那就不是生成了。预设能够生成更多新问题的关键是创设更加开放的问题情境和活动情境,促使学生多角度思考、多层面理解,从而产生比较多的“新问题”。
2.捕捉意外
著名教育家苏霍姆林斯基说:“教育的技巧并不在于能预见课堂的所有细节,而是根据当时的具体情况巧妙地在学生不知不觉中做出相应的变化。”化学教学过程不应该只是知识的单项传授,而应该是一个师生互动,素养生成的过程。老师不可能也不应该事先安排好课堂上的所有内容,也无需担心非预设生成会让自己在课堂上完成不了既定的教学任务,更不能在学生出现疑问时,打断学生提问或敷衍了事。因为这会使我们失去课堂中最具生命力的教学资源。
在执教“钠的化学性质”公开课时,我设计了一组微型的學生实验,其中有“将一小块金属Na投入到CuSO4溶液中,观察现象”的实验,目的是让学生认识到该反应的实质是Na与H2O先反应,生成的碱再与CUSO4反应。本应该看到钠在CUSO4液面上浮、游、熔、响,溶液中有蓝色絮状沉淀生成。但学生在做该实验时出现了异常情况:在烧杯中除了蓝色沉淀外,还有黑色物质出现。由于是学生实验,大多数学生都出现了这种情况,引起了学生们的议论。我意识到可能是同学切钠块时切大了一点所导致的。这是开发生成问题的好机会,我并没有急着说出原因,而是把问题抛给了学生:
(1)讨论:黑色的固体物质可能是什么?(煤油没有擦干净燃烧时产生了炭黑,或是氧化铜)
(2)探究:如何证明黑色固体是氧化铜还是炭黑?(实验:向烧杯中加一定量稀盐酸,充分搅拌。黑色固体消失,溶液变为蓝色)
(3)再探究:氧化铜是如何产生的?
将学生再次送入探究新知的讨论中。经过讨论达成共识:钠与水反应放出的热量积累,使部分Cu(OH)2分解,产生CuO。
(4)为什么有的同学实验中没有黑色固体生成,而有的同学的实验中有黑色固体呢?(钠块小,放出的热量少,且能及时散失,就不能将Cu(OH)2分解。钠块大,放出的热量多,且不能及时散失,热量的积累使溶液的温度升高。)
问题的解决,使学生脸上露出了满足、喜悦的神情。就在我准备进行下一教学内容时,一位同学问道:“难道钠就真的不能置换出硫酸铜中的铜吗?那为什么书上说金属钠能从钦等金属氯化物中置换出金属单质?”全班同学刷地静下来看着我。事出意外,怎么办?若是继续按着学生的思路探究,预设的教学任务肯定是不能完成了,何况这个问题让学生自己探究是很难完成的,但若找个借口搪塞过去,又怎么能解决学生心中的疑惑?稍加思索后,我说:“你的疑问很好,说明你是一个善于思考的学生,你能告诉我Na置换出TiCl4时条件是什么吗?”
学生:700~800℃
教师:在这个温度下钠是什么状态?
学生:液态,因为钠的熔点只有97.8℃。
演示实验:在一块凹形瓷片放黄豆粒大小的一块Na,取一药匙无水CuSO4粉末将Na块覆盖(为了安全,可用坩埚盖子把粉末盖好)。当加热1~2min之后,反应会爆炸式进行,瞬间放出的热会使瓷片破裂,生成光亮的紫红色Cu凝附在瓷片上非常醒目[2]。
学生讨论:从反应进行的剧烈程度和生成如此光亮纯洁的Cu,可以初步判定除发生2Na+CuSO4=Na2SO4+Cu之外,很难还有其他什么反应发生。
教师:在学习中,常常容易把反应物相同,但条件不同的反应混为一谈,这是很值得注意的,因为化学反应条件是影响化学反应产物的重要因素。我们在以后的学习中要注意反应发生的条件,不能以偏盖全。
教学虽没有按照预设的路线前进,教学任务没有完成,但课堂活起来了,精彩生成了,得到了听课老师和专家的好评。
3.善待错误
叶澜教授在“重建课堂教学过程观”一文中提到:“学生在课堂活动中的状态,包括他们的学习兴趣、注意力、合作能力、发表的意见和观点、提出的问题与争论乃至错误的回答等,都是教学过程中的生成性资源。”行为主义心理学家也认为:“人是在不断尝试错误中进行学习的。”课堂上,由于学生在知识建构过程中会受到一些条件的制约从而产生认识上的偏差和负迁移,导致错误也是在所难免的,甚至教师出错也是可能的。对于课堂中的错误,教师要是能根据实际情况灵活选择、整合,以错切入,引发冲突,就能将错误转化鲜活的生成性问题。
例如我在“水溶液中的离子平衡”复习课上,提出:在制得的氢氧化镁沉淀中,加入浓的氯化铵溶液,沉淀完全溶解,你能用有关理论解释上述事实吗?
学生甲:由于NH4+水解显酸性,H+与OH-结合使平衡向右移动,故Mg(OH)2沉淀溶解。
学生乙:由于NH4+水解显酸性,而Mg(OH)2易溶于酸中,发生Mg(OH)2+2H+=Mg2++2H2O反应使Mg(OH)2沉淀溶解。
学生们展开了激烈的讨论,但都无法说服对方。事实上,此处问题的症结不是H+与OH-的结合,也不是Mg(OH)2溶解于酸中,而是NH4+与OH-结合成NH3·H2O而使OH-浓度减少,Mg(OH)2沉淀溶解。面对学生的错误,我没有马上下结论,而是提出:在浓的NH4Cl溶液中NH4+和H+的浓度大吗?
学生丙:盐类的水解是微弱的,只有很小部分水解,所以NH4+浓度很大,而H+浓度很小。
老师:同学们能否从矛盾的两个方面来考虑这个问题?
学生甲:看来我刚才的回答是有问题的。NH4Cl水解是微弱的,产生的c(H+)很小,溶液c(OH-)也很小,它们之间反应很有限,是矛盾的次要方面;而原溶液中c(NH4+)很大,加入Mg(OH)2后,电离产生的是OH-与NH4+结合成NH3·H2O,而使c(OH-)减少,平衡溶解,这才是矛盾的主要方面。
老师:回答得很好!同学们,能否将NH4Cl晶体换成另一种可溶性晶体?”(提供醋酸和氨水的电离常数)
同学丁:向浓的CH3COONH4溶液中加入少量Mg(OH)2固体,振荡,若固体溶解则丙结论正确。
老师:为什么?
同学丁:根据醋酸和氨水的电离常数,在相同条件下它们的电离程度基本相同,CH3COONH4溶于水后,溶液应该呈中性。
这个问题是由学生的错误答案引起的,经过教师的及时引导,理清楚了化学概念中的关键问题。因此善待错误,借题发挥,就能将学生的错误转化为动态生成的教学资源,进而构建生态课堂,促进学生学科素养提升。
生成性问题往往能创造出许多未曾预约的精彩。随着新课程的实施,关注生成性问题,必将成为化学教师的一种共识。而且生成性问题本身就是最好的教学资源,教研(备课)组应针对教师教学中的实际问题和学生学习中的疑难问题开展研究,形成有特色的教学素材、案例和课件供全体教师分享,在分享中完善,不断提高教学质量和水平[3]。
参考文献
[1]宋心琦.普通高中课程标准实验教科书化学1(必修).第三版[M].北京:人民教育出版社,2009:60
[2]刘怀乐.钠与硫酸铜反应的实证分析[J].化学教育,2008(2):63
[3]中华人民共和国教育部.普通高中化学课程标准(2017年版)[S].北京:人民教育出版社,2018:88
