通过超高效液相色谱—四极杆-静电场轨道阱高分辨质谱联用仪对人尿中42种小肽类禁用物质进行兴奋剂检测
2021-11-17刘赟玺董天宇张玉峰常巍王占良
刘赟玺 董天宇 张玉峰 常巍 王占良
国家体育总局反兴奋剂中心(北京100029)
在20世纪,人们最初提出的理论认为,蛋白质必须在胃肠道完全消化成游离氨基酸后,才能被机体吸收,后转运至各个组织参与代谢[1]。然而,在20世纪80年代后,大量的研究表明,介于蛋白质与氨基酸之间的肽类物质,也是蛋白质代谢吸收的一种方式[2]。而随着对肽类物质的深入研究,人们意识到肽类物质除了具备良好的稳定性、耐受性、被机体吸收利用率高等共同特性以外,特定的肽类物质还具有神经递质、免疫活性、抗氧化活性等作用[3,4]。而对于运动员来说,部分肽类物质可以刺激机体分泌生长激素,从而影响机体的新陈代谢,促进骨、软骨、肌肉等的细胞分裂,促进蛋白质合成,促进脂肪分解提供能量,抑制对葡萄糖的利用,减少对葡萄糖的消耗[5]。又因为肽类物质易于购买获得,所以成为营养学,药学以及兴奋剂滥用的又一热点。
由此,1989年国际奥林匹克委员会引入新的兴奋剂类别“肽类激素及其类似物”[6]。在2021年的世界反兴奋剂机构(World Anti-Doping Agency,WADA)的禁用清单[7]中,肽类物质被归类于S2肽类激素、生长因子、相关物质和模拟物,还有部分属于S5 利尿剂。而小肽类物质一般是指分子量小于2 kDa 的肽类物质,通常含有2个以上的以肽键相连接的氨基酸片段[8],因其在高温下结构会被破坏,气相色谱并不适用于小肽的检测。所以近些年来,采用固相萃取(solid-phase extraction,SPE)纯化并通过液相色谱-串联质谱法(liquid chromatography- tandem mass spectrometry,LCMS/MS)测定生物液体(如尿液)中含有的小肽,已成为药物检测领域中常用的方法。然而,该方法样品预处理用时较长,步骤复杂,所需有机溶剂也较多,还需要使用SPE 柱以及固相萃取装置,并需要花费大量人力物力。分析仪器的改良,为检测样品提供了更高的灵敏度,从而使得一些简单快速的样品预处理方法得到更好的应用,如直接进样方法[9]。
目前,本实验室采用的分析仪器为超高效液相色谱-Q Exactive Plus 组合型四极杆 Orbitrap 质谱仪(ultra-high performance liquid chromatography-Q exactive plus hybrid quadrupole-orbitrap mass spectrometer,Q Exactive Plus UHPLC/HRMS),其具备高灵敏度、高精确度以及高分辨率,可提高结果的可靠性。本研究的目的是基于使用Q Exactive Plus UHPLC/HRMS 联用仪,开发和评估一种简单、快速、高效的样品预处理及分析方法,并且保留样品检测的灵敏度和特异性,满足WADA 技术文件中所规定的最低要求检测浓度(minimum required performance levels,MRPL:)2 ng/mL,用于同时检测人体尿液中不同类别的小肽类禁用物质或代谢物(共42 种),以便涵盖WADA 禁用清单中生长激素促分泌剂类(growth hormone secretagogues,GHS) 、生长激素释放肽类(growth hormone-release peptides,GHRP)、促性腺激素释放因子(Gonadotrophin-releasing factors,GnRHs)、人类生长激素(Human Growth Hormone,hGH)、生长因子以及生长因子调节剂等分类的小肽类禁用物质、片段及代谢物,还包括两种利尿剂去氨加压素(Desmopressin)和苯赖加压素(Felypressin)及其代谢物(表1)。

表1 42种小肽类禁用物质及其氨基酸序列[8,10,11]
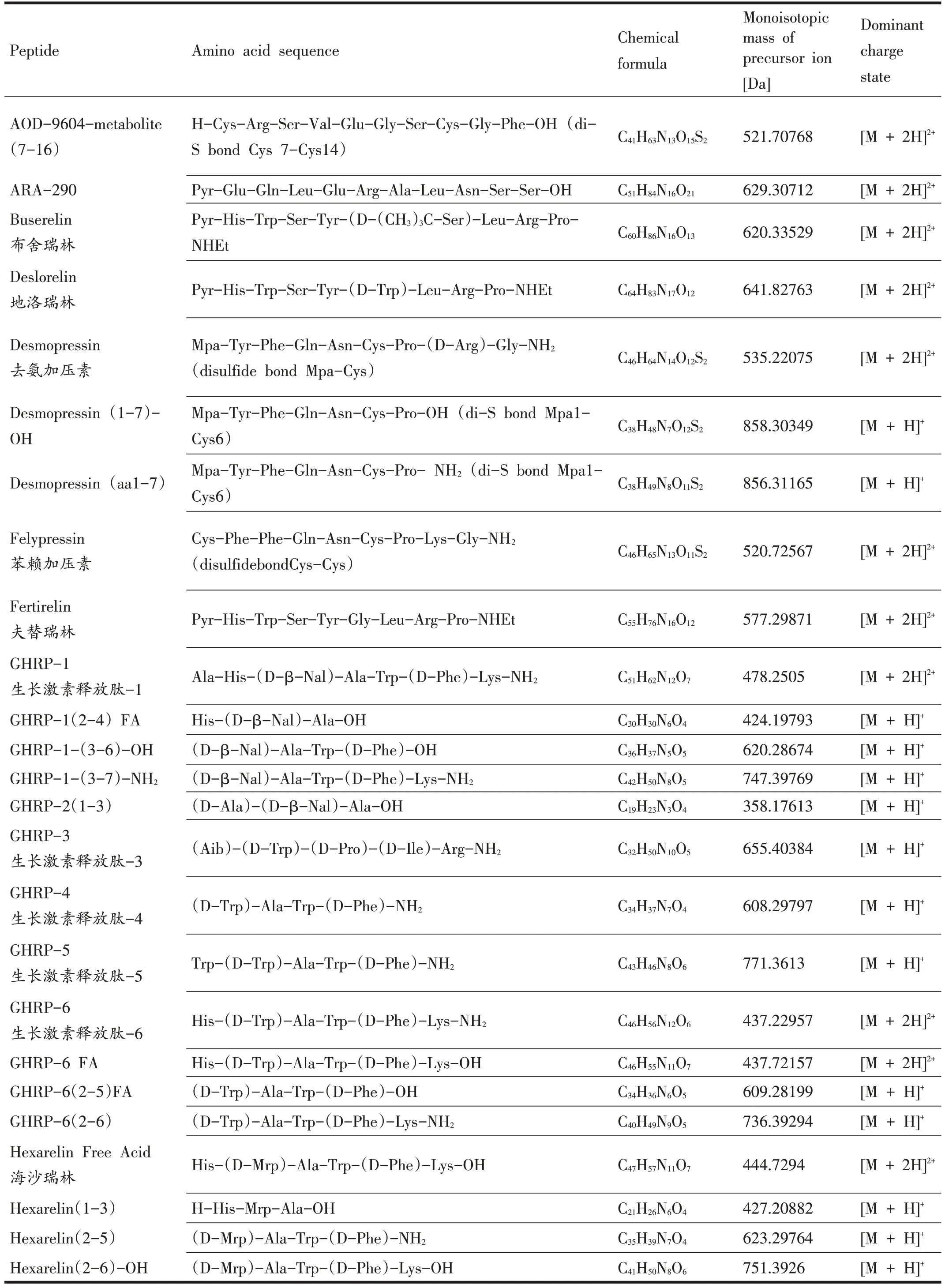
(续表1)
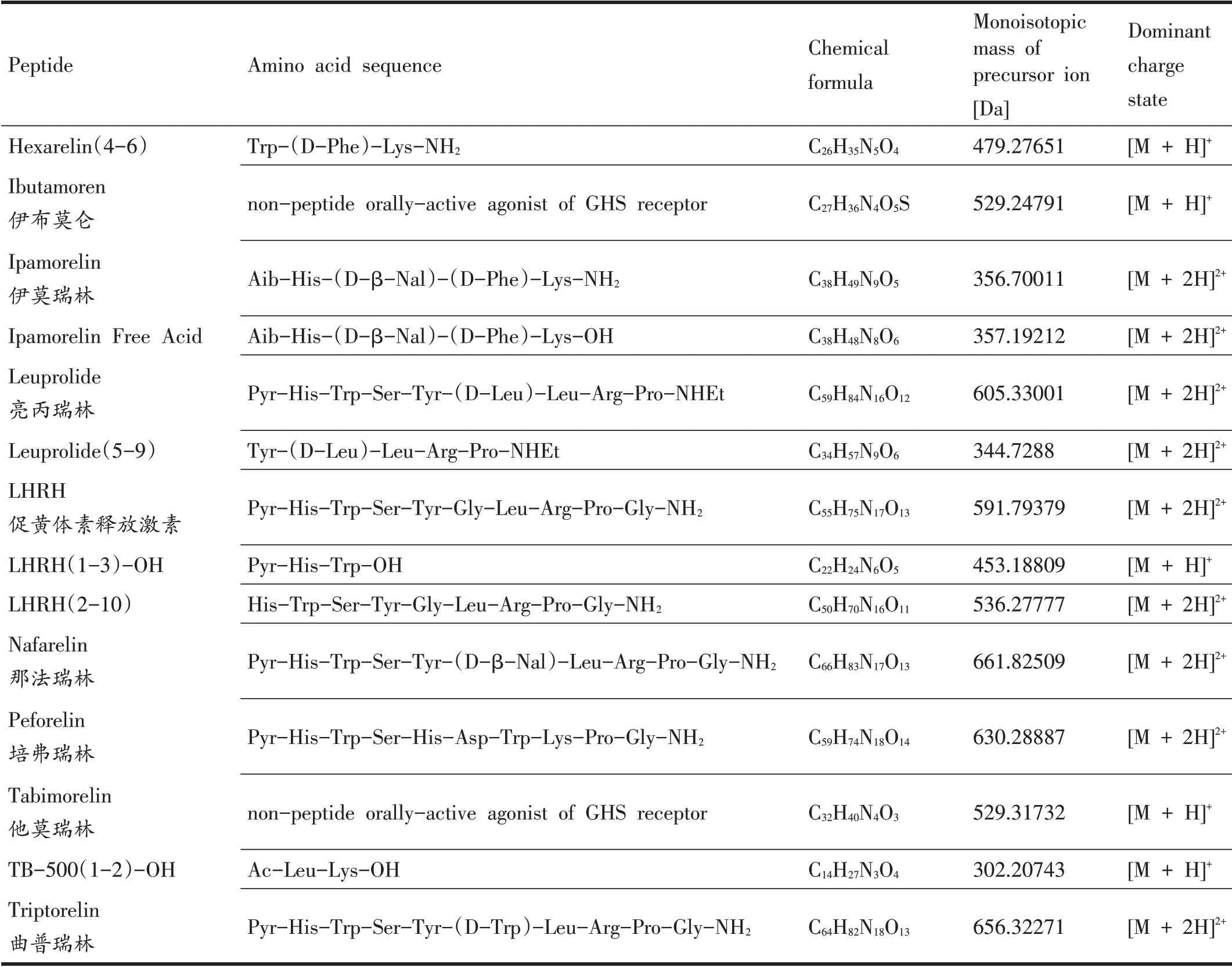
(续表1)
1 实验部分
1.1 标准品与试剂
标准品GHRP-1、GHRP-4、GHRP-5 来源于美国Abbiotec.LLC.;标准品Alexamorelin(3-6)-OH、AOD-9604-metabolite(7-16)、ARA-290、Desmopressin(1-7)-OH,Desmopressin(aa1-7)、Fertirelin、GHRP-1(2-4)FA、GHRP-1-(3-6)-OH、GHRP-1-(3-7)-NH2、GHRP-2(1-3)、GHRP-6 FA、GHRP-6(2-5)FA、GHRP-6(2-6)、Hexarelin(1-3)、Hexarelin(2-5)、Hexarelin(2-6)-OH、Hexarelin(4-6)、Ipamorelin Free Acid、Leuprolide(5-9)、LHRH(1-3)-OH、LHRH(2-10)、Peforelin、Anamorelin、TB-500(1-2)-OH、Ipamorelin 均来源于澳大利亚Auspep;标准品Alexamorelin、Desmopressin、Leuprolide 来源于德国Merck(Sigma-Aldrich);标准品Buserelin、Deslorelin、Hexarelin Free Acid、LHRH、Nafarelin、Triptorelin 来源于美国US Biological Life Sci.公司;其余标准品以及其来源:Ibutamoren(Key Organics,美国),Tabimorelin(吉尔生化上海有限公司),Felypressin(MedChemExpress,美国),GHRP-6(ProSpec-TanyTechnoGene Ltd.,以色列),GHRP-3(Toronto Research Chemicals,Inc.,加拿大);内标(Deamino-cys1,val4,D-arg8)-Vasopressin(DCVDV)来源于吉尔生化上海有限公司。
一次性耗材:2 mL 低吸附离心管(美国Axygen 公司)和250 μL低吸附内插管(美国Agilent公司)。
所需试剂:乙腈,甲醇,甲酸,甲酸铵(色谱纯,美国DIKMA TECHNOLOGY Inc.公司),去离子高纯水。
流动相A 的配置:称取2.52 g HPLC 级别甲酸铵,放入4 L溶剂瓶中,加入4 L去离子高纯水,加入2 mL甲酸溶液,充分混匀后,测量其pH值约为3.5,用装载了0.45 μm Sartorius Stedim过滤膜的溶剂过滤器进行过滤后方可使用。
样品稀释溶液的配置:取90 mL上述流动相A,过滤后加入至试剂瓶中,再加入10 mL 甲醇,充分混匀,使得流动相A与甲醇最终体积比约为9∶1。
1.2 内标溶液及标准品溶液制备
取等体积的乙腈和水混合后加入1%甲酸配置成为标准品稀释溶液。然后,取一定量的小肽固体标准品或内标标准品,加入对应量的1% 甲酸乙腈/水(1∶1)溶液,将其配制成为1 mg/mL的标准储备溶液,涡旋后,再用标准品稀释溶液将其逐级稀释成为不同浓度的储备液,最后得到1 ng/μL 的标准品溶液或0.5 ng/μL的内标溶液。
1.3 质量控制样品的制备(QCN,QCP 的制备)
收集不同匿名化的空白尿样混匀后,取3 份各1.5 mL按照小肽检测方法前处理后进行分析,确定不含待检测物质,则该尿液样本可作为阴性质量控制样品(quality control negative,QCN)。取检测过的空白样品,并加入适当浓度的标准品溶液,即可获得阳性质量控制样品(quality control positive,QCP)。
1.4 仪器设备
Ultimate 3000 超高效液相色谱-Q Exactive Plus组合型四极杆Orbitrap 质谱联用仪(Q Exactive Plus UHPLC/HRMS)(美国Thermo Fisher Scientific 公司)、METTLER PM200 分析天平、Genie Vortex-2 涡旋混合器(美国ScientificIndustries 公司)、高速离心机(美国SCILOGEX 公司)。
1.4.1 色谱条件
液相色谱仪为Ultimate 3000 UHPLC,液相色谱柱为Hypersil GOLD 1.9 μm × 100 mm × 2.1 mm id。使用流动相A为10 mmol/L 甲酸铵溶液和流动相B为甲醇溶液进行梯度洗脱,洗脱程序如表2所示,流动相流速为0.25 ml/min,柱温为30℃,进样体积为10 μL,采集时间为14 min。

表2 色谱梯度洗脱程序
1.4.2 质谱条件
采用Q Exactive Plus 组合型四极杆Orbitrap 质谱仪,电喷雾离子源( HESI),以正离子模式扫描;辅助气温度(aux gas heater temp)为350℃,流速(aux gas flow rate)为10 arb;鞘气流速(sheath gas flow rate):40 arb;喷雾电压(spray voltage):3.5 KeV;离子传输管温度(capillary temp):350℃;采集方式为全扫描(full scan)(resolution:70,000 FWHM;AGC:1e6;max.IT:100 ms;scan range:m/z 80 to 1000)和平行反应监测(parallel reaction monitoring,PRM)(resolution:35,000 FWHM;AGC:5e4;max.IT:100 ms;isolation window:2.0 m/z;nce:40)两种方式。
1.5 样品前处理
取1.5 mL 待测样品至低吸附离心管中,放置至室温后,与QCN和QCP一起加入20 μL内标溶液(0.5 ng/μL DCVDV),涡旋混匀后,以10000 r/min 离心10 分钟。将离心后的样品取150 μL 上清液转移至进样瓶中,加入150 μL 样品稀释溶液,涡旋混匀后,用Q Exactive Plus UHPLC/HRMS进样分析。
2 结果
2.1 实验结果
按上述实验方法,采用Q-Exactive plus UHPLC/HRMS 液质联用仪的全扫描(full scan)和平行反应监测(PRM)模式对含有42 种小肽类禁用物质及内标的阳性质量控制样品(QCP)进行定性分析,得到图1所示谱图。如图1 所示,在1/2 MRPL 下,本方法均可以正确检出尿样中的小肽类目标化合物(其信噪比S/N>3),色谱峰峰型良好,谱图清晰,其峰高及半峰宽均可满足WADA 的相关技术文件[12]的要求。而阴性质控样品(QCN)的谱图在与图1 对比后,在相同保留时间,目标化合物选择相同离子碎片,QCN 的窗口中均未出现干扰峰,因此,该方法具备较高的特异性和可靠性。
2.2 方法验证
该方法验证程序是基于WADA实验室国际标准以及相关技术文件等。主要针对定性检测42 种小肽类禁用物质或其代谢产物(分子量均小于2kDa),表3 所示为采集过程中所使用的42 种小肽物质的主要质谱参数:Full scan 母离子和3 个PRM 扫描的特征离子碎片的质荷比(通过实验优化,选取3 个干扰较少、丰度比较高的离子作为特征离子)及保留时间。通过对检出限、假阳性率以及基质效应的考察(如图1、表3和表4 所示),该方法具有高特异性、高灵敏度、高精确度及较好的稳健度(保留时间较为稳定),且满足WADA 对小肽类物质MRPL(2 ng/mL)的要求。此方法为直接进样分析,因此无需考察回收率。

表3 主要质谱参数(Full scan和PRM)及保留时间

图1 含42种小肽类禁用物质及内标的阳性质量控制样品(QCP)的UHPLC/HRMS PRM谱图
2.2.1 检出限
选择不同性别、比重(1.005~1.030)、pH(5~9)的空白尿样(不少于10 份),分别取1.5 mL,并加入42 种小肽类禁用物质的标准溶液和内标溶液,浓度均为MRPL 水平,混匀后按上述直接进样方法进行前处理,分别取150 μL 和50μL 上清液转移至进样瓶中,各加入150 μL样品稀释溶液,涡旋混匀后,进样分析,当信噪比S/N>3则认为检出,与尿样总数相比,若检出率大于90%(即假阴性率≤10%),则该浓度水平为该目标化合物的检出限(limit of detection,LOD)。由表4 可以看出,在MRPL浓度下,42种目标化合物的检出率均大于90%。而在1/2MRPL 的浓度下,除了Alexamorelin、AOD-9604-metabolite (7-16)、Deslorelin、GHRP-4、Nafarelin 外,其余目标化合物的检出率也均大于90%。42种小肽类目标化合物检出限的相关结果见表4。
2.2.2 假阳性率的计算
取不同性别、比重(1.005~1.030)、pH(5~9)的空白尿样(不少于20 份),加入内标,进行直接进样方法前处理后,进样分析。统计每种禁用物质在确定的保留时间的窗口内出现明显干扰的样品个数(信噪比S/N>3)与尿样总数相比,即为假阳性率,相关结果见表4。
2.2.3 基质效应的计算
另取300 μL 样品稀释溶液,并加入MRPL 水平的相同禁用物质的标准溶液和内标溶液,混匀后进样分析。通过对比前处理样品分析物的峰面积(A)和加在流动相标准溶液中分析物的峰面积(B)来评估基质效应,按以下公式计算:基质效应=(A/内标峰面积)÷(B/内标峰面积)× 100%。相关结果见表4。

表4 42种小肽类目标化合物的假阴性率、假阳性率、检出限以及基质效应
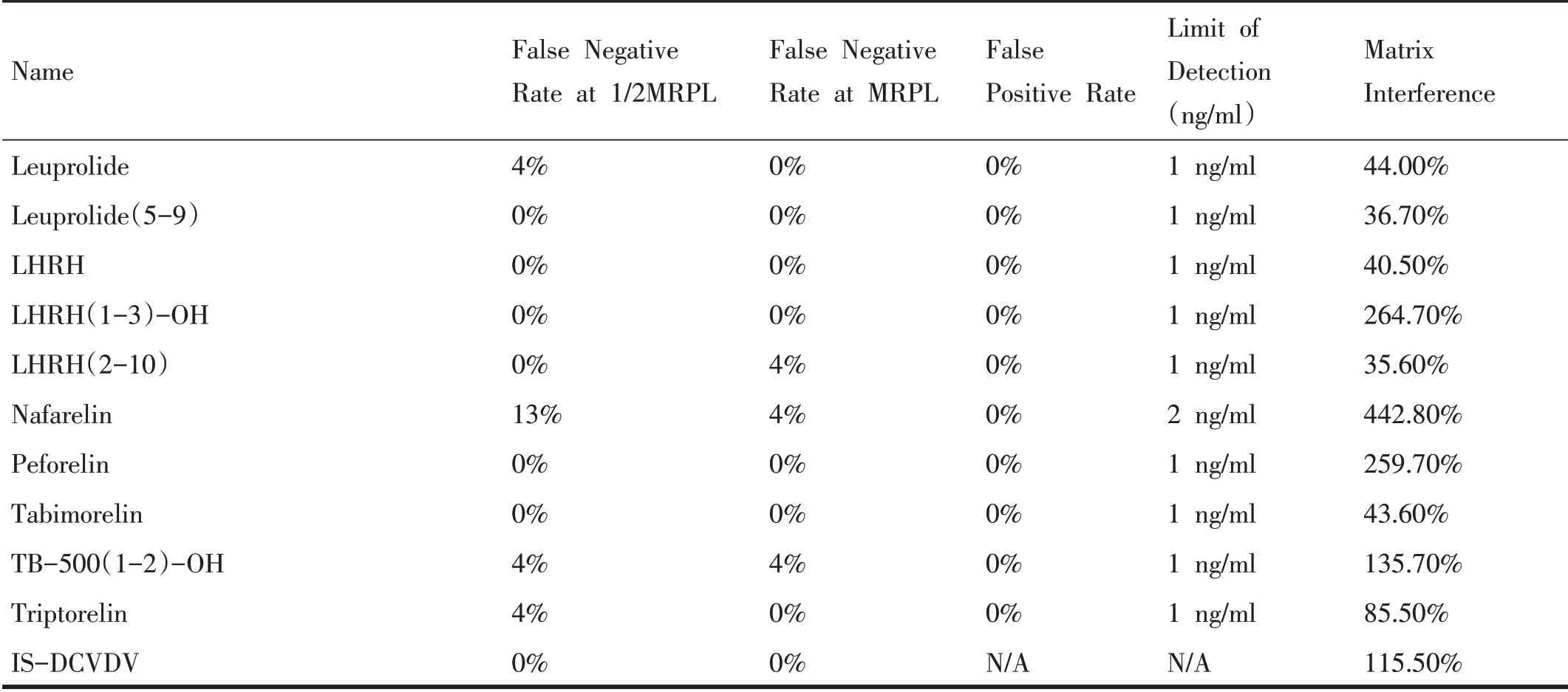
(续表4)
3 讨论
通过上述结果可以看出,直接进样方法可以保留更多样品信息,不会因为提取、纯化和预处理的过程,造成丢失部分样品信息,尤其是那些在SPE 提取过程中会出现信息大量损失的目标化合物,如LHRH(1-3)-OH、ARA-290等,这样可以更好地覆盖不同的小肽类物质。对于一些目标化合物,保留更多信息使其半峰宽变窄,峰高增大,峰型效果变好,审阅报告时更容易判断。而且由于直接进样方法简单,无需大量的试剂,步骤少,处理方式快速,这样可以节省人力物力,同时降低了前处理过程中可能引入的误差。该方法可以快速处理大量样品,避免样品积压导致的长时间存放产生的微生物降解等问题的发生。
然而,由于样品未经过提取纯化的处理,直接稀释后进样,样品中含有更多的杂质,导致谱图中噪音增大,对有些目标化合物的信噪比影响也随之增大,致使一些目标化合物在低浓度时,出峰效果不好,干扰较多。同时,未经提取纯化的样品,也会导致基质效应变大,从而对实验结果产生影响。因此,对于一些小肽类禁用物质,如AOD-9604,GHRP-2 等,本方法在MRPL浓度下尚不足以完成常规检测。在以后的实验中,仍需考虑将SPE方法和直接进样方法的前处理程序相结合,以达到对不同小肽类禁用物质及其代谢物的广泛覆盖,提供更高特异性及高效率的初筛检测方法。另一方面,由于直接进样方法中尿液样品中含有大量杂质(如尿蛋白、大肽等),尽管本方法已使用离心后尿液样品的上清液,但比起纯化后的样品,本方法还是更容易堵塞液相色谱柱。
4 总结
综上所述,直接进样的前处理方法,使得样品前处理的程序变得简单、高效,同时因为采用了Q Exactive Plus UHPLC/HRMS,所以尽可能多地保留了较高的检测灵敏度和特异性。本研究对该方法的检出限、基质效应等都进行了考察。实验结果表明,该方法的条件易于控制,结果准确,对于本次研究的42 种小肽类禁用物质或其代谢物,均可以完成常规检测,并能满足WADA对此类药品检测能力的要求。
