有氧运动联合维生素D干预改善db/db小鼠糖、脂代谢及肝脏炎症与氧化应激紊乱
2021-11-17刘军韩世坤马艳陈小红何玉敏孙晓敏
刘军 韩世坤 马艳 陈小红 何玉敏 孙晓敏
1 西安体育学院运动与健康科学学院(西安710068)
2 西安体育学院研究生部(西安710068)
3 西安交通大学公共卫生学院(西安710061)
4 西安交通大学全球健康研究院(西安710061)
糖尿病是一组因胰岛素分泌不足和/或生理作用受损而导致的以长期高血糖为主要特征的代谢性疾病,其中,2 型糖尿病(type 2 diabetes mellitus,T2DM)与体力活动和饮食习惯等生活方式关系最为密切[1]。研究已经证实,包括有氧运动和抗阻运动或者二者组合均能够通过降低体脂,改善体成分、血脂和血压,提高胰岛素敏感性,降低糖化血红蛋白(haemoglobin A1c ,HbA1c)等途径对糖尿病防治产生积极影响,但也有一些文献质疑,认为仅靠运动锻炼而没有营养方面的综合干预并不容易使病情得到有效缓解[2]。多项研究表明,维生素D 除了传统认识中调节血清钙和磷酸盐水平、维持骨骼健康功能之外,还与免疫系统、肌肉功能、心血管疾病、癌症进程、炎症和氧化应激调节等密切相关[3]。实验研究和流行病学调查均提示,维生素D 缺乏与胰岛素释放降低、胰岛素抵抗和T2DM 有关,特别是血清25(OH)D 的浓度较低,会直接增加代谢综合征和T2DM风险[4]。
体内炎症和氧化应激稳态失调是T2DM 的主要致病机制之一[5]。T2DM发病时,患者体内糖、脂代谢紊乱引起的慢性高血糖可引起过量自由基产生,导致内源性抗氧化系统的失衡,过多活性氧的产生导致体内急性和慢性炎症。核转录因子-κB(nuclear factor κB,NF-κB)既是炎症的主要调节器,又是体内氧化应激的监测器,在体内炎症和氧化应激共同调节途径中具有重要作用[6]。肝脏处于调节体内糖、脂代谢的核心位置,在T2DM 中,肝脏的糖和脂肪生物合成能力升高,从而导致高血糖和高甘油三脂血症。db/db小鼠是4号染色体的瘦素受体基因发生突变所诱发的自发型肥胖型2 型糖尿病动物模型,具有明显的高糖血症,出生4周左右血糖开始升高,表现出高胰岛素、高血糖、多饮、多食、多尿、肥胖和脂代谢异常等与人类T2DM 极为相似的症状,是公认且研究T2DM 时广泛应用的理想动物模型。因此,本研究通过有氧运动联合维生素D 注射干预db/db小鼠,探讨其联合干预效果及可能作用机制。
1 材料与方法
1.1 实验动物及分组
无特定病原体(specific pathogen free,SPF)级健康、雄性db/db小鼠,实验动物质量合格证:SCXK(苏)2016-0010,32只,7周龄,由南京君科生物有限公司提供,每笼2只,分笼饲养。动物饲养室为西安体育学院实验中心动物房,湿度保持在40%~70%,温度为20℃~25℃。笼具清洁卫生,实验动物自由摄取食物和水,小鼠饲料为实验鼠生长繁殖饲料(协同生物),取自来水。
小鼠购回后先适应性饲养3 天,后被随机分为对照组(CG)、有氧运动干预组(EG)、维生素D 注射干预组(VG)和有氧运动联合维生素D 注射干预组(EVG),每组8只,进行为期8周的有氧运动联合维生素D注射干预实验。
1.2 运动及维生素D干预方案
1.2.1 有氧运动干预方案
EG和EVG组小鼠适应性饲养结束后,进行3天的适应性跑台训练,然后开始8 周的有氧运动干预实验。有氧运动干预方案参照文献[7,8]设计,跑速控制在8~12 m/min(运动强度保持在72%~76%VO2max),每次运动时间为30 或60 min。EG 和EVG 组每周运动5天,周末休息,CG和VG组小鼠在运动日静置跑台相同时间作为对照。
具体方案:第1周跑速8 m/min,强度72%VO2max,时间30 min;第2周跑速、强度同第1周,时间为60 min;第3~6周跑速10 m/min,强度74%VO2max;第6~8周为跑速12 m/min,强度76%VO2max;第3~8周运动时间均为60 min。
1.2.2 维生素D注射干预方案
VG 及EVG 组小鼠用1,25-二羟维生素D3[1,25(OH)2D3]进行腹腔注射。用大豆油(250 mL,Acmec)将1,25(OH)2D3(2 mg,MCE试剂)溶解,配制成所需浓度溶液,具体干预剂量为每日7 μg/kg[9],每周注射3次,连续干预8 周。CG 与EG 组小鼠以等量大豆油腹腔注射作为对照。
1.3 动物取材
干预实验期间每周周日早8 点小鼠尾部采血,用于各组小鼠空腹血糖(采样前禁食16 h)测定;8 周干预实验结束后,禁食至次日晨,20%乌拉坦腹腔注射麻醉(0.5 mL/100 g),摘取眼球取血并分离血清备用;保持低温开胸,摘取肝脏分别于液氮或4%多聚甲醛进行保存,用于相关蛋白表达水平和组织切片HE染色的检测。
1.4 指标测试
1.4.1 血液指标测试
采用德国EKF乳酸盐分析仪的葡萄糖传感器及测定试剂(购自北京德福康科贸有限公司)测定血糖;采用ELISA试剂盒(购自上海西唐生物科技公司)测试血清胰岛素(insulin);采用南京建成生物工程研究所提供的试剂盒测定血清总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、低密度脂蛋白胆固醇(low density lipoprotein cholesterin,LDL-C)和高密度脂蛋白胆固醇(high density lipoprotein cholesterin,HDLC)等血脂四项指标。
1.4.2 肝脏指标测试1.4.2.1 肝脏糖原含量、炎症因子和抗氧化指标的测定
将液氮保存肝组织经匀浆后收上清液,采用试剂盒测试肝糖原(glycogen)含量,采用ELISA 测定肝脏C反应蛋白(C-reaction protein,CRP)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白介素-6(interleukin-6,IL-6)等炎症因子,试剂盒购自上海西唐生物科技有限公司;采用试剂盒测定肝脏丙二醛(malondialdehyde,MDA)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、超氧化物歧化酶(superoxide dismutase,SOD)等抗氧化指标,试剂盒由南京建成生物工程研究所提供。
1.4.2.2 肝脏核转录因子(NF-κB)和葡萄糖转运体4(Glut-4)表达的测定
称取液氮保存的大鼠肝脏组织50 mg 剪碎,加入提前配制好的裂解液(6 μL/mg),经过低温匀浆,离心后提取蛋白上清液,用BCA法进行蛋白定量,BCA蛋白定量试剂盒购自北京鼎国昌盛有限公司,兔多克隆抗体Glut4、NF-κB p65购自Abcam公司。
常规Western Blotting 实验检测Glut4 和NF-κB p65,一抗稀释浓度为1∶1000,经过上样、SDS-PAGE凝胶电泳分离、湿法转膜、室温封闭、4℃一抗孵育过夜,次日漂洗,室温二抗孵育,洗膜,ECL 发光等过程,利用凝胶成像系统成像,采用灰度值进行量化分析。
1.4.2.3 肝脏HE染色
将肝脏组织切成1 cm×1 cm×0.5 cm 小块,置于4%多聚甲醛中固定24 h,流水轻涤1 h后,以70%酒精为起始浓度,梯度脱水,两次二甲苯透明,石蜡包埋,制成5 μm 厚的切片,经HE 染色后,置于目镜10×、物镜20×光学显微镜下观察并拍照。
1.5 图像分析与统计学处理
Western Blotting 实验结果图片用Image Lab 5.2进行灰度分析统计,显微镜图像用Image-Pro Plus 5.1软件进行分析。实验所得数据使用SPSS 20.0 软件进行统计分析,不同组血糖随着时间变化趋势的差异,通过重复测量(repeated measures)方差分析计算时间与分组之间的交互效应进行比较。运动与维生素D在同一时间点上对血糖或其他指标作用效果,以这两个干预作为因子,通过双因素方差分析(two-way ANOVA)的主效应和交互效应进行分析,当交互效应不显著时(P>0.05),使用主效应分析进行组间比较,当交互效应显著时(P<0.05),进行事后检验的两两比较以明确其单独效应。
2 结果
2.1 实验干预期间各组小鼠血糖变化
图1 为干预期间小鼠血糖检测结果,重复测量方差分析显示,组别与时间存在显著交互效应,即与CG组比较,EG、VG 和EVG 组血糖变化趋势存在差异(P<0.05)。双因素方差分析显示,运动与维生素D 对血糖的影响无显著交互效应(P>0.05);主效应分析显示,至第8周时,EG、VG和EVG组小鼠血糖均显著低于CG组(P<0.01),EVG组下降程度更明显。
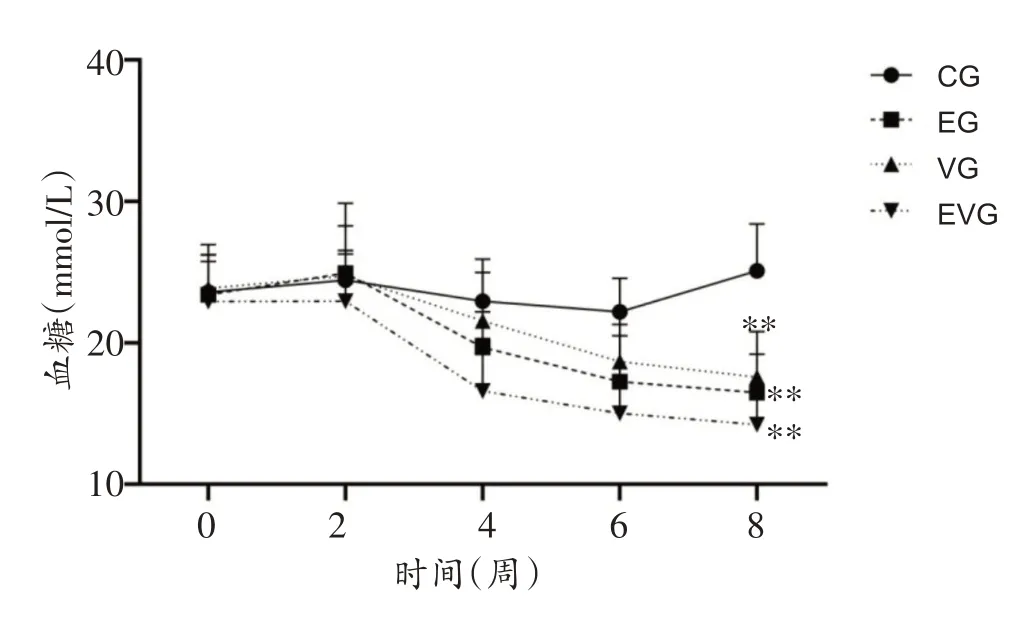
图1 实验干预期间各组小鼠血糖变化结果比较
2.2 各组小鼠血脂、血胰岛素及肝脏糖原、炎症因子和氧化应激指标变化
表1显示,8周的有氧运动联合维生素D干预后小鼠血清胰岛素、血脂、肝糖原、炎症因子和抗氧化指标存在组间差异,但运动与维生素D不存在交互效应(P>0.05),主效应分析结果如下:
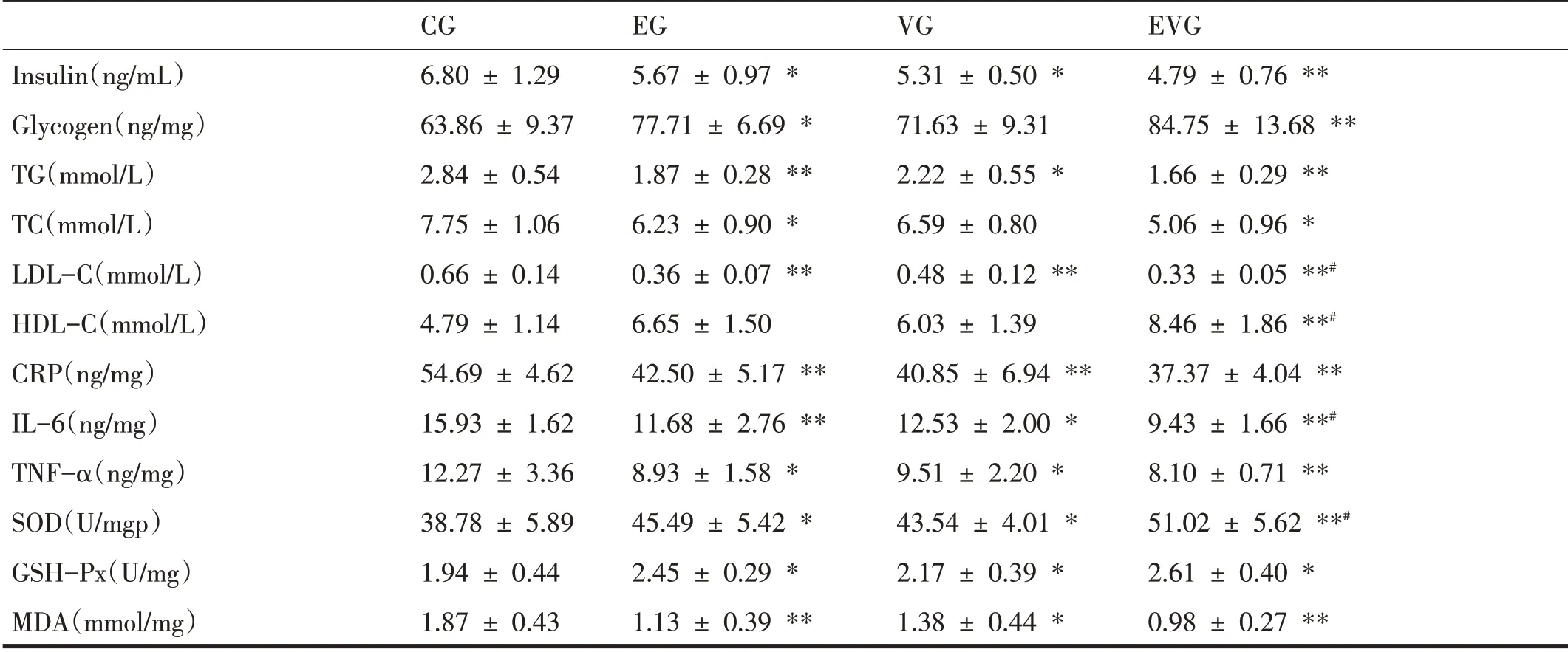
表1 干预后各组小鼠指标变化比较(n=8)
小鼠血清胰岛素检测结果显示,8周干预后,EG组和VG 组胰岛素水平显著低于CG 组(P<0.05),EVG 组极显著低于CG组(P<0.01),表明联合干预相比各单一干预对小鼠血清胰岛素稳定有更好的效果。肝糖原检测结果显示,EG 组和EVG 组肝糖原含量显著高于CG组(P<0.05,P<0.01),表明干预后肝糖原合成增加或者分解减少。
小鼠血脂检测结果显示,8 周干预后,血清TG 结果,EG 组、VG 组和EVG 组均显著低于CG 组(P<0.01、P<0.05、P<0.01),干预后3 组小鼠血清TC 和LDL-C 下降趋势和TG一致,表明运动或运动联合维生素D组对TG、TC 和LDL-C 干预效果更好;EG 组、VG 组和EVG组HDL-C 均高于CG 组,但只有EVG 组具有统计学差异(P<0.01)。EVG组LDL-C显著低于VG组(P<0.05),HDL-C 显著高于VG 组(P<0.05),提示对于血脂而言,运动干预效果更为明显。
小鼠肝脏炎症因子检测结果显示,8 周干预结束后,EG 组、VG 组和EVG 组小鼠肝脏IL-6 和CRP 含量均不同程度低于CG组,与CG组比较均有显著差异(P<0.05);EVG组IL-6含量显著低于VG组(P<0.05),表明运动或运动联合维生素D 干预对IL-6 的抑制效果更好;小鼠肝脏CRP 各干预组之间相互比较无差异;EG组、VG 组和EVG 组小鼠肝脏TNF-α均显著低于CG 组(P<0.05)。
小鼠肝脏氧化应激指标检测结果显示,EG、VG 和EVG组肝脏SOD和GSH-Px水平均显著高于CG组(P<0.05);EVG 组SOD 水平显著高于VG 组(P<0.05);EG、VG 和EVG 组肝脏MDA 水平均显著低于CG 组(P<0.01、P<0.05、P<0.01)。
2.3 各组小鼠肝组织HE染色结果
8 周实验结束后,各组小鼠肝组织HE 染色后病理变化见图2。CG 组大鼠肝组织呈现弥漫性的脂肪变性,肝细胞脂质沉积比较明显,出现较多的大小不一的空泡;EG 组和VG 组小鼠有所改善,空泡变性减少,EVG组肝细胞排列整齐,脂质沉积和空泡明显减少,联合干预效果明显优于单一干预组。
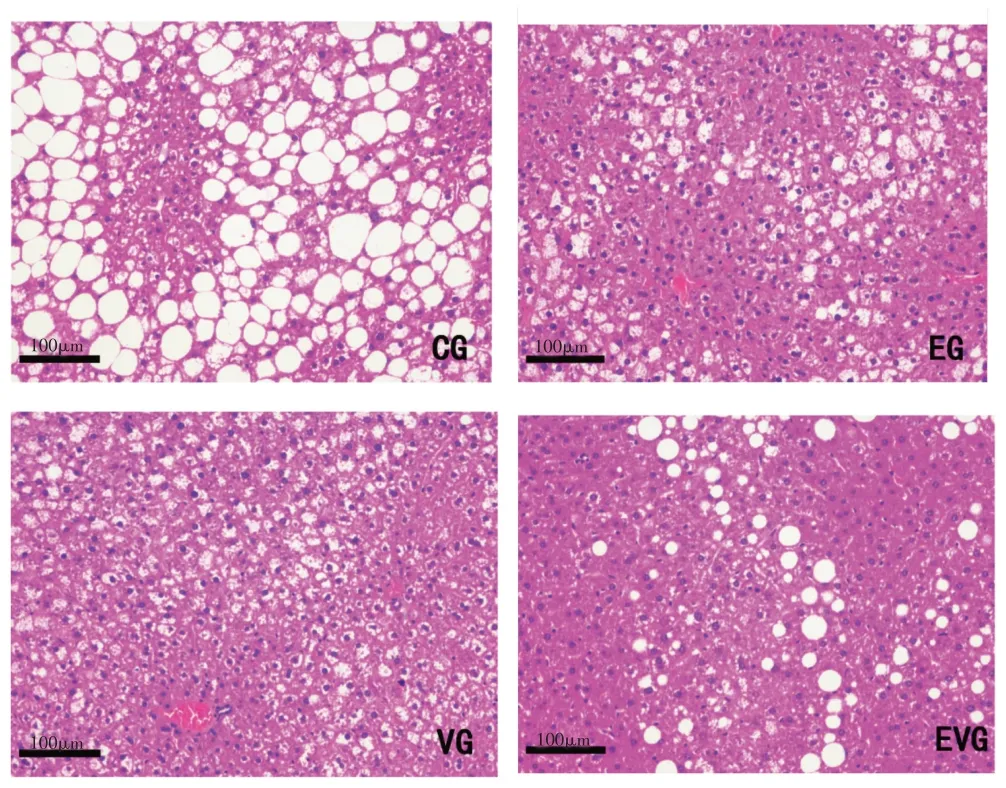
图2 实验干预后小鼠肝组织HE染色病理改变(×200)
2.4 有氧运动联合维生素D 干预调节小鼠肝组织中NF-κB和Glut4蛋白表达
图3结果显示,有氧运动结合维生素D干预后小鼠肝组织NF-κB 和Glut4 蛋白表达存在组间差异,但“运动”与“维生素D”不存在交互效应(P>0.05)。主效应分析显示,8周干预实验结束后,EG组、VG组和EVG组小鼠肝脏NF-κB蛋白表达显著低于CG组(P<0.01),EVG组表达显著低于VG 组(P<0.05);EG、VG 和EVG 组肝脏Glut4 蛋白表达显著高于CG 组(P<0.05、P<0.05、P<0.01)。
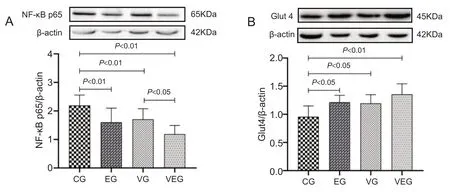
图3 实验干预后小鼠肝脏NF-κB和Glut4蛋白表达结果(n=8)
3 讨论
对于新确诊的糖尿病患者或者是为预防糖尿病发生,运动都是首先推荐的干预方式,但运动效益与运动的强度、量等高度相关,因为在慢性疾病患者中,剧烈运动会增加健康风险[10]。通过每周进行5~6次持续时间为30~60 min的有氧运动(其中2~3次结合抗阻训练)结合饮食的生活方式干预可以降低患者血清HbA1c,减少治疗用降糖药物用量[11]。
通常体内维生素D 是否缺乏需要根据血清中25(OH)D 的浓度来确定,欧洲内分泌协会将维生素D 缺乏、不足和充足分别定义为血清25(OH)D<20.0 ng/mL(<50 nmol/L)、20~29.9 ng/mL(50~75 mmol/L)和≥30 ng/mL(>75 nmol/L)[12]。对中国不同地区不同人群的调查文献显示,血清中25(OH)D 处于缺乏状态(<50 nmol/L)的比例分布在30%~96.8%之间,尽管数值范围差异较大,但多数文献显示,中国维生素D不足人口在70%左右[13]。维生素D 的缺乏会增加T2DM 的发病率,Afzal等的meta分析研究发现血中25(OH)D的低水平会增加未来T2DM 的患病率[14]。2016年Sun 等发表的以日本成年人为研究对象的为期1年的维生素D干预试验发现血清25(OH)D 水平升高的同时胰岛素抵抗(insulin resistance,IR)的水平也被显著降低[15]。上述研究提示,在摄取维生素D 或者保持高水平的血中25(OH)D浓度可以预防IR和T2DM的发生,但是在T2DM 人群中却没有得到一致的结论。肝脏是体内糖调节的核心器官,肝脏功能受损会导致空腹或餐后高血糖。有研究证实在糖尿病确诊前18 个月肝脏谷丙转氨酶(alanine transaminase,ALT)和TG 就稳定升高[16]。而肝脏脂肪变性是最常见引起ALT中度升高的原因,因此,研究肝脏对胰岛素的敏感性和肝脏脂肪的储存程度对于认识糖尿病十分重要。
3.1 有氧运动联合维生素D干预对db/db小鼠糖、脂代谢紊乱的调节及可能机制
正常餐后血清高胰岛素-高血糖可促使肝糖原最大程度合成,但T2DM 时此通路受阻,肝脏胰岛素抵抗导致二酯酰甘油依赖的蛋白激酶Cε(protein kinase Cε,PKCε)被激活,抑制胰岛素受体(insulin receptor,InsR)Thr1160 位点磷酸化,使胰岛素刺激的肝糖原合成受阻[17],导致空腹或餐后高血糖。因此,糖尿病患者或者糖尿病模型的动物,肝糖原贮量较正常人均明显降低。
在本研究中,有氧运动、维生素D以及有氧运动结合维生素D干预8周后,实验小鼠高血糖和高胰岛素血症得到有效缓解,肝脏糖原贮存增加,血浆TG、TC 下降,LDL-C 下降,HDL-C 升高。运动或/和维生素D 干预通过纠正T2DM 时的激素以及底物调控功能失衡,使肝糖生成的两个主要过程重新进入有序调控。究其原因,无论有氧运动或抗阻运动,均可通过调节HbA1c、身体质量指数(body mass index,BMI)、TC、TG、LDL-C、HDL-C来改善胰岛素抵抗、促进胰岛素分泌,还可降低T2DM发生心血管相关并发症的风险[18]。
虽然补充维生素D 的效果有不一致的结论,但高血清25(OH)D浓度与HDL-C呈正相关,与TG呈负相关,可使LDL-C/HDL-C 或TC/HDL-C 比值降低,这已经在诸多研究中被证实[19]。有研究发现在补充维生素D后,糖尿病患者血清25(OH)D水平显著升高,空腹血糖和HbA1c显著下降,而且下降程度与25(OH)D水平呈正相关,对LDL-C 和TC 也有显著改善[20-21]。但同时有研究认为血清高25(OH)D 水平(>61 ng/mL)时,相比血清中25(OH)D(35~61 ng/mL)、低(<35 ng/mL)水平对TC 和LDL-C 降低趋势更显著,高25(OH)D 水平时HDL-C也呈现较高水平,分析认为这可能与血清载脂蛋白A1浓度升高有关[22]。Patel等用4个月时间把受试对象血清25(OH)D水平分别从17.6 ± 1.5 ng/mL和15.6 ± 1.4 ng/mL 提高到25.5 ± 1.8 ng/mL 和27.4 ±2.4 ng/mL 后,受试者空腹血糖、HbA1c、血脂水平相比之前并没有显著差异,该项研究者提出血清25(OH)D浓度至少要大于32 ng/mL 后可能才会有显著改善效果[23]。这基本与本研究的结果一致,本研究中,干预组血清25(OH)D 浓度均较高,最低的EG 组为47.45 ±9.28 ng/mL,为取得干预效果奠定了量效基础。
在经双因素方差分析后,并没得出补充维生素D和有氧运动的显著交互效应,但联合干预还是出现了更好的干预趋势,推测可能与维生素D 对运动特别是有氧运动能力有促进作用,增加了机体对运动的良好适应有关。业已证实,维持胰腺β细胞中维生素D受体(vitamin D receptor,VDR)的水平,可以保护β细胞的数量和功能,防治糖尿病[24]。8周骨化三醇治疗可通过增加胞质钙浓度,激活钙离子/钙调蛋白依赖性蛋白激酶激酶β/腺苷酸活化蛋白激酶(Ca2+/CaMKKβ/AMPK)信号通路降低T2DM 胰岛素抵抗条件下的肝脏甘油三酯积累和葡萄糖输出,改善db/db 小鼠的肝脏异常的糖、脂代谢[25]。此外,有研究认为维生素D 对耐力性项目运动表现有促进作用,血清25(OH)D每增加1 nmol/L,受试者1.5 英里的跑步时间就会提高0.5 s,最佳耐力也出现在血清25(OH)D 浓度大于30 ng/mL的受试者上[26]。本研究中,补充维生素D虽然不是以提高运动表现为目的,但其背后机制仍然是维生素D 有助于身体对运动产生适应,使运动效益最大化。
3.2 有氧运动联合维生素D 干预对db/db 小鼠肝脏炎症和氧化应激调节及可能机制
T2DM时长期糖、脂代谢紊乱引起的血管并发症是糖尿病致死的主要原因,这可能与T2DM 时血管氧化应激增强引起的脂质过氧化损伤有关,而LDL 的载脂蛋白成分脂质过氧化可能是其主要诱因[27]。正常生理状态时,胰岛素与受体发生反应,导致蛋白激酶B(protein kinase B,Akt)活化,使葡萄糖转运体4(Glut4)转移至细胞膜上,血浆中葡萄糖被转运进细胞,通过糖酵解生成乳酸,或进入呼吸链彻底氧化后释放能量;T2DM 时,细胞氧化磷酸化功能受损,NADH 氧化还原酶和柠檬酸合成酶活性降低,过高的葡萄糖发生自氧化生成酮醛和超氧化物,损害线粒体生物功能,产生过量活性氧(reactive oxygen,ROS)[28],诱导NF-κB等蛋白过表达,抑制磷酯酰肌醇-3-激酶(phosphatidylinositol 3 kinase,PI3K)/蛋白激酶B(PI3K/Akt)通路,Glut4 表达下调,导致细胞损伤和后期并发症[29]。T2DM患者体内糖化蛋白、葡萄糖氧化、脂质过氧化等非酶因素表达过高,或过氧化氢酶(catalase,CAT)、超氧化物歧化酶(superoxide dismutase,SOD)和谷胱甘肽过氧化物酶(GSH-Px)等酶类物质表达过低均可打破体内自由基产生和清除之间的稳态,产生过量自由基[30]。因此,体内充足的SOD 和GSH-Px 可以帮助维持自由基稳态,降低线粒体内膜超极化和ROS 的形成,阻断葡萄糖诱导的细胞死亡,维持糖、脂代谢正常。糖、脂代谢紊乱会导致炎症,脂肪累积后可通过增加巨噬细胞分泌TNF-α、导致NF-κB活化等途径增加炎症反应[31],导致胰岛素抵抗。
在本研究中,运动、维生素D 及二者联合干预后,肝细胞脂肪变性被明显抑制,脂质沉积和空泡减少,肝脏促炎因子IL-6、TNF-α显著降低,CRP 降低,说明不同干预手段均有效抑制了肝脏的炎症反应;而抗氧化酶SOD 和GSH-Px 表达显著升高,氧化应激产物MDA显著降低,说明干预纠正了肝脏氧化应激稳态的失衡;炎症途径主要调控因子NF-κB表达降低,而Glut4则显著升高,说明无论是8 周的有氧运动还是维生素D 注射,或者二者联合干预,都能够通过调节肝脏氧化应激和炎症水平,恢复生理稳态,纠正胰岛素分泌不足或者胰岛素抵抗,通过Glut4 促进葡萄糖向细胞内的转运[32],恢复能量供应稳态而对db/db 小鼠的糖、脂代谢紊乱起到调节作用。其机制可能与运动或/和维生素D能够通过提高抗氧化酶活性帮助机体对抗氧化应激,调节线粒体自噬纠正氧化应激损伤[33],降低脂肪分泌的炎性细胞因子抵抗素[34],抑制M1 巨噬细胞分泌TNF-α,下调下游通路NF-κB 表达,降低IL-1 表达等有关[29],刺激IL-1ra 产生直接抗炎作用,改善葡萄糖耐量,从而对T2DM和心血管疾病产生益处[35]。
其他研究也证实,通过隔天腹腔注射25(OH)D(5 μg/kg)可降低db/db 小鼠细胞信号转导抑制因子3(Suppressors of cytokine signaling,SOCS3)的表达,从而抑制NF-κB 促炎信号通路,进一步减少衰老相关分泌表型(senescence-associated secretory phenotype,SASP)的分泌[36],这也提示,25(OH)D 对糖尿病及其并发症的干预有多种效果,但对体内炎症改善是共同作用机制。维生素D还可通过激活肝巨噬细胞VDR可改善肝脏炎症、脂肪变性,显著提高胰岛素敏感性,改善胰岛素抵抗,使肝脏葡萄糖产出显著降低[37]。其他研究也证实,维生素D 具有间接的抗氧化特性,可通过介导细胞核内的VDR 保护细胞免受ROS 导致的细胞损伤,从而减缓氧化应激诱导的胰岛素抵抗[38]。Sinha等证明,经补充维生素D提高血清25(OH)D浓度后,可提高机体氧化磷酸化能力,减少磷酸肌酸恢复一半的时间[39]。运动联合维生素D表现出了更好的改善趋势,也可能与维生素D 帮助纠正运动过程中稳态失调,通过VDR 修复运动过程中发生微损伤的肌肉组织,诱导肌细胞分化和肌肉蛋白质合成等因素有关[40]。
此外,在25(OH)D3向1,25(OH)2D3的转化过程,可通过抑制树突状细胞分化和对巨噬细胞胆固醇的摄取下调CRP、TNF-α、IL-1等促炎因子,上调IL-10等抗炎细胞因子,防止炎症造成的β细胞破坏[41]。
4 结论
8周有氧运动、维生素D注射和有氧运动联合维生素D 注射干预可改善db/db 小鼠糖、脂代谢紊乱,降低血清胰岛素和空腹血糖水平、改善血清脂质水平,降低肝脏脂质沉积和肝细胞脂肪变性,肝糖原贮量增加;机制可能与运动或/和维生素D通过提高肝脏抗氧化酶活性,降低肝细胞氧化应激和炎症水平,进而改善胰岛素抵抗,促进葡萄糖利用和糖原贮存有关。
