巨型艾美耳球虫裂殖子的分离和纯化
2021-09-18张榕珍王黎霞郭许情张天宇张建军
张榕珍,王黎霞,郭许情,张 健,张天宇,张建军,安 健*
(1. 北京农学院动物科学技术学院,北京 102206;2. 北京农业职业学院牧医系,北京102442)
巨型艾美耳球虫(Eimeriamaxima)是集约化鸡场常见的球虫之一,也是7种禽类艾美耳球虫中田间检出率较高的虫种[1-2]。由于该虫种免疫原性较高,近年来成为相关领域的研究热点。裂殖子是球虫无性生殖阶段的虫体。分离和纯化出大量虫体是研究球虫免疫学、生物化学、抗药性以及细胞共培养的基础。然而,目前关于裂殖子分离和纯化的报道十分有限,且主要集中在柔嫩艾美耳球虫(Eimeriatenella),毒害艾美耳球虫(Eimerianecatrix)和堆型艾美耳球虫(Eimeriaacervulina),缺乏巨型艾美耳球虫裂殖子分离和纯化的相关报道。
巨型艾美耳球虫第1代裂殖子出现的最早时间是在感染后48 h,最短潜隐期为121 h[3-4],但分离裂殖子的时间未被确定。此外,巨型艾美耳球虫被公认为寄生于小肠中段,但是能分离较多裂殖子的具体肠段未被细化。此前,有研究人员在不同接种时间分肠段对巨型艾美耳球虫的内生性发育进行研究,发现随感染时间的变化,裂殖子不同发育阶段的寄生部位有所改变[5]。
据报道,裂殖子可通过密度梯度离心法、酶消化法、过滤法和层析法进行纯化。有研究者将酶消化法与密度梯度离心法相结合,获得纯度较高的柔嫩艾美耳球虫2代裂殖子[6-7]。此外,通过DEAE-52纤维素柱层析法结合过滤法和差速离心法能获得纯净裂殖子[8-9]。该方法较好的避免了密度梯度制备过程中由于操作失误造成材料浪费的可能性,虽然过程复杂,但操作易于进行,获得裂殖子纯化程度较高,试验效果较为理想。
本研究收集感染后48~124 h的巨型艾美耳球虫裂殖子,筛选能够分离较多裂殖子的时间和位置;经粗纯化后,通过DEAE-52纤维素柱层析法对裂殖子进一步纯化,并确定收集纯净裂殖子的最佳时间,为在合适的时间及肠段分离并纯化巨型艾美耳球虫裂殖子提供参考。
1 材料与方法
1.1 试验动物及虫株
1日龄健康白羽肉鸡购买于北京农效禽业有限责任公司,饲养在无球虫环境下,饲喂无球虫、无药物添加的饲料及自来水,自由饮食;巨型艾美耳球虫虫株由中国农业大学寄生虫试验室惠赠。该试验已通过北京农学院动物福利与伦理审查,编号为BUA2020093。
1.2 试剂和仪器
DEAE-52纤维素:Biotopped试剂公司;洗脱液(pH8.0 Glycine-NaCl缓冲液),2.5%重铬酸钾溶液,饱和食盐水,HCl、NaOH等(化学试剂购自北京试剂公司)。
组织匀浆机,离心机,0.074 mm标准网筛,层析柱(直径1.5 cm,柱高25.0 cm),血球计数板。
1.3 巨型艾美耳球虫卵囊的制备
为保证虫株活力,将北京农学院预防兽医学实验室保存的巨型艾美耳球虫进行复壮。分别对20只14日龄无球虫肉鸡感染孢子化卵囊,每只鸡感染15×104个。收取感染后5~9 d的粪便,用饱和食盐水漂浮法[10]分离纯化卵囊,置于2.5%重铬酸钾溶液中,在28 ℃下通风孢子化24 h,保存在4 ℃冰箱中备用。
1.4 分离巨型艾美耳球虫裂殖子最佳时间的探索
对57只25日龄肉鸡进行攻虫,每只感染3×105个卵囊。肉鸡感染后,分别在感染后48、56、60、64、68、72、76、80、84、88、92、96、100、104、108、112、116、120和124 h扑杀3只感染肉鸡,收取十二指肠末端到卵黄蒂后5 cm处的肠段,洗去肠段内容物,置于0 ℃洗脱液中,用载玻片刮取肠黏膜。组织匀浆器处理3~5 min,使裂殖子充分游离在缓冲液中,用0.074 mm标准网筛过滤除去大块组织和部分杂质。滤液经1 500 r/min离心10 min,弃上清,重悬沉淀后加洗脱液定容至60 mL。洗脱液600 r/min离心8 min,除去体积和密度较大的红细胞和杂质,收集上清。用血球计数板对粗纯化的裂殖子进行计数,确定最佳分离时间。
1.5 确定分离巨型艾美耳球虫裂殖子的最佳肠段
对5(n=3)只肉鸡口服接种3×105个孢子化卵囊,在分离裂殖子的最佳时间扑杀。取十二指肠末端到卵黄蒂后5 cm处小肠并均分为5段,并依次编号。具体分段方法及位置如表1所示。
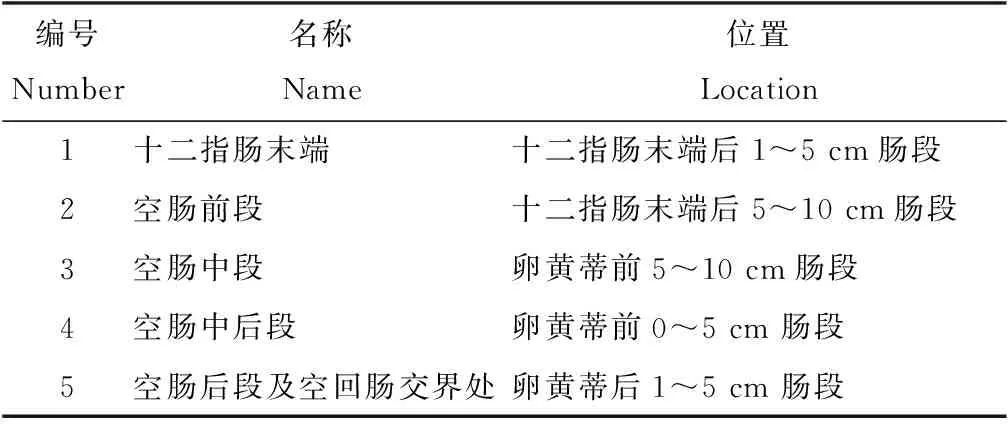
表1 肠段的分段方法及位置Tab.1 Segmentation method and location of intestinal segments
依照“1.4”中所述方法对每个肠段中的裂殖子进行分离和粗纯化,并通过血球计数板镜下计数。使用Graphpad Prism 7.0对数据进行统计分析,以确定分离巨型艾美耳球虫裂殖子的最佳肠段。
1.6 DEAE-52纤维素柱层析纯化裂殖子
1.6.1 DEAE-52纤维柱的制备 于试验前2 d对DEAE-52纤维素进行预处理。取适量DEAE-52纤维素,加入去离子水溶胀24 h,每8 h更换1次去离子水。然后弃掉上清,用0.1 mol/L NaOH溶液处理1 h,去离子水洗涤至pH=7;0.1 mol/L的HCl溶液处理1 h并洗涤至pH=7,自然沉淀。随后弃上清并加入洗脱液,将纤维素平衡至pH=8后装柱,柱高5 cm,备用。
1.6.2 巨型艾美耳球虫裂殖子的纯化 将粗纯化的60 mL含裂殖子的洗脱液缓慢倒入层析柱中,用玻璃棒引流,注意不要破坏纤维柱平面。准备收集管并编号为1号到30号,从第1管开始收集层析液,依次收集至第30管。层析液流速为2 mL/min,每个收集管收集2 mL。用血球计数板对每管中的裂殖子进行计数。使用Graphpad Prism 7.0对数据进行统计分析。
2 结 果
2.1 巨型艾美耳球虫裂殖子最佳分离时间
感染后48 h,鸡肠道上皮中有巨型艾美耳球虫裂殖子产生;感染后60 h裂殖子增加趋势开始明显,于感染后84 h达到峰值;88~92 h裂殖子显著下降,92 h后缓慢下降至较低水平。感染后84 h为收集巨型艾美耳球虫裂殖子的最佳时间(图1)。
2.2 分离巨型艾美耳球虫裂殖子的最佳肠段
对5个不同肠段中的裂殖子数进行统计分析,空肠中后段、空肠后段及空回肠交界处裂殖子数显著增加(P<0.05),占整个肠段裂殖子总数的62%(图2)。这表明在感染后84 h,较多的裂殖子寄生在空肠后段。
2.3 DEAE-52纤维素柱层析纯化过程中巨型艾美耳球虫裂殖子数变化
从第1管开始依次收集到第30管,收集到的裂殖子先增后减(图3)。从第3管开始,收集的裂殖子数呈明显增长趋势,第15管收集液中裂殖子数达到最高峰,随后呈下降趋势。第22管后裂殖子数明显降低,到第24管下降至较低水平。60 mL含裂殖子的洗脱液经DEAE-52纤维素柱层析纯化后,共收集到约4.48×108个裂殖子,收集率为69%。1管到22管中收集的裂殖子数达到收集总数的92%。最终获得44 mL纯净的裂殖子。
3 讨 论
此前,研究者多选择柔嫩艾美耳球虫和毒害艾美耳球虫的第2代裂殖子进行分离纯化。然而,目前关于巨型艾美耳球虫裂殖生殖代数和发生时间仍然存在争议。TYZZER[11]、LONG[12]、BHATIA和PANDE[13]早先对巨型艾美耳球虫裂殖子内生性发育进行研究,认为只有1代裂殖子。同时,有学者认为发生2代裂殖生殖[3];CHALLEY和JOHNSON[14]观察到第1代裂殖体于感染后48 h产生,72 h后出现第2代裂殖体。MILLARD等[15]认为有3代裂殖生殖,第1代发生在感染后24~48 h,第2代于感染后48~72 h进行,第3代裂殖子产生于感染后72~96 h。MCDONALD[16]认为至少有4代裂殖子,而DUBEY和JENKINS[5]甚至观察到5代裂殖生殖。吴力力等[17]对2株巨型艾美耳球虫虫株进行内生发育比较,观察到上海株和扬州株都有3代裂殖生殖,并且第3代裂殖体出现在感染后88~104 h,但内生发育阶段所出现的具体时间有差异。本试验发现感染后84 h收集的裂殖子最多,显示84~88 h为裂殖子产生的高峰(图1)。根据文献,推断该时间所收集的裂殖子可能为第3代裂殖子。在感染后96~120 h能观察到形状较大,更为成熟的裂殖子,这可能是第3代裂殖子进一步发育。此外,感染后92 h裂殖子数明显下降,考虑是由于内生发育的无性生殖阶段结束,不再进行裂殖生殖,开始进入有性生殖阶段。
较多文献记载巨型艾美耳球虫寄生于小肠中段,但不同文献对具体寄生位置的描述略有差异。SCHWARZ等[18]于十二指肠尾端到卵黄蒂的肠段中分离裂殖子。吴力力等[17]观察到第1代和第2代裂殖子寄生于十二指肠1/2回折处到卵黄蒂前10 cm处,第3代裂殖子寄生于十二指肠到卵黄蒂后5 cm处。这表明巨型艾美耳球虫在内生发育过程中有向小肠后段移动的趋势。本试验于空肠后端收集到数量较多的裂殖子,这与DUBEY和JENKINS[5]研究结论一致,即巨型艾美耳球虫在空肠内的寄生率最高。由于分离巨型艾美耳球虫裂殖子的肠段较长,所刮取肠黏膜的组织和杂质较多,为减少分离和纯化过程中的杂质总量,推荐收集卵黄蒂前后5~8 cm处的裂殖子。
DEAE-52纤维素纯化裂殖子的原理是在特定pH条件下,通过离子吸附作用吸附洗脱液中的组织细胞和杂质,而虫体由于其运动性将从纤维素筛网孔中挣脱并游离出来[9]。随着层析的时间增加,一方面,层析柱中的杂质增多将影响虫体向下游动;另一方面,较多的杂质包裹在层析剂外将降低层析柱吸附能力,导致杂质和虫体一起随洗脱液流出,影响裂殖子的纯度。本试验纯化过程中收集的裂殖子数量会受到洗脱液中杂质浓度、层析剂吸附力和虫体活力的影响,这反应在洗脱曲线的变化和波动中(图3)。从第23管开始,镜下观察到收集液中的杂质增多。基于1管到22管收集了92%的裂殖子,建议在收集44 mL洗脱液以后停止收集,以免杂质随洗脱液流出。若出现红细胞和杂质,可回收并清洗DEAE-52纤维素并进行第2次层析过滤[9]。
球虫的分子生物学、免疫学、细胞培养等研究都对裂殖子纯度要求较高,如建立2代裂殖子cDNA文库、mRNA差异显示;通过裂殖子提取相关蛋白并筛选抗原,研制抗球虫疫苗;以及利用裂殖子入侵细胞以研究对球虫与细胞凋亡的关系。本研究确定分离巨型艾美耳球虫裂殖子的时间和部位,并基于已有文献和方法通过DEAE-52纤维素柱层析对裂殖子进行纯化,确定收集较高纯度巨型艾美耳球虫裂殖子洗脱液的最佳时间,为分离和纯化巨型艾美耳球虫裂殖子提供参考。文献表明,不同巨型艾美耳球虫虫株的潜隐期、裂殖子代数及内生发育具有一定的差异,因此,分离巨型艾美耳球虫裂殖子的时间和部位需要根据试验所用的具体虫株确定。
