经导管瓣膜瓣中瓣模式下流体力学性能体外测试及评价
2021-08-18刘丽万辰杰柯林楠王春仁
刘丽 万辰杰 柯林楠 王春仁
0 引言
随着人工生物心脏瓣膜(以下简称:生物瓣膜)材料和技术的不断发展,以及人们对人工机械心脏瓣膜(以下简称:机械瓣膜)终身抗凝并发症的重视,越来越多的临床研究显示出生物瓣膜的优越性[1-4]。2017年发布的瓣膜性心脏病治疗指南(ESC/EACTS Guidelines for the management of valvular heart disease)[5]推荐50 岁以下患者选择机械瓣膜,70岁以上患者选择生物瓣膜,50~70 岁患者两种瓣膜都可以考虑,但目前临床上生物瓣膜植入患者有年龄降低的趋势,由此带来二次植入瓣膜的需求。生物瓣膜一般使用牛心包或者猪主动脉瓣制作而成,其优势在于患者不需要终生服用抗凝药物,但发生瓣膜毁损和再次手术的风险较高,且再次开胸手术风险比首次手术明显增高。随着介入技术的发展,2008年开始经导管瓣中瓣植入技术逐渐在临床上尝试使用[6-10]。即将经导管植入式人工心脏瓣膜(以下简称:经导管瓣膜)压缩至输送系统,经股动脉(或心尖)植入至已毁损生物瓣膜内,形成瓣中瓣模式。瓣中瓣模式下的经导管瓣膜(以下简称:经导管瓣中瓣)用来替代已毁损的生物瓣膜,完成瓣膜的二次植入。经导管瓣中瓣植入通常不需要开胸和体外循环,患者创伤小,恢复快,尤其适用于不能再次承受开胸手术的高危患者。近2年来,国内也开展了经导管瓣中瓣临床应用[11-12]。由于经导管瓣中瓣将经导管瓣膜直接安装在已毁损的生物瓣膜内,导致植入的经导管瓣膜瓣口面积更小,瓣膜跨瓣压差增加,从而既增加了心脏负荷,也会在一定程度上影响瓣膜寿命。目前,经导管瓣中瓣研究多为临床病例报道[13-18],缺乏流体力学性能研究数据,作为血液系统的阀门,流体力学性能是瓣膜重要性能之一,而且流体力学数据为临床上选择瓣膜规格的重要依据,具有及其重要的作用。将经导管瓣膜放入生物瓣膜形成瓣中瓣模式,本文对其流体力学性能进行体外测试,并与同尺寸生物瓣膜进行比较,可作为经导管瓣中瓣临床前体外评价的参考。
1 材料与方法
1.1 实验材料
实验样品:将经导管瓣膜(规格23 mm、27 mm、29 mm)按照说明书通过输送系统安装在对应规格生物瓣膜中形成瓣中瓣;参考瓣膜为生物瓣膜(规格23 mm、27 mm、29 mm)。上述规格尺寸都是安装后的内径尺寸。由于放入经导管瓣膜之前利用生物瓣膜的支架弹性及特殊设计对其进行了预扩张,使得放入经导管瓣膜后瓣口内径仍可维持原尺寸。所有测试环境参数模拟及标准参照为主动脉瓣位。
实验用流体为0.9%生理盐水。
1.2 实验仪器
脉动流性能测试采用模块化人工心脏瓣膜脉动流测试系统(上海心瓣测试设备有限公司)[19-20]。该系统能模拟主动脉瓣部位流动环境,提供生理压力及流量波形,2~7 L/min的模拟心输出量。
稳态流测试系统与之相匹配(上海心瓣测试设备有限公司)[19-20],该系统能提供5 L/min、10 L/min、15 L/min、20 L/min、25 L/min、30 L/min的前向流量;40 mmHg(1 mmHg=133.3 Pa)、80 mmHg、120 mmHg、160 mmHg、200 mmHg的反向压力。
1.3 实验方法
1.3.1 样品预处理
在实验台的瓣膜安装位置先安装生物瓣膜(牛心包),进行测试后利用其瓣架上的特殊装置及材料本身的弹性用球囊将其内径扩大,使得经导管瓣膜放入后与原先测试的生物瓣膜有相同的瓣口内径。将经导管瓣膜按照使用说明压握至适用规格的输送系统上,按实验管路通过输送系统放入对应规格的生物瓣膜中(实验瓣膜的规格为23 mm、27 mm、29 mm),形成瓣中瓣模式。利用测试系统对组装好的瓣中瓣分别进行稳态前向流实验、稳态反向泄漏实验、脉动流实验。作为对照瓣膜的生物瓣膜进行脉动流实验。
1.3.2 稳态前向流实验
稳态前向流实验用来测试稳态流量下的跨瓣压差。将经导管瓣中瓣正向安装在稳态流测试系统上,在5 L/min、10 L/min、15 L/min、20 L/min、25 L/min、30 L/min流量的实验条件下测试经导管瓣中瓣的跨瓣压差,在每一流量下取300个测试值并计算平均值。
1.3.3 稳态反向泄漏实验
稳态反向泄漏实验用来测试稳态反向压力下的泄漏量。将经导管瓣中瓣反向安装在稳态流测试系统上,在40 mmHg、80 mmHg、120 mmHg、160 mmHg、200 mmHg压力的实验条件下测试经导管瓣中瓣的反向泄漏量,在每一压力下取300个测试值并计算平均值。
1.3.4 脉动流实验
脉动流实验用来测试脉动条件下的流体力学性能。将经导管瓣中瓣安装在脉动流测试系统上,在平均主动脉压100 mmHg、心率70次/min,心输出量2.0 L/min、3.5 L/min、5.0 L/min、7.0 L/min的实验条件下测试经导管瓣中瓣和生物瓣膜的平均跨瓣压差、返流百分比、有效瓣口面积。每个条件下选取10个循环测试并计算平均值。在心输出量5.0 L/min实验条件下将经导管瓣中瓣和生物瓣膜的实验结果进行对比。
2 结果
2.1 稳态前向流实验
稳态前向流实验测试瓣膜在稳定流量下的跨瓣压差,跨瓣压差是反映瓣膜性能的重要指标,跨瓣压差过大影响心脏供血功能,同时也对瓣膜瓣叶造成损害。由图1可见,经导管瓣中瓣跨瓣压差随着前向流量的增大而增大,在相同前向流量下,随着规格变大,跨瓣压差减小,该结果与标准喷嘴跨瓣压差具有相同的变化趋势,符合瓣膜稳态流下跨瓣压差的变化规律。

图1 稳态前向流实验Figure 1 Steady forward-flow testing
2.2 稳态反向泄漏实验
稳态反向泄漏实验用来测试瓣膜在稳定反向压力情况下的泄漏量,该泄漏量反映了瓣膜完全关闭状态下的返流情况,是评价瓣膜性能的另一个重要指标。由图2可见,泄漏量随着反向压力的增大而增大,经导管瓣中瓣与标准喷嘴泄漏量具有相同的变化趋势,符合瓣膜在稳态反向压力下的变化规律。

图2 稳态反向泄漏实验Figure 2 Steady back-flow leakage testing
经导管瓣中瓣最大的风险之一就是瓣中瓣结构中的经导管瓣膜与植入的生物瓣膜不匹配,在植入和工作过程中发生脱落。从稳态流实验结果可以看出,在稳态前向流量30 L/min和稳态反向压力200 mmHg的实验条件,该实验条件远远高于临床中心输出量和反向压力,瓣中瓣中经导管瓣膜牢固地固定在植入的生物瓣膜中,没有发生移动和脱落,说明该经导管瓣中瓣结构牢固,植入后经导管瓣膜脱落风险低。
2.3 脉动流实验
脉动流实验用来测试瓣膜在脉动流条件下的流体力学性能,该流体力学性能主要通过平均跨瓣压差、返流百分比和有效瓣口面积3个指标反映。其中,平均跨瓣压差是循环的正压差阶段,瓣膜两侧的压差对时间的算术平均值,是用来评价瓣膜狭窄的重要指标。返流百分比是一个循环内反向通过瓣膜的流量与前向流阶段通过瓣膜的流量的百分比,是用来评价瓣膜返流的重要指标。有效瓣口面积通过压力和流量计算得出,更直观地反映瓣膜的开闭性能。由图3~图5可见,经导管瓣中瓣和生物瓣膜平均跨瓣压差、返流百分比和有效瓣口面积有着相同的变化趋势。对于同一规格的经导管瓣中瓣和生物瓣膜,随着心输出量的增加,跨瓣压差增大,返流百分比减小,有效瓣口面积增大;在同一心输出量下,随着瓣中瓣和生物瓣膜规格的增大,跨瓣压差减小,返流百分比增大,有效瓣口面积增大。其中23 mm的经导管瓣中瓣和生物瓣膜相比,平均跨瓣压差和返流百分比较大,有效开口面积较小;27 mm和29 mm的经导管瓣中瓣和生物瓣膜相比,平均跨瓣压差和返流百分比较小,有效开口面积较大。分析其原因,可能由于存在于瓣中瓣结构中经导管瓣膜和生物瓣膜之间的瓣叶对于经导管瓣中瓣脉动流性能产生影响。对于小规格经导管瓣中瓣,瓣叶厚度相对于瓣膜直径尺寸占比大,对经导管瓣中瓣脉动流性能影响大,对于大规格经导管瓣中瓣,瓣膜厚度相对于瓣膜直径尺寸占比小,对经导管瓣中瓣脉动流性能影响小。说明大规格的生物瓣膜中植入经导管瓣中瓣具有更好的脉动流性能。

图3 23 mm经导管瓣中瓣和生物瓣膜脉动流实验Figure 3 Pulsatile-flow testing in 23 mm ViV-THV and bioprosthetic valve
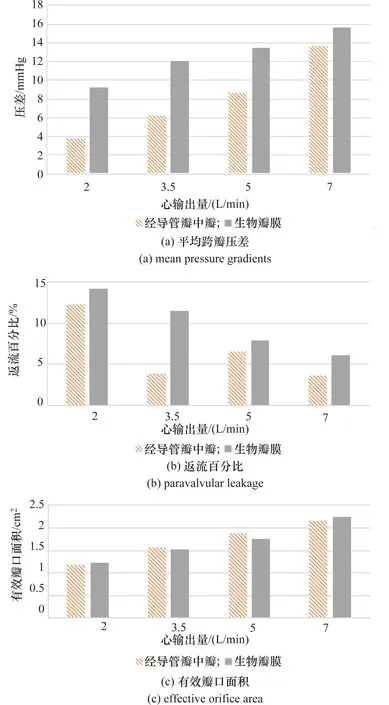
图4 27 mm经导管瓣中瓣和生物瓣膜脉动流实验Figure 4 Pulsatile-flow testing in 27 mm ViV-THV and bioprosthetic valve

图5 29 mm经导管瓣中瓣和生物瓣膜脉动流实验Figure 5 Pulsatile-flow testing in 29 mm ViV-THV and bioprosthetic valve
2.4 在模拟临床使用条件下的脉动流性能实验
经导管瓣中瓣和生物瓣膜在模拟临床使用条件(平均主动脉压力100 mmHg、心率70次/min、心输出量5 L/min)下的脉动流性能实验结果见表1。同规格经导管瓣中瓣和生物瓣膜在模拟临床使用条件下的脉动流性能实验结果无明显差异,说明该经导管瓣中瓣基本可以与生物瓣膜具有同等的体外脉动流性能。YY/T1449.3—2016《心血管植入物 人工心脏瓣膜 第3部分 经导管植入式人工心脏瓣膜》[19](等同转化于ISO 5840.3:2013[20])对于主动脉经导管瓣膜的最低脉动流性能做了规定。通过上述实验结果可以看出,经导管瓣中瓣的返流百分比和有效瓣口面积完全满足同规格该标准中的要求,说明该经导管瓣膜以瓣中瓣的方式植入生物瓣膜后具有良好的脉动流性能。

表1 模拟临床使用条件下的脉动流性能实验Table 1 Pulsatile-flow testing under simulated clinical conditions
3 讨论
近十几年,随着生物瓣膜植入患者越来越多,生物瓣膜毁损发生病例逐年递增,对于瓣膜发生毁损的患者需要进行二次换瓣手术,由于二次换瓣患者本身年龄较大,再次开胸植入生物瓣膜风险很大。经导管瓣中瓣植入技术逐渐成为生物瓣膜二次植入的替代手术。Nalluri等[21]通过PubMed等检索出二次换瓣临床实验594例,其中255例经导管瓣中瓣植入术,339例二次开胸生物瓣膜植入术,二者在手术死亡率、30天死亡率和1年死亡率无显著差异。该结果从临床上说明了经导管瓣中瓣技术治疗高危手术患者主动脉瓣衰败的安全性和可行性。
目前,国内外经导管瓣中瓣研究主要集中在临床应用上,其流体力学性能数据鲜有报道。瓣膜作为血液系统的阀门,流体力学性能是其重要的评价指标,而且也是临床上经导管瓣中瓣植入中所使用的经导管瓣膜规格选择的重要参考依据。本文首次对经导管瓣中瓣的流体力学性能进行体外测试,并与生物瓣膜测试数据进行比对,对其流体力学性能进行评价。该经导管瓣中瓣具有稳定的结构,在高于临床心输出量的前向流量和高于收缩压的反向压力下,瓣中瓣结构中的经导管瓣膜未发生移动及脱落。该经导管瓣膜具有良好的脉动流性能,与生物瓣膜相比无明显差异,满足YY/T 1449.3—2016的要求,说明该经导管瓣中瓣可以满足临床需要,与二次植入生物瓣膜相比,无显著差异。
本研究中将经导管瓣膜放入完好的生物瓣膜中进行测试,未模拟出生物瓣膜毁损甚至钙化的情况,而这类情况的发生是患者需要放入瓣中瓣的主要原因。当生物瓣膜发生毁损(钙化),可能导致植入的经导管瓣膜局部变形,从而影响经导管瓣中瓣的脉动流性能。由于毁损和钙化情况多种多样,很难选择测试标准模型。由于该模型的重要性,目前在收集临床病例的影像数据,试图建立具有代表性的经导管瓣中瓣测试周围锚定几何模型。
4 结论
经导管瓣中瓣体外脉动流性能指标满足YY/T1449.3—2016标准中经导管瓣膜的最低性能要求,且其脉动流性能与同规格生物瓣膜相比无明显差异。该经导管瓣中瓣具有良好的血流动力学性能。
