基于原子力显微镜压痕技术的大鼠小梁网组织弹性模量测定
2021-08-18王川李林刘志成
王川 李林 刘志成
0 引言
青光眼是全球第一大不可修复的致盲眼病,患病率已超过人口总量的3.5%。到2040年,全球患者总数将达到1.1亿,是全球关注的重大健康问题之一[1]。眼球是密闭的腔体,眼内房水异常堆积将导致眼压升高[2-3]。小梁网房水排出通道是房水外流的主通道,约80%以上的房水经小梁网通道排出[4]。小梁网的组织力学特性与小梁网的组织结构以及房水流出阻力密切相关[5-6]。因此小梁网组织(trabecular meshwork,TM)力学特性的认识对了解高眼压状态下房水流出阻力增加具有重要意义[7-8]。
小梁网组织内嵌于前房角处的巩膜区域,小梁网组织位置特殊,几何尺寸小且组织分离难度大。对于小梁网组织目前尚无成熟的生物力学测试方法。在已有的大、小鼠小梁网组织力学特性研究中,直接测量小梁网组织力学特性主要用到2种方法,即单轴拉伸实验(uniaxial tensile test)与原子力显微镜(atomic force microscope,AFM)压痕实验[9-10]。前者需要剥离小梁网组织,实验难度大且破坏了其原生理状态,获取的是垂直于房水流出方向的组织力学特性[11]。相比较而言,AFM压痕实验更接近小梁网组织的生理状态且获取的是沿房水流出方向的组织力学特性。然而,由于巩膜组织的非透光性导致其在光学显微镜下成像效果极差,极难分辨确切的小梁网组织部位,而AFM压痕实验装置需要搭载光学显微镜进行组织部位的确定,导致了AFM压痕实验无法准确定位小梁网组织测试区域的实际困难。目前,Huang等[10]采用Evans蓝染料进行前房灌注用于标记大鼠小梁网组织,结合AFM压痕实验获取的大鼠小梁网组织弹性模量为162 Pa,该研究中Evans蓝染料并不特定作用于小梁网,因此基于染色的方法确定小梁网组织测试区域存在着不确定性。Wang等[5]采用眼球冷冻组织切片,将切片后的组织进行AFM压痕实验获取了小鼠小梁网组织的弹性模量为3 840 Pa,该研究中组织切片对小梁网组织的整体结构及力学特性均会产生一定的影响。这两项研究均未给出大、小鼠小梁网组织在AFM测试环境下的位置、宽度信息以供后续研究做重要参考。
明确AFM测试环境下大鼠小梁网组织测试区域并准确定位,是获取小梁网组织力学特性的关键前提。探索基于原子力显微镜压痕技术获取大鼠小梁网组织弹性模量的方法,为揭示小梁网组织力学特性与小梁网通道房水外流阻力之间的关系等研究奠定基础。基于以上分析,本研究基于大鼠眼球组织切片呈现的小梁网组织与毗邻组织之间的位置关系、距离信息和结构信息基础上,探索基于AFM压痕实验定位小梁网组织区域并获取该组织弹性模量的测试方法,并利用该方法获取了大鼠眼球鼻侧、颞侧、上侧、下侧4个位置处的小梁网组织弹性模量,也为即将进行的小梁网组织力学特性与小梁网通道房水外流阻力之间的关系等研究奠定基础。
1 材料与方法
1.1 实验动物
首都医科大学实验动物中心提供的正常 8~10周雄性SD大鼠10只,无眼部疾病,眼压正常,体质量240~280 g。1%戊巴比妥钠腹腔注射麻醉大鼠,按体质量1 mL/100g剂量给药,深度麻醉后脱颈处死。眼科剪剪开结膜,剪断视神经,完整取出眼球,分别进行标号。分离了共20只眼球用于实验测试。选取其中4只眼球区分左右眼用于组织学切片及染色处理,另外的16只眼球区分左右眼用于AFM压痕实验,其中4只眼球用于确定AFM测试环境下小梁网组织测试区域,另外12只眼球区分左右眼用于小梁网组织环周力学特性测试。所有实验和流程符合首都医科大学使用动物的声明。
1.2 实验过程及数据处理
1.2.1 组织切片染色
小梁网组织内嵌于角巩膜缘部位的巩膜区域。考虑到前房角处角膜组织富含胶原纤维,小梁网组织富含肌纤维,这两种组织经过Masson染色后可以清晰地呈现出蓝色和红色的分布。因此,为了获取小梁网组织与毗邻组织之间的位置关系、距离信息和结构信息,实验采用石蜡切片,Masson染色处理。垂直于虹膜纵向刨开眼球,切片厚度3 μm,每个眼球切片数量约30片,使用Zeiss(Axio Lab A,德国)显微镜进行组织切片观察并给出大鼠小梁网组织与毗邻组织之间的距离信息和结构信息,为AFM压痕实验提供数据支持。
1.2.2 AFM力学测试
本实验利用NT-MDT公司生产的NTEGRA原子力显微镜,悬臂梁的弹簧系数k=0.04 N/m,球形压头的材质为氮化硅材料,压头半径17 μm。AFM测试软件为NovaPx软件(NT-MDT,莫斯科,俄罗斯,version 3.2.5)。
实验前进行预加载/调零。将大鼠眼球沿垂直于角膜方向剖开,去除眼球内容物。在操作显微镜下利用镊子将虹膜撕下。沿角膜、巩膜方向裁条。AFM压痕实验环节,将试样自然平铺在直径为30 mm培养皿中。如图1(a)所示,用3M胶带分别将角膜和巩膜部位与培养皿基底粘在一起,样品制备过程中应避免样品的挤压与拉伸。加入适量PBS缓冲液没过样品组织,置于倒置显微镜上方,进行AFM压痕实验如图1(b)所示。实验过程中,在靠近角巩膜缘的角膜部位,实验中选了5个间隔20 μm的点分别进行AFM压痕实验,获取了角膜的力-位移曲线,直至探针位置移动到角巩膜缘的上方,这个位置在光学显微镜下可以分辨。实验继续采用逐点(间隔20 μm)测量的方法,探针逐渐移动到小梁网区域,从力-位移曲线的斜率可以看出这一变化。此处力-位移曲线将变得平缓(相对于角膜部位组织的力-位移曲线),此时可以缩小测量的间距(间隔10 μm),每个点进行测量。直至测量进入巩膜区域,获取巩膜区域的力-位移曲线。

图1 基于AFM压痕实验制备的大鼠角膜、小梁网、巩膜组织样品Figure 1 The cornea,TM and sclera of rats were prepared based on AFM indentation test
1.2.3 力-位移曲线的拟合方法
本实验采用球形针尖,针尖曲率半径为17 μm,压入深度为2 μm,对于大鼠小梁网组织,满足附于刚性基底的半无限Hertz模型[12-13]:
式中:F/nN为针尖对样品施加的作用力;R/nm为球形针尖的半径;E/GPa为材料的弹性模量;v为材料泊松比,对于不可压缩的生物组织泊松比取0.5;δ/nm为压入深度。
坐标(a,b)为力-位移曲线中探针与样品的接触点。将实验获取的力-位移曲线进行Hertz公式拟合[14],给出弹性模量的信息,拟合过程及数据结果如图2所示,整条曲线为实验获取的力-位移曲线,红色曲线为Hertz拟合曲线,δ表示压入深度。
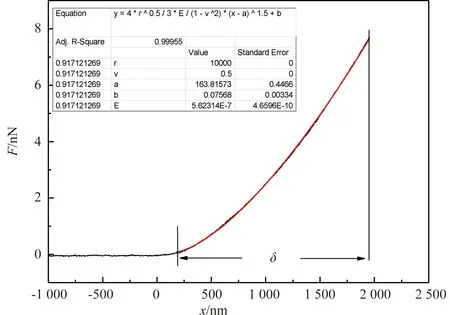
图2 力-位移曲线及Hertz公式拟合Figure 2 Force-displacement curve and Hertz formula fitting
2 结果
2.1 组织切片的位置确定
Masson染色结果如图3所示。Masson染色在眼组织主要有蓝色、红色、紫色分布,组织层次清晰可见,角膜组织胶原纤维为蓝色,肌纤维为红色。切片中可以分辨角膜后弹力层止端和巩膜突位置,这2处位置中间为巩膜内沟,参考人眼组织结构可以判断这2处位置之间为小梁网组织区域。根据图中标尺可以确定此处距离角巩膜缘约200 μm,小梁网组织的宽度约80 μm。在这些位置信息的基础上,进行不同组织的AFM压痕实验,并为AFM压痕实验环境下定位小梁网组织区域提供参考。
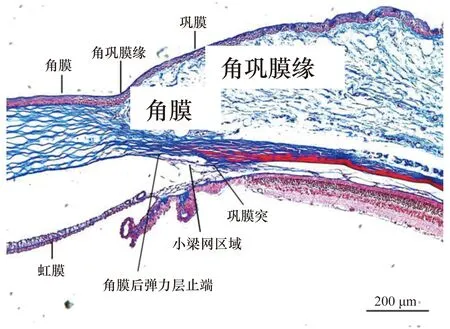
图3 大鼠眼部组织Masson染色Figure 3 Masson staining of rat eye tissue
2.2 不同组织弹性模量变化
根据1.2.3节给出的力-位移曲线拟合方法确定组织弹性模量,以1号右眼眼球为例,沿角膜-角巩膜缘-小梁网-巩膜方向的弹性模量的变化趋势与组织间相对位置的关系如图4所示。由于小梁网组织弹性模量远低于角膜及巩膜组织,大鼠小梁网区域组织的弹性模量约为几百Pa,因此AFM压痕实验确定的小梁网组织的宽度约80 μm。对比眼球组织切片所获取的小梁网组织宽度信息,AFM压痕实验所获取的小梁网组织宽度信息与组织切片观察的结果具有一致性。
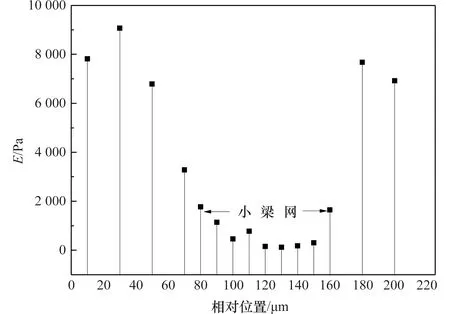
图4 AFM压痕实验获取的角膜到巩膜区域的弹性模量Figure 4 The elastic modulus of cornea to sclera region obtained from AFM indentation
2.3 AFM力学测试环境下小梁网区域位置的确定
AFM压痕实验过程中记录出现小梁网处组织弹性模量变小时,探针所处的位置为距离角巩膜缘处约200 μm。角巩膜缘在镜下比较容易辨认。如图5所示,上方第一条黑色水平直线即角巩膜缘的位置,该直线下方的平行线所示位置为小梁网区域的上边界。图中两条黑线中间的位置为角巩膜缘至小梁网组织的过渡区域。参考悬臂梁的高度(200 μm)可以确定过渡区域宽度大约200 μm。此结果可为在AFM测试环境下快速定位小梁网组织测试区域提供依据。即沿着角膜-巩膜的方向进行AFM压痕实验,当控制悬臂梁的底端与角巩膜缘平齐时,结合悬臂梁的高度约200 μm,悬臂梁顶端针尖所对应的位置即是小梁网的开始测量点,以此位置开始约80 μm的跨角膜-巩膜区域是小梁网组织的测试区域。

图5 AFM压痕实验中大鼠小梁网部位的确定(×50)Figure 5 Determination of TM position in AFM indentation experiment(×50)
2.4 小梁网组织环周弹性模量结果
考虑到小梁网组织沿房角处的环向分布特点,小梁网组织的弹性模量在不同的部位(如鼻侧和颞侧)可能会有改变,因此,实验中设计了每只眼球取4个部位进行力学测试,即鼻侧、颞侧、上侧和下侧4个互相对称的位置。其中鼻侧和颞侧在取眼球之前用记号笔标记,垂直与鼻侧和颞侧连线方向就是上侧和下侧小梁网位置。实验中将12只大鼠眼球按照沿着鼻、颞、上、下4个部位进行裁样。裁样环节由于操作不熟练,导致2只眼球无法用于AFM压痕实验,最终有10只眼球进行了AFM压痕实验,每只眼球测试部位为上、下、鼻、颞4个部位。结合AFM力学测试环境下小梁网区域位置的确定方法,对小梁网区域进行了AFM压痕实验,实验中每处组织间隔测试5个点,间距为10 μm。将实验获取的力-位移曲线进行Hertz拟合给出弹性模量的数值。区分左右眼将10只眼球的鼻侧、颞侧、上侧、下侧4个部位的弹性模量以平均值±标准差的形式列于表1。
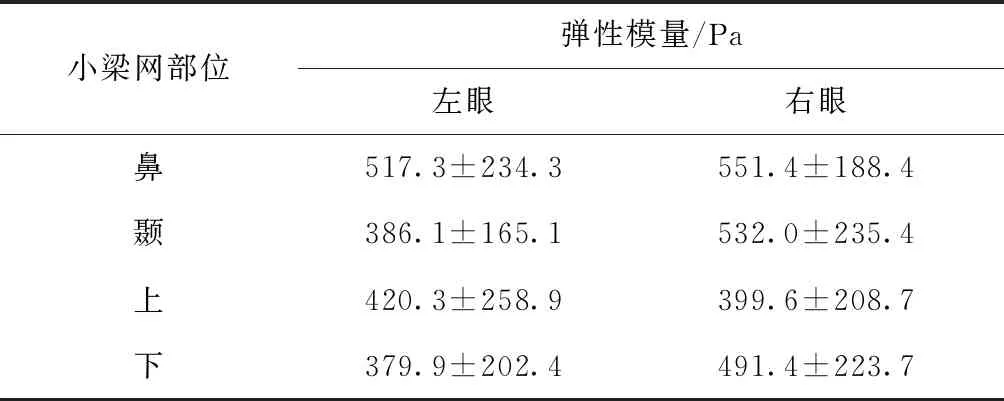
表1 大鼠眼部鼻侧、颞侧、上侧、下侧的小梁网组织弹性模量(n=5)Table 1 Values of elastic modulus of TM in nasal,temporal,superior and inferior sides of rat eyes(n=5)
采用Dunnett’s 多组间检验的方法,左右眼4个部位的小梁网组织弹性模量之间差异无统计学意义。该数据说明在小梁网组织的弹性模量在不同的部位没有明显改变,因而进行大鼠小梁网组织弹性模量测量的过程中,可以忽略小梁网组织不同位置处弹性模量的差异。
3 讨论与结论
本研究探索了一种基于AFM压痕技术定位大鼠小梁网组织并获取该组织弹性模量的测试方法,基于该方法得到的大鼠小梁网弹性模量范围为300~600 Pa。明确了大鼠小梁网组织测试区域宽度约80 μm。小梁网区域弹性模量结果与Huang等[10]报道的结果相近。Huang等利用前房灌注染料进行小梁网处组织的染色,然后利用AFM压痕实验对染色处的组织进行力学测试获取的结果为162 Pa。该研究未考虑染料分子进入小梁网通路之后对组织力学特性所产生的影响,同时,该染料并不能特定地对小梁网组织进行染色,这使得在力学测试环节并不能准确定位小梁网组织。Wang等[5]报道了一种基于AFM压痕实验对CBA/J与C57BL/6J两种小鼠小梁网组织弹性模量的测量方法,所得结果分别为3.84 kPa±3.37 kPa(n=7)和3.22 kPa±1.84 kPa(n=3)。所得弹性模量值要大于本研究的结果,他们提出了对小梁网测试部位具有一定的不确定性。
本研究同样存在着局限性。首先,AFM测试环境下角巩膜缘部位的确定存在着主观性,需要进一步优化测试方法。其次,所得数据标准差较大,应进一步缩小测试的步长,进一步优化测试过程,这样获得的结果会更加准确。第三,对于小梁网组织不同部位的弹性模量结果,由于动物的个体差异及不同样本间的结果存在差异,后续研究中可以通过加大样本量,得到更加一致的结果。
基于AFM压痕实验获取小梁网组织力学特性,其测试结果受到AFM针尖几何形状、针尖尺寸、检测条件的设定、数学模型的应用等因素的影响。在每次测量的过程中,可以保证测试时的温度、湿度保持相对稳定。因此误差的来源可归属于系统误差。系统误差对测量结果的影响是一致的。因此,同批次的小梁网组织的测量结果之间具有可比性。本研究获取的小梁网组织弹性模量值标准差较大,原因主要由小梁网组织结构分布的非均匀性所导致的,小梁网是由相互联结的小梁组成的多孔网状结构组织[15],压痕实验中采集的5个点的数据,有的可能压在小梁网组织孔洞较多的部位(结果偏小),有的可能会压在弹性纤维上(结果偏大),因此,取平均之后,标准差会比较大。小梁网组织弹性模量与小梁网组织的细观结构密切相关,需要进一步研究小梁网组织弹性模量的结构依赖性。
本研究基于大鼠眼球组织切片呈现的大鼠小梁网组织与毗邻组织之间的位置关系,给出了一种基于AFM压痕技术获取大鼠小梁网弹性模量的测试方法。该方法提供了AFM测试环境下小梁网组织区域的位置参考,优势在于可快速定位到大鼠小梁网组织区域。
