青岛市5岁低龄儿童重度龋患者龈上菌斑微生物群落的宏基因组学研究
2021-07-28刘梦佳滕飞公文徐颖婕丛蓓蓓王万春
刘梦佳 滕飞 公文 徐颖婕 丛蓓蓓 王万春
美国儿童牙科学会将低龄儿童龋(early childhood caries,ECC)定义为72个月以下的儿童的任何1颗及1颗以上乳牙龋坏或因龋导致的牙齿缺失或充填。中国第四次口腔流行病学调查显示5岁儿童患龋率为71.9%,比十年前上升了 5.9%[1]。ECC是最常见的儿童口腔疾病,严重影响儿童的身心健康[2-3]。因此,针对低龄儿童龋病的病因学研究和精准的风险评估是现阶段研究重点。
诱发龋病的因素较为复杂,四联因素学说认为细菌、环境、宿主、时间都是龋病发生的必要因素。其中,细菌是最关键的因素。近年,随着高通量测序技术和人类微生物组计划的突破性进展,越来越多学者认为口腔微生物群落失衡导致龋病的发生和发展[4],这为龋病研究提供了新思路。但是,目前的研究限制了对龋病微生物病因学研究的深度和精度[2,5]。
因此,本研究旨在对比解析青岛市5岁重度低龄龋儿童及健康者龈上牙菌斑微生物群落差异,探究龋病发生的微生物病因学机制,甄选潜在的龋病相关微生物因子,建立基于菌群信息的龋病风险模型,为青岛市儿童龋病特定目标人群微生物诊断和个性化治疗提供新思路。
1 资料与方法
1.1 研究对象
2019年3~6月对青岛市13个幼儿园的5岁儿童进行口腔流行病学调查,经口腔检查筛选出31例患重症低龄儿童龋的儿童(C组:dmfs≥6)和34例口腔健康的儿童(H组:dmfs=0)参与本研究。受试者入选标准:过去3个月未使用抗生素;牙列为乳牙列;口腔黏膜无明显异常;无发育畸形及全身系统性疾病;未佩戴各种正畸矫治器及配件。本研究经青岛大学附属青岛市口腔医院医学伦理委员会批准。所有受试者均取得了儿童监护人同意。
1.2 样本采集方法
口腔检查:选择3名口腔专业本科以上毕业从事口腔临床工作3年以上医生进行检查,检查器械均经高温高压严格灭菌消毒。所有医生在检查前均接受口腔临床检查培训,检查者之间的标准一致性检验Kappa值均>0.85。龋病的诊断标准参照世界卫生组织《口腔健康调查基本方法》(第5版)。
样本采集:采样前,根据《人类微生物组计划程序手册》(http://hmpdacc.org/resources/tools_protocols.php)和之前的研究[2]对3位口腔检查医生进行样本采集培训。2019年3~6月上午10:00~11:00收集样本,所有受试者早晨不刷牙,采样前2 h内不进食并轻漱口,在口腔检查所用的简易牙椅上进行采样,用无菌棉签收集全部萌出的20颗乳牙的颊舌面及面龈上菌斑,将棉签头剪下保存于1.5 mL离心管中,置于-20℃条件保存,在2 h之内转移至青岛市口腔医院中心实验室-80℃冰箱。
1.3 基因组DNA的提取、聚合酶链式反应(polymer-ase chain reaction,PCR)扩增及测序
使用 MoBio PowerSoil DNA Isolation Kit(QIAGEN)试剂盒纯化分离菌斑样本中基因组DNA,对其16S rRNA片段上的V3-V4高变区进行基因扩增,使用KAPA 2G Robust Hot Start Ready Mix试剂盒进行PCR扩增,利用 Illumina Miseq PE300平台(Illumina,Inc.,USA)进行测序。
1.4 生物信息学和统计学分析
使用IBM SPSS 26.0进行统计分析,对各组的性别分布的差异性采用χ2检验,检验水准α=0.05,P<0.05有统计学意义。使用 QIIME2(https://qiime2.org)对原始数据进行质量控制和后续生物信息学分析。使用 R(v3.6.0,https://www.r-project.org/)进行菌群统计分析。H组和C组之间的比较采用Wilc-oxon ranksum检验,采用Bonferroni检验校正法进行多重比较分析(P<0.05为差异有统计学意义)。通过多因素方差分析(permutationa multivariate analysis of variance,PERMANOVA)考察龋病状态和性别对微生物结构的影响程度。所用构建模型方法为随机森林(random forest,RF)算法,模型性能通过受试者操作特征(receiver operating characteristic,ROC)及其曲线下面积(area under the curve,AUC)进行分析。
2 结 果
2.1 H组和C组的性别分布
65例5岁儿童纳入研究,其中男36例,女39例;H组中,男17例,女17例;C组中,男19例,女12例(表1)。H组和C组的性别组成无统计学差异(P>0.05)。

表1 H组和C组的性别分布Tab 1 Sex distribution of H group and C group
2.2 龈上菌斑菌种多样性分布
图1可见:α多样性指数中,Shannon和Simpson指数显示C组显著高于H组(P<0.05),说明C组的物种丰富度高于H组;不同性别来源的样本的3个α多样性指数均不具有统计学意义(P>0.05)。
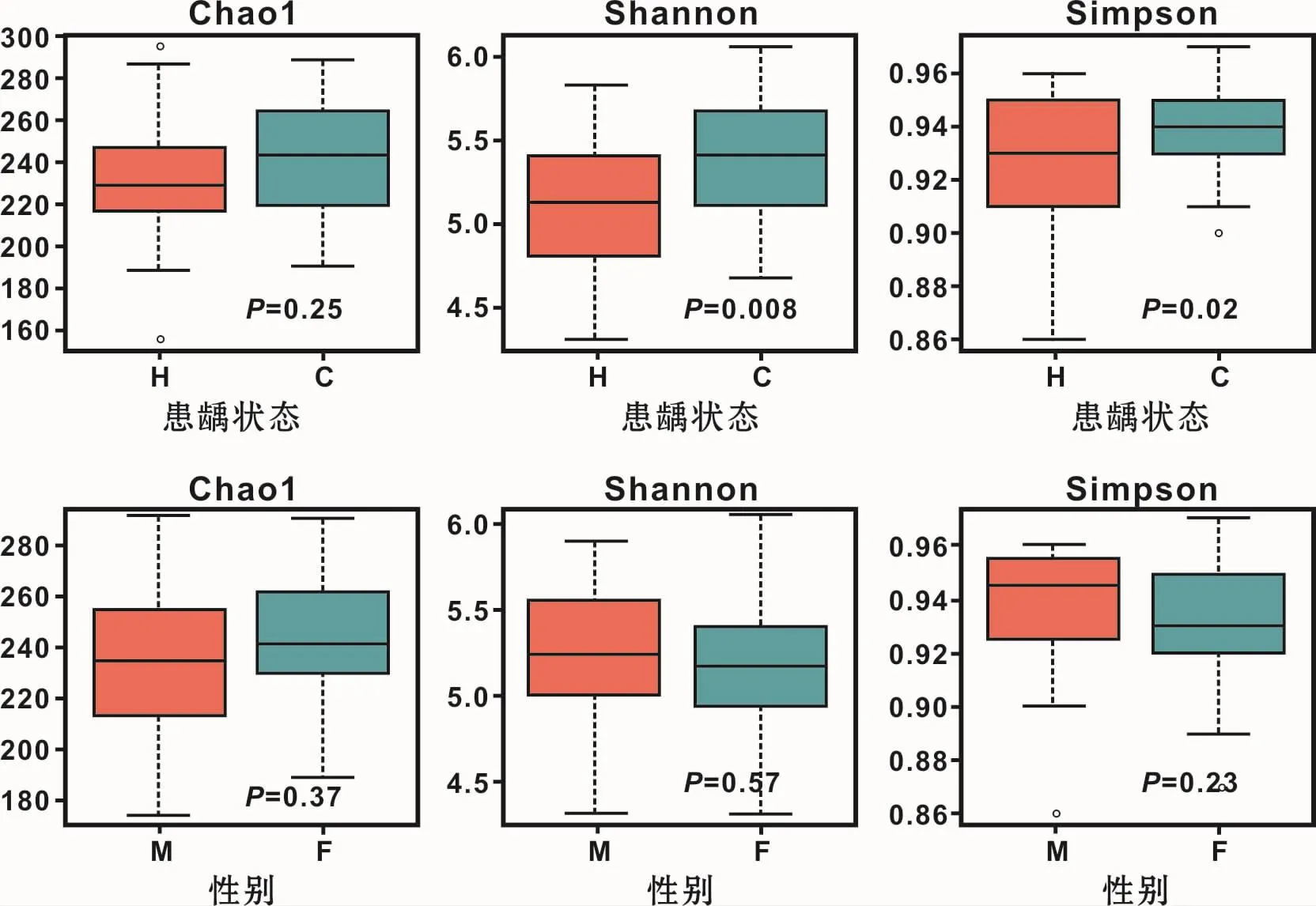
图1 龈上菌斑菌群多样性分析Fig 1 Analysis of the diversity and richness of the flora in supra-gingival plaque of the subjects
2.3 基于Bray-Curtis矩阵的龈上菌斑微生物群落结构
首先,龋病状态会显著影响菌斑的微生物菌群结构(F=1.73,P<0.05),性别无影响(P>0.05;图2A);其次,H组和C组的菌斑菌群结构存在明显差异(P<0.05),且C组的群落结构距离较远且更为复杂,而H组的群落结构较为相似(P<0.001;图 2B);最后,PCoA分析可见两组样本呈显著分离(P<0.01;图2C)。
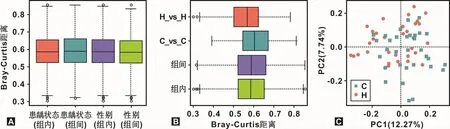
图2 H组和C组龈上菌斑微生物群落结构比较Fig 2 Comparison of microbial community structure from supragingival plaque between H group and C group
2.4 基于种系发育信息的龈上菌斑微生物菌群特点
对两组的龈上菌斑微生物相对丰度进行统计分析(图3)。在门水平,H组和C组样本的组成比较相似,超过98%样本的菌斑菌群由以下5个相对丰度占比较高的门构成,包括变形菌门(Proteobateria,35.32%)、厚壁菌门(Firmicutes,28.14%)、拟杆菌门(Bacteroidetes,12.95%)、放线菌门 (Actinobacteria,12.39%)、梭杆菌门(Fusobacteria,9.57%)。
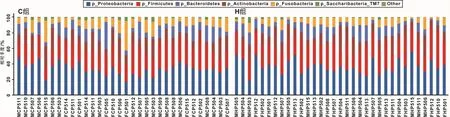
图3 龈上菌斑菌群中优势细菌门构成Fig 3 The predominant phylum in the supragingival plaque microbiota
在门、纲、目、科、属、种6个种系发育水平下比较C组和H组物种组成差异,没有发现龋病特异性致病菌,即不存在龋患者群中可检测到,而健康人群中未检测到的物种(图4)。从门到种6个水平下均检测到在两组间相对丰度存在显著差异的细菌种类(图4,P<0.05):(1)门水平,梭杆菌门(Fusobacteria)、TM7;(2)纲水平,梭杆菌纲(Fusobacteriia)、芽孢杆菌纲(Bacil-li);(3)目水平,梭杆菌目(Fusobacteriales)、巴氏杆菌目(Pasteurellales);(4)科水平,普氏菌科(Prevotellace-ae)、巴氏杆菌科(Pasteurellaceae);(5)属水平,普氏菌属(Prevotella)、嗜血杆菌属(Haemophilus);(6)种水平,变形链球菌(Streptococcus mutans)、异殊韦荣球菌(Veillonella dispar)、普氏菌 -317(Prevotella 317)、副流感嗜血杆菌(Haemophilus parainfluenzae)。
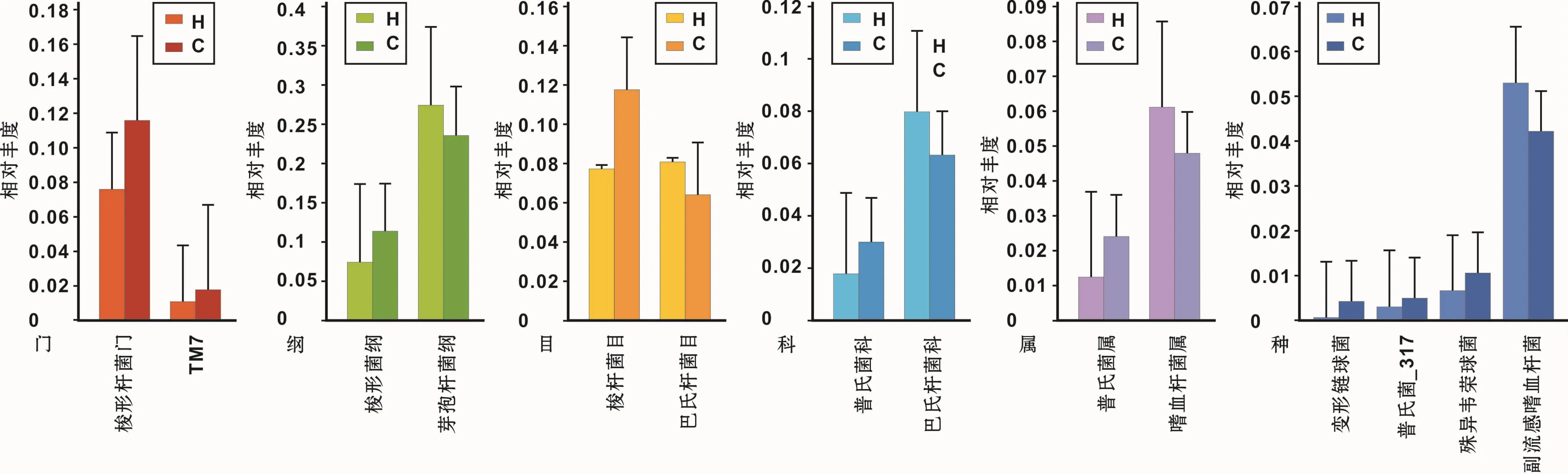
图4 H组和C组龈上菌斑菌群种系发育信息的比较Fig 4 Difference of microbial composition of supragingival plaque between H group and C group
2.5 基于龈上菌斑微生物建立ECC评估模型
首先,筛选对建模最优的种系发育水平,发现利用细菌种水平图谱可获得性能最佳模型(AUC=0.71,图5);其次,基于本研究中已筛选出的4个在两组间显著差异表达的细菌种构建模型,可得到性能接近于基于全部细菌种信息构建的评估模型(AUC=0.68,图5);最后,分别用这四个细菌种独立建模,变形链球菌亦可得到性能较好评估模型(AUC=0.68,图5),提示这些微生物因子在低龄儿童龋病风险评估方面具有潜在应用价值。
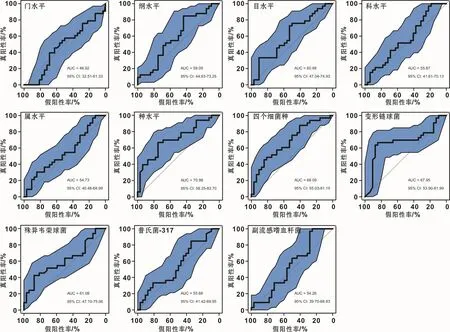
图5 利用龈上菌斑菌群图谱建立龋病分类模型Fig 5 Caries classifications based on supragingival plaque microbiota profile
3 讨 论
本研究中,健康和患龋儿童的性别分布均衡(P>0.05),不同性别来源的儿童口腔微生物组没有差异(P>0.05)。与之前研究结果一致[6],重度低龄儿童龋儿童和健康者龈上菌斑菌群多样性和结构均存在显著差异。而且,患龋儿童之间的群落结构相比健康者间距离较远且更为复杂,提示龋病菌群可能存在个体异质性[2,7]。此外,在H组和C组中均没有检测到“龋特异性”细菌。这些结果说明龋病涉及的微生物变化比所预期的要复杂,不是某种特异性微生物导致的,而是口腔生物膜菌群的结构在整体上发生了改变,这也证实了“生态菌斑假说”[8]。
通过对种系发育水平的研究得出龈上菌斑微生物群落的在门水平的构成与以往儿童口腔龈上菌斑研究一致[9]。本研究筛选出在龋病中高表达的细菌,主要属于链球菌属、普氏菌属和韦荣球菌属,即这些口腔常驻微生物转变为了致病微生物,这亦证实了微生态失衡是多种微生物作用的结果,从而导致龋病的发生发展[8]。其中,变形链球菌是最常见的致龋细菌,具有高度产酸和耐酸特性,其致龋能力强于其他产酸菌[10]。变形链球菌在牙菌斑微环境中通过发酵多种化合物产酸,并且生长、发育、代谢,最终导致牙齿脱矿、龋损加重[11]。韦荣球菌主要利用碳水化合物代谢出中间产物(乳酸),将乳酸转化为酸性较弱的丙酸和乙酸,并在低pH值环境下有利于变异链球菌等致龋菌进行代谢产酸过程[12-13]。普氏菌在体外培养时发现没有产酸性,仅具备中度耐酸能力[14],但大量龋病研究发现普氏菌在牙本质龋中高表达,可能通过自身的蛋白溶解特性参与龋病的发生发展[2,15-16]。
人类微生物组核心目标之一是利用共生菌群诊断和预测疾病。本研究基于牙菌斑菌群信息建立了龋病风险评估模型,其辨别龋病和健康样本的准确率均可以达到71%;尤其是使用筛选的4个细菌种类和变形链球菌分别建立的龋病评估模型均与全菌谱模型的性能比较相似。本研究结果提示可以利用其建立快捷和精确的龋病风险评估方法,是否可直接应用于临床预测高危人群,亟待于进一步研究验证。
