蓝萼甲素对牙龈卟啉单胞菌体外抑菌活性研究
2021-07-28杨钰婷宋忠臣张旭周薇周鲁先宋莉
杨钰婷 宋忠臣 张旭 周薇 周鲁先 宋莉
牙周炎是一种微生物相关的、宿主介导的、多因素参与并导致牙周附着丧失的炎症性疾病[1]。药物治疗是牙周炎的一种辅助治疗方式,目前最常用于临床的药物主要是一些抗生素类药物,如:甲硝唑、阿莫西林等,它们主要通过抑制某些特定种类的细菌及细菌复合物发挥其辅助治疗的效果[2]。但近些年来,抗生素耐药性问题已经被认为是人类健康的主要风险,而且相关研究人员已经从感染的牙髓组织和牙周组织中分离出多种耐药菌株[3],这表明口腔很可能作为耐药菌菌库,限制抗生素在治疗身体其他部位的感染性疾病中的有效性[4]。为了减少牙周病原菌的耐药性问题,研究人员正致力于研究各种新型的牙周炎辅助治疗方法,包括益生菌疗法[5]、激光疗法[6]等。与此同时,有研究表明基于天然化合物的治疗方法能有效抑制口腔中致病微生物的定植和生长,并且有的天然化合物在体外抗菌实验中还能够达到抑制口腔生物膜形成和减少口腔中成熟生物膜的作用[7],这就提示若将天然化合物用于牙周炎治疗可能在不造成耐药性问题的基础之上达到有效控制牙周病发展的效果。因此有越来越多的牙周炎药物研究开始将目光聚焦于具有较高安全性以及广泛生物学活性的天然化合物。
蓝萼甲素(glaucocalyxin A,GLA)是从唇形科香茶菜属植物蓝萼香茶菜中分离并提取出来的一种天然化合物,属于对映-贝壳杉烷型二萜类化合物[8],具有抗氧化活性、抗肿瘤活性、抗凝血及抗血栓活性、免疫活性、抗炎性以及抗菌活性[9]。但目前尚无关于GLA针对牙周致病菌的体外抗菌实验研究。
牙龈卟啉单胞菌(Porphyromonasgingivalis,P.gingivalis)是牙周病、尤其是慢性牙周炎病变区或活动部位最主要的优势菌,相关研究显示P.gingivalis在慢性牙周炎患者龈下菌斑中的检出率高达85.75%[10]。P.gingivalis能从龈沟或牙周袋内的上皮细胞侵入宿主的牙周组织中,释放各种毒素,诱导宿主产生一系列炎症反应。毒素的作用加之机体自身的免疫炎症反应将导致宿主牙周支持组织的吸收和破坏,最终使得牙齿松动、脱落。除此之外,P.gingivalis还能够逃避宿主的免疫防御,这一特点使得由P.gingivalis所导致的牙周组织的感染和破坏很难得到有效的控制[11]。因此,在与牙周炎相关的体外抑菌实验中常将P.gingivalis作为实验对象来观察和研究不同处理方式对牙周致病菌的作用[12-14]。
本研究观察GLA对P.gingivalis的生长及其生物膜的形成和生物活性的影响,初步探究GLA作为一种抗菌药物用于辅助治疗牙周炎的可行性。
1 材料与方法
1.1 基本材料
蓝萼甲素溶液(上海艾济生物科技有限公司);P.gingivalis ATCC 33277(上海交通大学医学院附属第九人民医院口腔微生物实验室);脑心浸液(BHI)培养基、培养液(BD,美国);厌氧培养箱(Baker,英国);酶标仪(Bio Tek Epoch2,美国);结晶紫染料(Sigma,美国);MTT试剂盒(上海碧云天)。
1.2 研究方法
1.2.1 细菌培养及鉴定 取冻存的 P.gingivalis ATCC 33277菌株于超净台中常规接种复苏。复苏成功后取适量菌液以四区划线法均匀涂布于BHI琼脂平板上,将平板倒置放入37℃恒温厌氧箱中厌氧培养72 h。待平板上形成形态均一的黑色菌落后,挑取其中部分单克隆菌落进行革兰氏染色,并在光学显微镜下根据P.gingivalis的形态学特点对复苏的菌株进行鉴定,鉴定无误后,挑取若干单克隆菌落接种至BHI液体培养基中进行增菌培养。
1.2.2 GLA对 P.gingivalis的药物敏感性实验 取培养至对数生长期的P.gingivalis,用BHI培养基将菌液浓度调整至约2.0×107CFU/mL,备用。
实验组为用BHI培养基稀释好的GLA与备用的菌液各100μL加入96孔板中混合,使其中GLA的终浓度分别为:1.25、2.5、5、10μmol/L,菌液的终浓度为1.0×107CFU/mL。对照组为菌液加BHI培养基,菌液终浓度同实验组。另设调零孔(200μL BHI培养基)用于实验组和对照组的调零。每组至少设置三副孔。
将上述配置好的孔板放入37℃恒温厌氧箱中厌氧培养48 h后,用酶标仪读取各组在600 nm波长时的吸光度值(A值)。将A600<0.05所对应的最小浓度定为GLA对P.gingivalis的最小抑菌浓度(minimum inhibitory concentration,MIC)[15]。各实验组的生长抑制率(%)=[(对照组A600-调零孔A600)-(实验组A600-调零孔 A600)]/(对照组 A600-调零孔 A600)×100%。实验至少重复3次。
各组取适量菌液涂布于BHI琼脂血平板上,将平板倒置放入37℃恒温厌氧箱中厌氧培养48 h,将观察到菌落数量为0的最小浓度定为GLA对P.gingivalis的最小杀菌浓度(minimal bactericidal concentration,MBC)。
1.2.3 GLA对 P.gingivalis生物膜形成的影响 实验组按照 GLA终浓度分为:1/4 MIC(1.25μmol/L)、1/2 MIC(2.5μmol/L)、MIC(5μmol/L),对照组培养基中不加入GLA,具体处理过程同1.2.2。将配置好的96孔板放入37℃恒温厌氧箱中厌氧培养48 h后取出,将孔板内多余液体弃去,用PBS轻轻冲洗3次,注意冲洗过程尽量小心轻柔不要破坏生物膜的完整性。然后往孔板内加入甲醇固定生物膜15 min,弃甲醇。待96孔板干燥后,往每孔中加入0.4%的结晶紫(crystal violet,CV)溶液染色15 min,弃染料,将多余染料冲洗干净,待96孔板充分干燥后,每孔加入100μL 95%乙醇溶液,另设调零孔,调零孔内只加100μL 95%乙醇溶液。盖上盖板轻轻震荡1 h,最后用酶标仪在波长550 nm处读取 A值[16]。
1.2.4 GLA对P.gingivalis生物膜的代谢活性的影响分组及处理同1.2.3,将配置好的96孔板放入37℃恒温厌氧箱中厌氧培养48 h后取出,将孔板内多余液体弃去,用PBS轻轻冲洗3次,然后往孔板内加入0.5%MTT 50μL,厌氧避光孵育4 h后弃去孔内液体,加入100μL DMSO进行溶解,另设调零孔,调零孔内只加100μL DMSO。轻轻震荡10 min后用酶标仪在波长490 nm处读取A值。
1.3 统计学方法
使用Graphpad Prism 6.0软件对实验数据进行统计学分析。定量资料采用±s表示。采用单因素方差分析法进行数据统计分析,P<0.05表示差异有统计学差异。
2 结 果
2.1 GLA对P.gingivalis的药物敏感性实验
如表1所示,当GLA浓度达到5μmol/L时,其所对应的 A600=0.024±0.008,是 A600<0.05所对应的最小浓度,故GLA对P.gingivalis的MIC为5μmol/L;在此浓度下有P.gingivalis细菌悬液中96%的细菌生长受到抑制(图1)。当GLA浓度达到1/2 MIC即2.5 μmol/L时,与对照组相比 P.gingivalis细菌悬液的生长已受到显著的抑制效果(P<0.05)(表1),此时GLA对P.gingivalis细菌悬液的生长抑制率已达61%(图1)。虽然 10μmol/L GLA对 P.gingivalis细菌悬液的生长抑制率高达99%,但与5μmol/L组相比其差异并无统计学意义(P>0.05)(图1)。
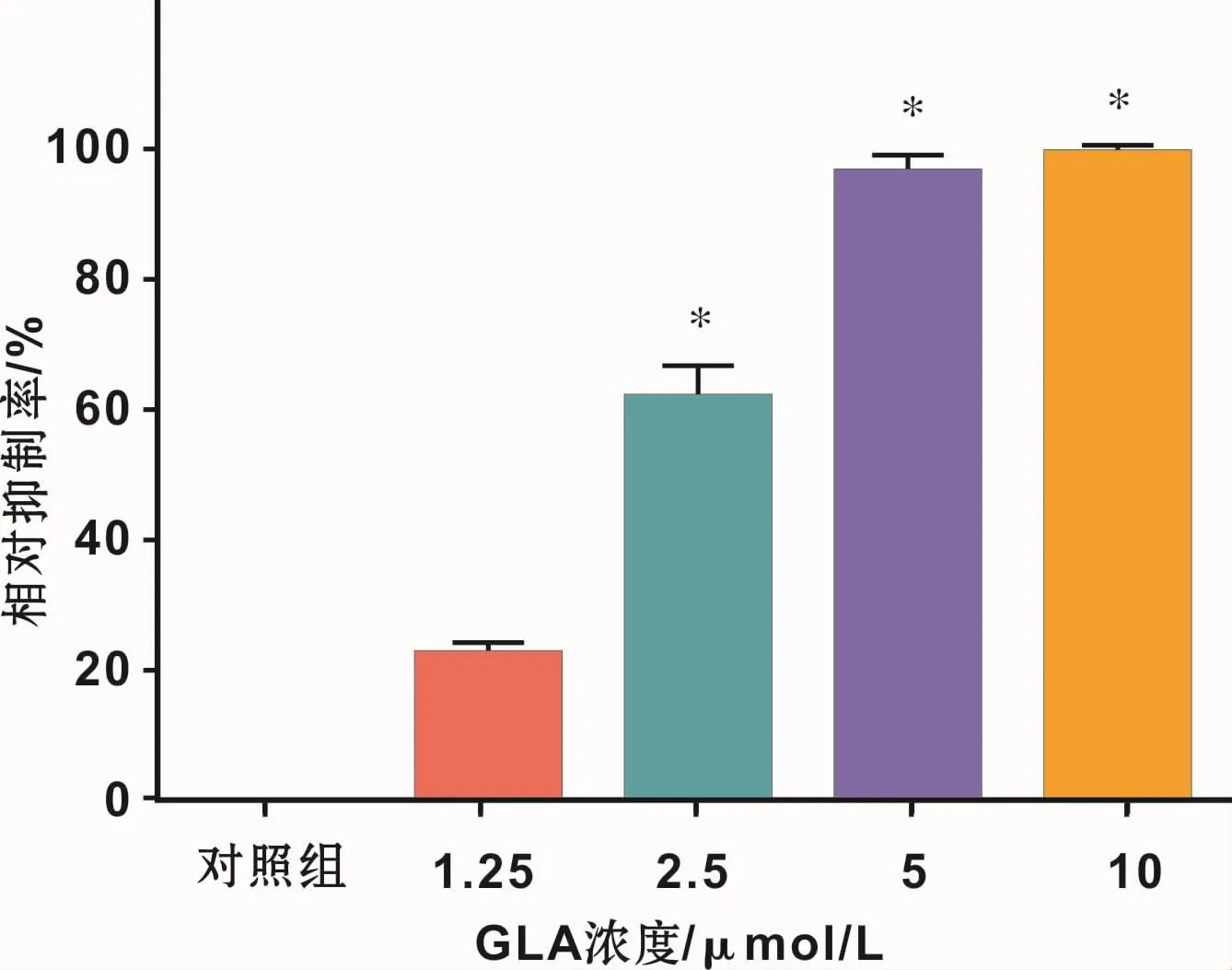
图1 不同浓度GLA对P.gingivalis细菌悬浮液生长的相对抑制率(与对照组相比,*P<0.000 1)Fig 1 Relative inhabitation rate of GLA on P.gingivalis bacterial planktonic cultures(compared with control group,*P<0.000 1)
表1 不同浓度GLA对P.gingivalis细菌悬浮液A值的影响 (±s)Tab 1 The effects of different concentrations of GLA on the A value of P.gingivalis bacterial planktonic cultures(±s)

表1 不同浓度GLA对P.gingivalis细菌悬浮液A值的影响 (±s)Tab 1 The effects of different concentrations of GLA on the A value of P.gingivalis bacterial planktonic cultures(±s)
注:与对照组比较,① P<0.05
分组 对照组 实验组(μmol/L)1.25 2.5 5 10 A600 0.554±0.015 0.520±0.062 0.126±0.037① 0.024±0.008① 0.021±0.006①
如图 2所示,当 GLA浓度为 2.5μmol/L和 5 μmol/L时,P.gingivalis在 BHI琼脂血平板上的生长情况与对照组无明显差异。当GLA浓度为10μmol/L时,与对照组相比P.gingivalis的生长受到显著抑制,只在划线的起始部分观察到明显的成群的菌落,随着划线往后菌落数量也随之减少,并且菌落密度也越来越低,甚至在划线的末端已未见有明显的黑色菌落形成。当GLA的浓度达到20μmol/L时,BHI琼脂血平板上的该区域内未见有P.gingivalis菌落生长和形成,菌落数为 0,故 GLA对 P.gingivalis的 MBC为 20 μmol/L,为 MIC值的4倍。
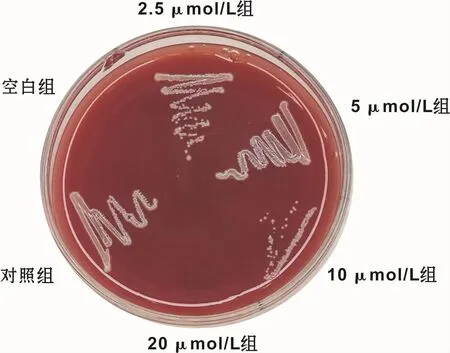
图2 不同浓度GLA对P.gingivalis在BHI琼脂血平板上的生长情况的影响Fig 2 The effect of different concentrations of GLA on the growth of P.gingivalis on BHI agar blood plate
2.2 GLA对P.gingivalis生物膜形成的影响
图3所示,当 GLA浓度达到1/4 MIC即1.25 μmol/L,GLA对 P.gingivalis生物膜的形成已经具有具有显著抑制作用(P<0.01),与对照组相比能够抑制 14%P.gingivalis生物膜的形成,而 1/2 MIC(2.5 μmol/L)的 GLA能抑制25%P.gingivalis生物膜的形成。当 GLA浓度升高到 MIC(5μmol/L),其对P.gingivalis生物膜形成的抑制作用进一步增强,能抑制76%P.gingivalis生物膜的形成。结果表明,GLA对P.gingivalis生物膜的形成过程具有一定的抑制作用,并且该抑制作用随着GLA浓度的升高而增强,呈浓度依赖性变化。

图3 结晶紫染色法检测不同浓度GLA对P.gingivalis生物膜形成的影响(*P<0.01,**P<0.000 1)Fig 3 The effect of different concentrations of GLA on the formation of P.gingivalis biofilm examined by crystal violet staining(*P<0.01,**P<0.000 1)
2.3 GLA对P.gingivalis生物膜代谢活性的影响
图 4示当 GLA浓度达到1/4 MIC(1.25μmol/L),P.gingivalis生物膜代谢活性开始受到抑制(P<0.01),此时有20%的生物膜代谢活性受到抑制;当GLA的浓度上升到 1/2 MIC(2.5μmol/L)时,能抑制38%P.gingivalis生物膜的代谢活性;MIC(5μmol/L)时已有74%的生物膜代谢活性受到抑制(P<0.000 1)。不同浓度的实验组之间的差异均存在统计学意义(P<0.05),说明 GLA对 P.gingivalis生物膜的代谢活性的抑制作用呈浓度依赖性,抑制作用从1.25μmol/L开始随着GLA浓度的升高而不断增强。

图4 MTT法检测不同浓度GLA对P.gingivalis生物膜生物活性的影响(与对照组相比,*P<0.01,**P<0.000 1)Fig 4 The effect of different concentrations of GLA on the viability of P.gingivalis biofilm examined by MTT assay(compared with control group,*P<0.01,**P<0.000 1)
3 讨 论
药物治疗虽然是治疗牙周炎的一种辅助手段,但在牙周组织的急性感染、器械不易到达的感染部位以及伴有全身性疾病的患者或不能行使口腔卫生措施的患者等特殊情况下往往能发挥非常重要的作用。鉴于目前抗生素的使用存在着诸如耐药性等在内的一系列问题[17],天然化合物的使用已经逐渐成为了研究的热点,越来越多的证据表明一些天然化合物能够对包括P.gingivalis在内的牙周致病菌的细菌悬液及生物膜产生抑制作用[18-20]。
GLA是一种提取自蓝萼香茶菜的天然化合物,具有良好的生物活性和较高的生物安全性,其抗菌活性很早就被人们发现和研究。早在1954年,就有日本学者发现从香茶菜中提取出来的对映-贝壳杉烷型二萜类化合物具有抑制革兰氏阳性细菌生长的作用。后来又有中国学者发现:蓝萼香茶菜的茎和叶的乙醇提取物对革兰氏阳性菌金黄色葡萄球菌表现出较好的抑菌活性,茎和叶的乙醇提取物对金黄色葡萄球菌的MIC分别为 25 mg/mL和 50 mg/mL[21]。金忠民等[22]的实验结果则显示蓝萼香茶菜提取物对金黄色葡萄球菌和大肠杆菌均有抑制作用,并且采用不同的提取剂其MIC也不一样。在上述实验中研究的蓝萼香茶菜提取物其实是蓝萼香茶菜的一种粗提取物,其中除了含有主要的活性成分GLA之外还有一些其他的化学成分。目前尚无针对分离纯化后的GLA的抗菌活性的相关研究,本实验是首次将分离纯化的GLA用于体外抗菌实验。
MIC的定义为:在特定时间段内肉眼能观察到的抑制微生物生长的最小药物浓度,MIC实验的金标准包括微量肉汤稀释法和琼脂稀释法,本实验在微量肉汤稀释法的基础之上采用酶标仪在特定波长下测定A值的方法来判定GLA的MIC值,这种方法较大多数实验所采用的肉眼判读方法更为客观和准确[12]。实验结果显示GLA对P.gingivalis的 MIC为5μmol/L(约1.66μg/mL),远小于上述实验中用蓝萼香茶菜提取物所测得的MIC,这一结果一方面证明了GLA具有良好的抗菌活性,另一方面还提示了GLA很可能就是蓝萼香茶菜提取物中发挥主要抗菌作用的活性成分。采用分离纯化后的GLA,排除了其他化学成分可能对实验结果产生的影响,从而使得本实验的最终结果更加的具体、准确,更具说服力,并且对于后续研究及实际临床运用更具参考价值和指导意义。
牙周致病微生物在口腔中往往是以生物膜的形式存在的。细菌生物膜的特殊结构使得其既不能被水冲去或漱掉,同时也使得其中的细菌能够抵抗表面活性剂、抗生素或宿主防御功能的杀灭作用。相关研究显示,细菌生物膜的基质能够阻止抗生素进入嵌入其中的细菌细胞,所以即使抗生素能够通过物理作用在生物膜表面流动也无法穿透生物膜基质发挥其杀菌作用[23]。本实验采用结晶紫染色法来进行生物膜的敏感性实验,这是生物膜检测的一种标准方法[24],即用结晶紫染料对生物膜成分进行染色,使生物膜中的活细胞、死细胞以及生物膜基质染色,然后再通过染色的深浅程度来对生物膜进行量化分析,相关证据表明此法的检出率优于其他生物膜检测方法。MTT实验的实验原理是利用活细胞中的琥珀酸脱氢酶将外源性的MTT还原为不溶于水的紫色结晶状甲臜(Formazan),甲臜能够溶解于二甲亚砜(DMSO),溶解后能够用酶标仪对其进行定量分析[25]。MTT实验虽然常常用于细胞毒性的检测试验,但实际上它同样可以运用于微生物实验,如:多重耐药菌的检测试验、生物膜形成的测定实验以及抗菌化合物的间接定量检测实验等,与结晶紫染色实验相比,MTT实验除了能够对生物膜进行定位和定量分析之外,最主要的是能够反映生物膜中活细菌的存在,从而能够对生物膜的代谢活性进行定量的分析,是对结晶紫染色实验的补充和延伸。本实验结果显示GLA对P.gingivalis生物膜的形成过程及其生物学活性均具有抑制作用,当GLA浓度达到对P.gingivalis浮游菌具有显著抑制作用的MIC值时,其对P.gingivalis生物膜的形成和代谢活性也同样有较为显著的抑制作用。GLA的这一特性能够使其在抑制牙周致病菌生长的同时还能够有效防止细菌粘附和定植,阻止其在口腔中形成生物膜,从而进一步阻止牙周致病菌对牙周组织的的损害。
综上所述,本实验证明GLA作为一种天然化合物,对P.gingivalis有较好的抑菌效果,并且还能够有效抑制P.gingivalis生物膜的形成及代谢活性,加之其较高的生物安全性及较好的抗炎活性[26],GLA有望成为牙周炎辅助治疗的一种新型药物,在防止牙周致病菌的定植、抑制口腔生物膜的形成和生长及减轻牙周组织炎症反应等方面发挥作用。
