外源性L-抗坏血酸对斑玉蕈子实体发育过程中氧化还原体系的影响
2021-07-28戴建成陈辉张津京郝海波韩灿灿赵明文冯志勇
戴建成,陈辉,张津京,郝海波,韩灿灿,赵明文,冯志勇*
(1.南京农业大学生命科学学院,江苏 南京 210095;2.上海市农业科学院食用菌研究所上海市农业遗传育种重点开放实验室/农业农村部南方食用菌资源利用重点实验室/国家食用菌工程技术研究中心,上海 201403)
斑玉蕈Hypsizygusmarmoreus(Peck)H. E. Bigelow又名玉蕈,俗称真姬菇、蟹味菇等,属于伞菌目(Agaricales)口蘑科(Tricholomataceae)玉蕈属(Hypsizipussinger)。斑玉蕈是北温带一种优良的食用菌。斑玉蕈味比平菇鲜,肉比滑菇厚,质比香菇韧,口感极佳,还具有独特的蟹香味,在日本有“香在松口蘑、味在玉蕈”之说。斑玉蕈有防止便秘、抗癌、防癌、提高免疫力、预防衰老、延长寿命的独特功效。作为大众消费的食品,其货架期长,是一种低热量、低脂肪的保健食品[1]。
斑玉蕈生产周期通常为100~120 d,约为金针菇和杏鲍菇生产周期的2倍,生产效率相对较低,这个问题是影响其产业发展的重要因素。有研究发现在培养基中添加适量的MgSO4、KCl和NaCl对斑玉蕈菌丝生长具有一定的促进作用[2];在培养基中添加适量的叶酸、烟酸、维生素B1和维生素B2,对斑玉蕈菌丝生长具有一定的促进作用,其中叶酸的促进作用最强,烟酸次之[3]。肥皂草素具有抑制斑玉蕈的营养生长、促进斑玉蕈原基发生与发育以及缩短斑玉蕈培养周期的作用[4-5];外源添加曲酸可以提高漆酶和纤维素酶活性,增强菌丝对木质纤维素的利用,为斑玉蕈子实体生长发育提供更多的能源,从而增加子实体产量[6]。郝海波[7]发现添加富氢水不仅能够有效提高斑玉蕈子实体的产量,而且缩短菌丝的后熟期并促进原基的形成。然而,皂苷和曲酸都是化学试剂,存在安全隐患。富氢水价格相对昂贵,成本过高。因此,这些都不是增加斑玉蕈产量的理想添加剂。
L-抗坏血酸是一种必需的营养素,在多种羟基化反应和维持包括线粒体和内质网在内的细胞器中的氧化还原稳态中发挥关键作用[8]。抗坏血酸是催化DNA去甲基化的11个易位双加氧酶的辅助因子[9]。抗坏血酸(维生素C的还原形式)能清除生理上相关的活性氧和氮物质[10]。L-抗坏血酸可以减少非自由基物质,并再生循环抗氧化分子,如维生素E[11]。L-抗坏血酸能促进多巴胺、去甲肾上腺素、血管加压素和血管升压素的合成,还可作为胶原蛋白合成辅助因子促进伤口愈合[12]。适量的L-抗坏血酸能够使心情愉悦[13]。Chen等[14]发现当斑玉蕈菌丝生长时间为80 d时,外源添加L-抗坏血酸可以增强菌丝的抗氧化能力,促进损伤的菌丝恢复并提高其产量。
本文主要探究通过外源添加L-抗坏血酸,观察斑玉蕈40和120 d的菌丝中抗氧化物质含量及相关酶活性的变化,从不同培养时期验证L-抗坏血酸是否有增强菌丝的抗氧化能力,促进损伤的菌丝恢复并提高其产量的类似作用。该研究为今后研究斑玉蕈子实体发育并提高其生产效率奠定理论基础。
1 材料与方法
1.1 供试菌株及试剂
斑玉蕈(SIEF3133)由中国微生物菌种保藏管理委员会农业微生物中心上海食用菌分中心提供,为上海市农业科学院食用菌研究所选育的工厂化栽培菌株。按照上海光明森源生物科技有限公司斑玉蕈工厂化标准进行栽培生产,具体试验栽培流程参照刘明广等[15]的方法。L-抗坏血酸(AsA)购于上海生工生物技术有限公司,AsA、MDA测定试剂盒购于南京建成生物工程研究所,其他试剂盒均购于苏州科铭生物技术有限公司。
1.2 试验设计及处理
工厂化斑玉蕈栽培中使用的栽培瓶大小为1 100 mL,瓶中的栽培料量为(870±50)g。处理组是在搔菌后向栽培料内添加15 mL 400 mg·L-1AsA;对照组向搔菌后栽培料内添加15 mL蒸馏水。以上每种处理重复试验16瓶,放入工厂菇房里,严格按照工厂化生产要求管理。分别于菌丝恢复期(H-M)、菌丝转色期(H-V)、原基期(H-P)和子实体期(H-F)取样,用药匙取5 g左右的栽培料放入取样袋里,并用订书机封好袋口,每个时期取4瓶,每瓶取6个样。样品立即放入液氮罐冷冻20 min,然后转移至-80 ℃冰箱中保存。在斑玉蕈出菇期间采收子实体,统计产量。
1.3 斑玉蕈菌丝细胞内AsA含量的测定
取保存在-80 ℃冰箱中培养40和120 d的斑玉蕈菌丝样品,在研钵中用液氮充分研磨后,分别精确称取0.1 g,加入1 mL提取液,充分混匀,放置15 min后于4 ℃、3 500 r·min-1离心10 min。收集上清液置于冰上,用TECAN Infinite 200 PRO型多功能酶标仪测定AsA含量。
1.4 斑玉蕈菌丝细胞内抗氧化物质含量的测定
取保存在-80 ℃冰箱中培养40和120 d的斑玉蕈菌丝样品,在研钵中用液氮充分研磨后,分别精确称取0.1 g,加入1 mL提取液进行冰浴匀浆。4 ℃、8 000 r· min-1离心10 min,取上清液置冰上待测。用多功能酶标仪测定还原型谷胱甘肽(GSH)和氧化型谷胱甘肽(GSSG)含量。
取保存在-80 ℃冰箱中培养40和120 d的斑玉蕈菌丝样品,在研钵中用液氮充分研磨后,分别称取 1 g 放入10 mL的离心管中,另加9 mL 0.9%的生理盐水。4 ℃、10 000 r·min-1离心10 min,取上清液用于测定。用多功能酶标仪测定丙二醛(MDA)含量。
1.5 斑玉蕈活性氧(ROS)含量的测定
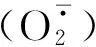
取保存在-80 ℃冰箱中培养40和120 d的斑玉蕈菌丝样品,在研钵中用液氮充分研磨后,称取约 0.1 g 组织,加入1 mL提取液进行冰浴匀浆;转移至EP管中,定容至1 mL,4 ℃、8 000 r·min-1离心10 min,取上清液置冰上待测。用多功能酶标仪测定H2O2含量。
1.6 斑玉蕈抗氧化酶活性的测定
取保存在-80 ℃冰箱中培养40和120 d的斑玉蕈菌丝样品,在研钵中用液氮充分研磨后,称取约 0.1 g 组织,加入1 mL提取液进行冰浴匀浆。4 ℃、8 000 r·min-1离心10 min,取上清液置冰上待测。上清液稀释2倍。用多功能酶标仪测定谷胱甘肽过氧化物酶(GPX)、谷胱甘肽还原酶(GR)、超氧化物歧化酶(SOD)及过氧化氢酶(CAT)的活性。
1.7 数据处理与方法
所有试验数据均为平均值±标准差,每个试验3次生物学重复,并使用GraphPad Prism 6.0处理数据和图表。通过单向方差分析(ANOVA)结合Duncan’s的多范围检验来分析处理之间的差异。
2 结果与分析
2.1 L-抗坏血酸(ASA)对斑玉蕈子实体产量的影响
在菌丝培养时间分别为40和120 d时,添加400 mg·L-1AsA显著增加斑玉蕈子实体产量(图1)。菌丝培养120 d时斑玉蕈子实体产量为265.23 g,是菌丝培养40 d时产量的2.80倍。外源添加AsA后,菌丝培养40 d时AsA处理组的斑玉蕈产量为104.01 g,比对照组增加10%(P<0.05);当菌丝培养时间为120 d时,处理组产量为278.49 g,比对照组增加5%(P<0.05)。这说明外源添加AsA后,可以显著提高斑玉蕈子实体产量,且不同培养时间菌丝的增产效率差异显著。
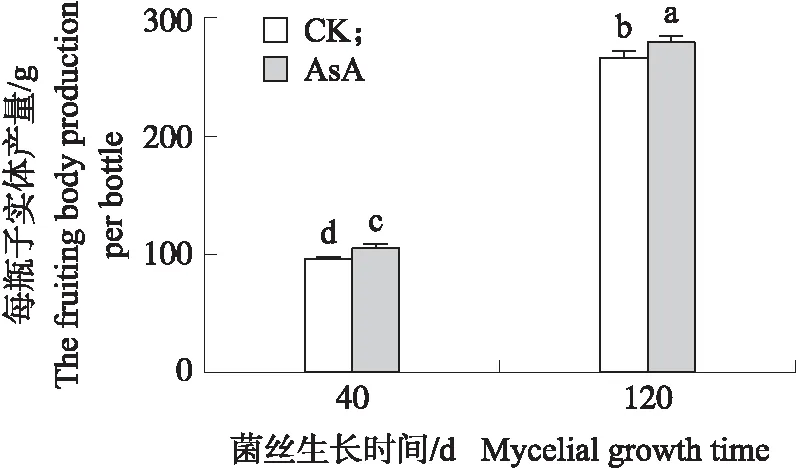
图1 外源添加L-抗坏血酸(AsA)对不同培养时间斑玉蕈菌丝子实体产量的影响Fig.1 The effects of addition of L-ascorbic acid(AsA)on the fruiting body production ofHypsizygus marmoreus during different mycelial growth period CK. 对照组;AsA. 添加L-抗坏血酸的试验组。不同小写字母表示不同处理在0.05水平差异显著。下同。CK. Control;AsA. Experimental group using ascorbic acid as additive. The different lowercase letters mean significant difference during treatment at 0.05 level. The same as follows.
2.2 外源添加AsA对斑玉蕈内源L-抗坏血酸含量的影响
由图2可知:当斑玉蕈菌丝培养时间为40 d时,处理组和对照组内源AsA含量在斑玉蕈不同发育时期呈先上升后下降的趋势。处理组中,AsA含量在H-V时最大,显著高于对照组,在H-M时AsA含量最低。对照组中,AsA含量在H-P时最大,H-F时AsA含量最低。在菌丝培养时间为120 d时,处理组中 AsA含量在H-M时最大,在H-F时其含量最低;对照组AsA含量在H-V最大,在H-F时AsA含量最低。
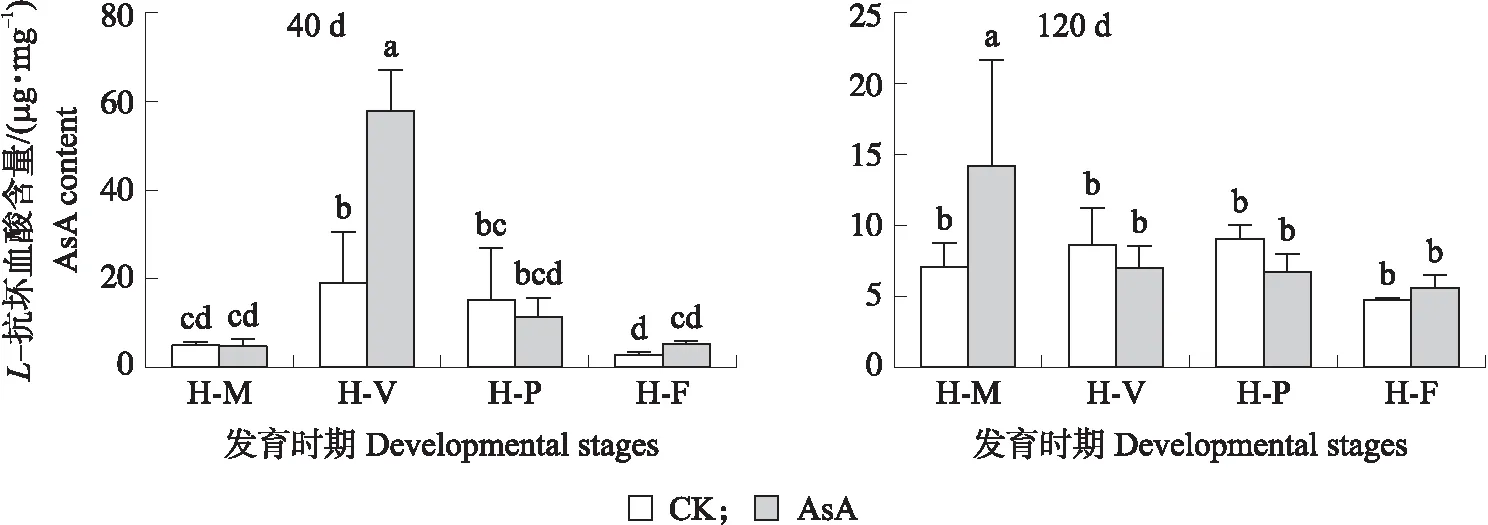
图2 外源AsA对不同发育时期斑玉蕈内源AsA含量的影响Fig.2 Effects of exogenous AsA on endogenous AsA content in different developmental stages of Hypsizygus marmoreus H-M. 菌丝恢复期Mycelial regeneration stage;H-V. 菌丝转色期Mycelial pigmentation stage;H-P. 原基期Primordium stage;H-F. 子实体期Fruiting stage. 下同。The same as follows.
2.3 外源添加AsA对不同发育时期斑玉蕈还原型谷胱甘肽(GSH)含量的影响
由图3可知:在菌丝培养40 d时,处理组GSH在H-P时含量最大,其在H-F时含量最低。对照组GSH含量在H-P时最大,在H-V时含量最低。外源添加AsA显著增加H-V时GSH含量。在此时期,处理组GSH含量显著低于对照组,而在H-P和H-F时处理组和对照组无显著差异。当菌丝培养时间为 120 d 时,处理组和对照组的GSH合成规律都呈先增加后降低的趋势,在H-V时含量最大,在H-F时含量最低。这说明在菌丝培养时间为40 d时,AsA主要作用于菌丝转色期。外源添加AsA可显著增加H-M时120 d菌丝胞内的GSH含量,这说明在菌丝培养时间为120 d时,外源添加AsA可通过调控菌丝恢复过程影响子实体的发育。

图3 不同发育时期斑玉蕈菌丝细胞内还原型谷胱甘肽(GSH)含量Fig.3 Content of reduced glutathione(GSH)in mycelium cells during different developmental stages
2.4 外源添加 AsA对不同发育时期斑玉蕈氧化型谷胱甘肽含量(GSSG)的影响
由图4可知:在菌丝培养40 和120 d时,细胞内GSSG含量都呈先升高后降低趋势,在H-V时GSSG含量最大,在H-F时GSSG含量最低,但是培养120 d的菌丝GSSG含量总体比培养40 d的菌丝多。另外,在菌丝培养40 d时,外源添加AsA显著增加H-P和H-F时GSSG含量;在H-M和H-V时,处理组菌丝的GSSG含量比对照组少(P<0.05)。这说明在菌丝培养时间为40 d时,AsA主要作用于原基的发生和子实体生长期。培养120 d时,外源添加AsA可显著增加H-V时菌丝胞内GSSG含量,显著减少H-M时GSSG含量,这说明在菌丝培养时间为120 d时,外源添加AsA可通过调控菌丝恢复和转色过程,进而影响子实体的发育。

图4 不同发育时期斑玉蕈菌丝细胞内氧化型谷胱甘肽(GSSG)含量Fig.4 Content of oxidized glutathione(GSSG)in mycelium cells during different developmental stages
2.5 外源添加 AsA对不同发育时期斑玉蕈丙二醛(MDA)含量的影响
由图5可知:在菌丝培养40 和120 d时,菌丝的MDA含量都呈先升高后降低的趋势,在H-V时MDA量最大,在H-F时MDA含量最低。120 d菌丝MDA含量总体比培养40 d菌丝少。另外,在菌丝培养40 d时,外源添加AsA后H-V时的MDA含量显著降低,而在其他时期无明显影响(P>0.05)。这说明在菌丝培养40 d时,AsA主要作用于菌丝H-V。外源添加AsA后,H-V时菌丝MDA含量显著降低,但在菌丝其他时期,MDA含量无显著性变化。这说明在菌丝培养120 d时,外源AsA通过调控菌丝转色这个过程,以降低脂质过氧化和减轻膜损伤,进而影响斑玉蕈子实体发育。

图5 不同发育时期斑玉蕈菌丝细胞内丙二醛(MDA)含量Fig.5 Content of malondialdehyde(MDA)in mycelium cells during different developmental stages
2.6 外源添加 AsA对不同发育时期斑玉蕈活性氧(ROS)含量的影响
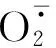
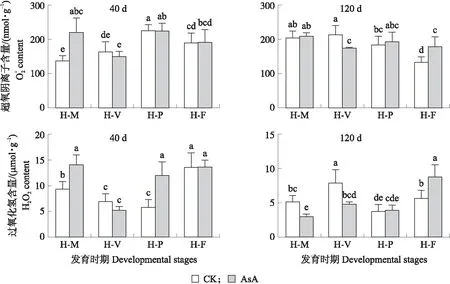
图6 不同发育时期斑玉蕈菌丝细胞内活性氧(ROS)含量Fig.6 Content of reactive oxygen species(ROS)in mycelium cells during different developmental stages
在菌丝培养40 d时,细胞内的过氧化氢含量呈先逐渐降低后升高的趋势,在H-F时H2O2含量达到最大,在H-P时H2O2含量最低。120 d的菌丝中,H2O2含量呈先升高后降低再升高的趋势,在H-V时H2O2含量最大,H-P时H2O2含量最低。培养120 d的菌丝H2O2含量总体比培养40 d的菌丝低。另外,在菌丝培养40 d时,添加AsA显著增加H-M、H-P时H2O2含量;在H-V时,处理组菌丝的H2O2含量比对照组低(P>0.05)。这说明在菌丝培养40 d时,AsA主要作用于H-M和H-P时。外源添加AsA后,H-F时菌丝H2O2含量显著增加,H-M、H-V时H2O2含量显著降低,H-P时菌丝的H2O2含量则无显著性变化。这说明在菌丝培养120 d时,外源加入AsA可以显著调控菌丝恢复、转色和子实体生长过程,进而影响斑玉蕈子实体发育。
2.7 外源添加AsA对不同发育时期斑玉蕈抗氧化酶活性的影响
由图7可知:在菌丝培养40 d时,GPX活性呈逐渐升高的趋势,在H-F时GPX活性最大,在H-M时GPX活性最低。培养120 d的菌丝GPX活性呈先升高后降低的趋势,其活性总体比培养40 d的菌丝高;在H-V时GPX活性最大,H-F时GPX活性最低。另外,在菌丝培养40 d时,处理组H-F时GPX活性显著增加;在H-M、H-V和H-P时,处理组菌丝的GPX比对照组高(P>0.05)。这说明在菌丝培养40 d时,AsA主要作用于子实体生长后期。外源添加AsA后,H-V的GPX酶活显著增加,但是H-M、H-P和H-F的菌丝GPX活性无显著性变化(图7-B)。在菌丝培养120 d时,外源添加AsA后,通过显著调控菌丝转色这个过程,进而影响斑玉蕈子实体发育。
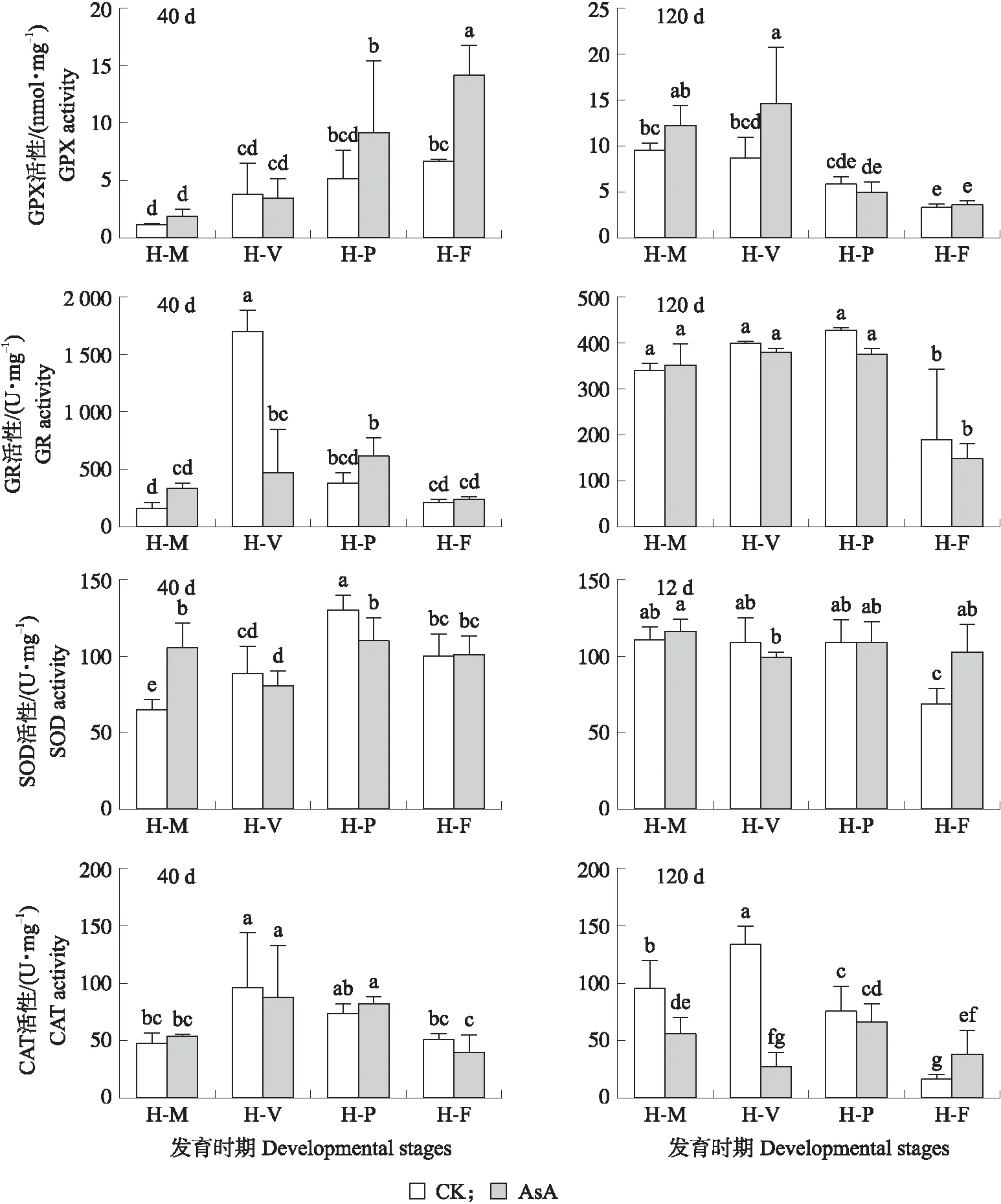
图7 不同发育时期斑玉蕈菌丝细胞内GPX、GR、SOD、CAT活性Fig.7 Activities of GPX,GR,SOD,CAT in mycelial cells of during different developmental stages GPX:谷胱甘肽过氧化氢酶Glutathione peroxidase;GR:谷胱甘肽还原酶Glutathione reductase;SOD:超氧化物歧化酶Superoxide dismutase;CAT:过氧化氢酶Catalase.
在菌丝培养40 和120 d时,细胞内的GR活性均呈先升高后降低的趋势。在菌丝培养40 d时,H-V时GR活性最大,H-F时GR活性最低。而培养120 d的菌丝,GR活性在H-P时最大,在H-F时酶活性最低,且该菌丝的GR活性总体和培养40 d的菌丝一样。另外,在菌丝培养40 d时,外源添加AsA后,H-V时GR活性显著降低;在H-M、H-P和H-V时,处理组菌丝GR活性比对照组低(P>0.05)。外源添加AsA对菌丝GR的活性无显著性变化。
在菌丝培养40 d时,SOD活性呈先降低后升高的趋势,在H-P时SOD活性最大,在H-M时SOD活性最低;而培养120 d的菌丝SOD活性则在H-F时显著降低。总体来说,培养120 d的菌丝中SOD活性比培养40 d的菌丝高。另外,在菌丝培养40 d时,与对照组相比外源添加AsA后H-M时SOD活性显著增加,在H-P时活性显著降低;在其他时期活性无明显变化(P>0.05)。
在菌丝培养40 和120 d时,细胞内的CAT活性都呈先升高后降低趋势。菌丝培养40 d时,在H-V时其活性最大,在H-M时CAT活性最低。在菌丝培养40 d时,外源添加AsA对菌丝的CAT活性无显著影响(P>0.05)。这说明外源添加AsA后,H-F时菌丝的CAT活性显著增加,H-M、H-V时CAT活性显著降低,H-P时CAT活性则无显著性变化。在菌丝培养120 d时,外源添加的AsA,通过显著调控H-M、H-V和H-F这3个过程,进而影响子实体发育。
3 讨论
斑玉蕈栽培周期长,即从菌丝生长到向子实体生长转化前,必须经过60~70 d的菌丝体后熟阶段[6]。如果后熟阶段时间偏短,子实体产量将会下降[16]。笔者前期研究发现,培养40和120 d的菌丝搔菌后,120 d的子实体产量(每瓶265.23 g)是菌丝培养40 d产量(每瓶94.56 g)的2.80倍。并且,外源添加AsA对于不同培养时期的菌丝后熟期增产效率也不一样。外源添加AsA对培养40 d的菌丝增产效率高于120 d。因此,在菌丝培养一定时期搔菌后,添加适量的AsA,可以提高子实体的产量。这为今后提高工厂化生产斑玉蕈的产量,提供了解决方法。
陈辉等[17]研究发现,前期添加外源皂苷能抑制降解纤维素酶活性,从而不利于菌丝的生长;后期则起促进纤维素酶发挥作用,为子实体的生长发育提供更多碳源,增加子实体产量。张津京等[6]研究外源添加曲酸,可提高漆酶和纤维素酶活性,进而提高菌丝利用木质纤维素的能力,为斑玉蕈子实体生长发育提供更多能源,增加子实体产量。添加海藻糖的培养基不仅能为斑玉蕈菌丝生长提供良好的营养和环境[18]、显著加快食用菌菌丝的生长速度、提高菌丝生物量,还可增强斑玉蕈在培养过程中应对环境胁迫的能力[19]和显著提高斑玉蕈漆酶的活性[20]。这3种物质均通过影响木质素降解的相关酶活性,来达到增产的效果。外源添加富氢水和AsA所起的作用相似,即通过影响斑玉蕈相关的抗氧化酶活性,进而影响其生长发育,最终达到增产。
本研究发现,外源添加AsA能显著提高斑玉蕈菌丝转色期的内源AsA含量,显著降低MDA、ROS含量,提高培养40 d的菌丝恢复期和培养120 d的子实体SOD活性。在菌丝培养40 d时,外源添加AsA,菌丝恢复期的GSH含量显著降低,而菌丝转色期的GSH含量显著提高。由这些结果可知,L-抗坏血酸提高斑玉蕈产量,并不是单一的发挥抑制或者抗氧化的作用,可能是一个综合作用的表现。在测量多种抗氧化酶活性时发现,外源添加AsA,总体上提高了GPX、GR、SOD和CAT活性,但是不同酶发挥的主要作用方式或时间不同,它们响应L-抗坏血酸的方式有差异。
综上所述,外源添加L-抗坏血酸能增加斑玉蕈子实体产量,且不同培养时期的增产率不同。在斑玉蕈生殖生长阶段,外源添加L-抗坏血酸后,抗氧化酶活性提高,MDA和ROS含量降低,以达到提高菌丝的抗氧化胁迫能力。该种菌丝可降低外界伤害,为子实体的生长发育提供更好的物质基础,从而提高子实体产量。
