分娩启动前后孕激素调控子宫肌层静息与收缩分子机制研究进展
2021-07-28张亮潘红梅郭宗义
张亮,潘红梅,郭宗义
(重庆市畜牧科学院,重庆 402460)
在妊娠的大部分时间里,子宫平滑肌在孕酮的作用下,保持松弛平顺的状态,也会通过细胞肥大和体积扩张来适应胎儿的生长发育。分娩过程则会出现子宫肌层细胞有力且有节律性收缩,子宫肌层这种激活状态的转换和腹部肌肉收缩的同步是母体启动分娩的关键。然而不同物种在整个怀孕期间子宫肌层的静息状态受胎盘或卵巢黄体分泌的孕酮(progesterone,P4)控制的机制却不同。在人类中主要由单个基因产生的不同转录本、孕激素受体(progesterone receptor,PR)PR-A(94 k)和PR-B(114 k)异构体来介导P4阻断肌层收缩的作用。尽管PR-A和PR-B均可与DNA中的孕酮反应元件(progesterone response element,PRE)结合,但PR-A包含PR-B中存在的3个转录激活域中的2个,因此转录活性较低。在体外培养的人子宫肌细胞中PR-A抑制PR-B转录活性[1],说明PR-A对子宫肌层中的PR-B有潜在拮抗作用。此外,在分娩的女性子宫肌层中PR-A与PR-B的mRNA[2]和蛋白质[1]的比例显著高于足月不分娩女性,说明 PR-A 和PR-B在妊娠期间在人子宫肌层中存在不同的调控模式[3-4]。
啮齿动物和大多数哺乳动物母体在整个怀孕期间P4水平仍然维持高水平,并在分娩前急剧下降,然而人和豚鼠的血浆中P4浓度以及肌层中PR表达在分娩前期却没有出现下降[5]。此外在缺乏Ⅰ型5α还原酶或在子宫内膜中表达20α羟类固醇脱氢酶(20α-HSD)[6]的小鼠会出现分娩延迟,可见子宫颈和子宫肌层内P4代谢为无生物活性的产物对于其正常的分娩启动至关重要。由此可见胎盘哺乳动物的分娩都是由一系列保守的分子事件所引发的,而引起分娩的关键就是PR维持子宫静息能力的解除或阻断。本文回顾了妊娠期间P4/PR通过不同途径维持子宫肌层静息的主要机制以及分析引起分娩前期的PR性阻断的主要因素,为进一步了解哺乳动物分娩启动的分子机制和在畜牧生产中更好地控制母畜分娩提供有益思路。
1 雌性动物分娩与子宫肌层炎性反应或母体炎症负担增加有关
早产和足月分娩是由炎症反应增强、羊水中促炎细胞因子水平升高、中性粒细胞和巨噬细胞(M)侵入胎膜、子宫颈以及子宫肌层[7]引起的(图1)。母体外在的(如宫内压力、子宫内感染)和内在的(例如子宫扩张、胎儿成熟、胎膜老化)各种因素都能引起子宫肌层炎性反应[8-10]。甚至有学者认为哺乳动物的分娩本质上是炎症反应的过程,是源发于子宫肌层、子宫颈和蜕膜内的无菌组织炎症的继发反应[11-12]。多数早产与子宫内、生殖道感染以及细菌性阴道炎有密切关系[13-15]。对恒河猴的研究表明,母体妊娠组织中的炎症反应先于分娩发生,并且对怀孕的恒河猴和小鼠子宫内实施促炎性刺激都将引发早产[16-17]。此外,随着迁移至子宫肌层的免疫细胞分泌细胞因子和趋化因子引起NF-κB和其他炎症相关转录因子如激活子蛋白1(activator protein 1,AP-1)等的激活[15,19-21],这些活化的转录因子促进子宫肌层促炎因子,如白细胞介素(interleukin,IL)-1β、IL-8和收缩相关蛋白(contraction-associated protein,CAP)基因的表达,如连接蛋白43(connexin 43,CX43)、催产素受体(oxytocin receptor,OXTR)和环氧化酶2(cyclooxygenase 2,COX-2),这一系列炎症相关的分子事件都与分娩的发生密切相关[22]。
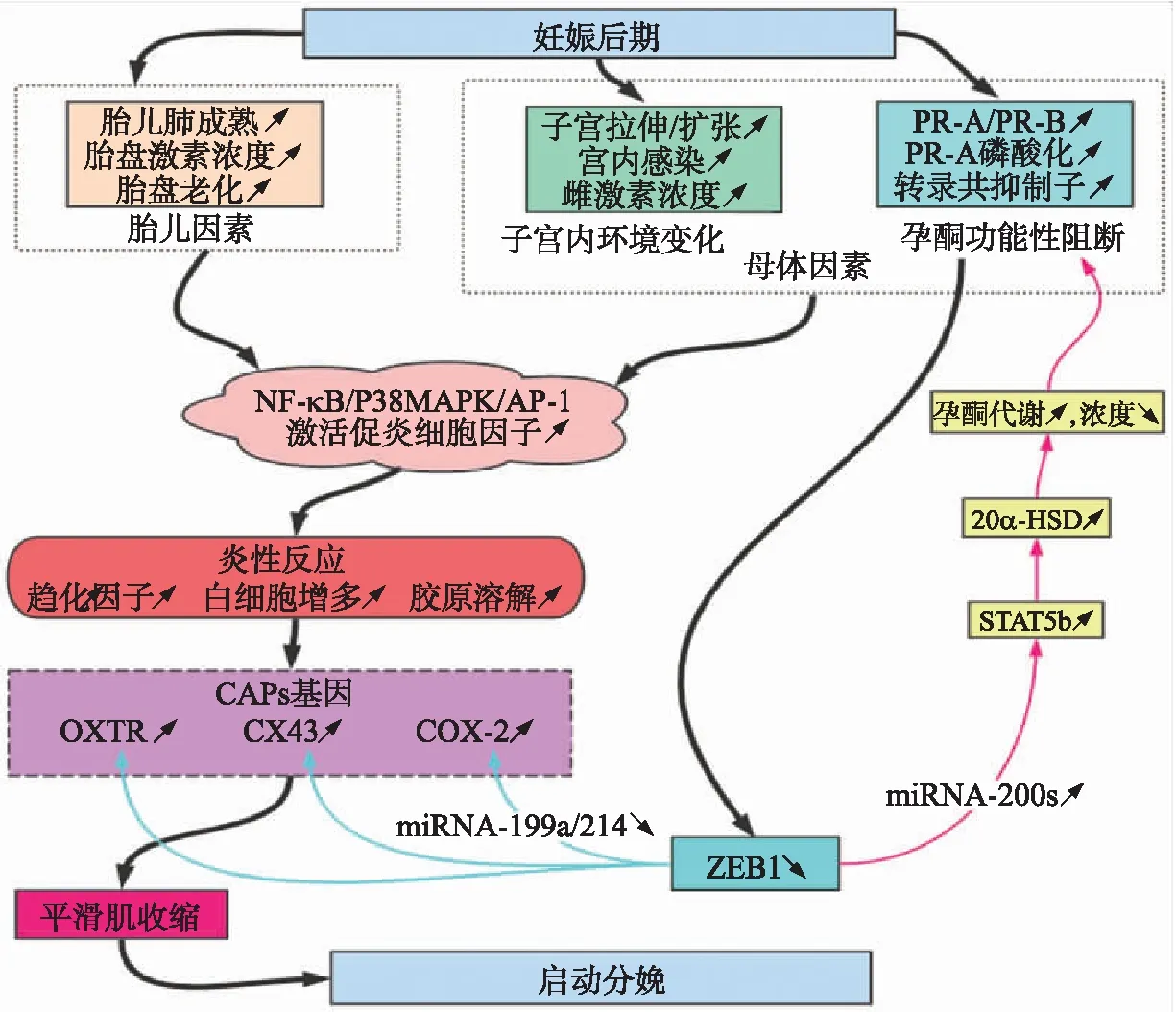
图1 由孕酮功能性阻断介导的雌性动物足月分娩启动与炎症反应有关[18]Fig.1 The initiation of term parturition induced by P4/PR functional blockade is associated with an inflammatory response[18] PR:孕激素受体Progesterence receptor;NF-κB:核因子κB Nuclear factor kappa-B;AP-1:激活子蛋白1 Activator protein 1;P38MAPK:p38丝裂原活化蛋白激酶信号通路p38 mitogen-activated protein kinase signal pathway;ZEB1:E 盒结合锌指蛋白Zinc finger E-box-binding protein 1;CX43:连接蛋白43 Connexin 43;OXTR:催产素受体Oxytocin receptor;COX-2:环氧化酶2 Cyclooxygenase 2;20α-HSD:20α羟类固醇脱氢酶20α-hydroxysteroid dehydrogenase;STAT5b:信号传导及转录激活蛋白5b Signal transducer and activator of transcription protein 5b.箭头表示该物质促进或引起了后面生理反应或化学作用;↗表示该基因表达量增多或该蛋白功能增强;↘表示该基因表达量减少或该蛋白功能缺失。下同。Arrow indicates that the substance promotes or causes subsequent physiological or chemical reactions;↗indicates that the gene/protein up-expressed;↘indicates that the gene/protein down-expressed. The same as follows.
2 P4/PR通过多种途径来保持子宫肌层静息状态
如前所述母体的炎症反应是引起子宫肌层收缩并导致分娩的重要因素,而在妊娠期间母体主要是由P4/PR通过多种途径来维持肌层静止。包括:1)诱导促炎性转录因子激活抑制剂的表达,如核因子κB抑制子(inhibitor a of NF-κB,IκBα)和丝裂原活化蛋白激酶磷酸酶1(mitogen-activated protein kinase phosphatase-1,MKP-1),降低NF-κB的活性和活化蛋白1(AP-1)的转录活性;2)通过相互作用和募集共抑制子抑制炎症前转录因子活性(如NF-κB)和CAP基因表达;3)通过诱导CAP基因转录阻遏物E 盒结合锌指蛋白1/2(zinc finger E-box-binding protein,ZEB1/2)和STAT5b的表达,维持肌层静止;4)诱导半胱天冬酶活化,降解CAP蛋白维持肌层静息状态(图2)。

图2 雌性动物妊娠期间P4/PR维持子宫肌层静止的机制[18]Fig.2 Mechanisms for P4/PR maintenance of myometrial quiescence during pregnancy[18] IκBα:核因子κB抑制子Inhibitor of NF-κB;MKP-1:丝裂原活化蛋白激酶磷酸酶1 Mitogen-activated protein kinase phosphatase-1;p65/p50:NF-κB转录相关的蛋白p65和p50形成的异源二聚体NF-kappaB subunits p65 and p50. 下同。The same as follows.
2.1 P4/PR通过诱导促炎转录因子激活抑制剂(IκBα、MKP-1)的表达来抑制NF-κB和AP-1的活化
大量研究[23-25]表明P4/PR通过阻止炎症的作用维持子宫肌层的静止(图2)。在培养的人永生化子宫平滑肌(hTERT-HM)细胞中,P4/PR通过拮抗NF-κB的活化并阻止COX-2[24,26]、促炎性细胞因子和CAP基因的诱导而发挥抗炎作用。使用染色质免疫沉淀(ChIP)技术研究后发现,用P4处理hTERT-HM细胞可阻止白介素1(IL-1)诱导的内源性NF-κB p65与COX-2和IL-8启动子上反应元件的结合[4,23]。P4介导的促炎性和CAP基因转录的抑制可能是由于PR与p65结合对NF-κB DNA结合的抑制和CAP基因转录活性的降低所引起的。
P4/PR还可以通过增加IκBα的表达来阻断NF-κB的活化和炎性反应,IκBα隔离细胞质中的NF-κB并阻止其活化[23](图2)。经P4处理的hTERT-HM细胞可快速诱导IκBα的表达,并抑制由IL-1β诱导的COX-2表达[23]。P4/PR进一步的抗炎作用主要是通过有丝分裂原活化蛋白激酶1(MAPK-1)抑制剂双特异性磷酸酶1(dual-specificity phosphatase 1,DUSP1)的上调来介导[27],即通过抑制MAPK信号通路来抑制NF-κB和AP-1的活化[28]。
2.2 P4/PR通过募集共抑制因子抑制炎症前转录因子活性和CAP基因表达
为了明确P4抑制子宫内膜促炎性作用和CAP基因表达的机制,Chen等[4]分析野生型孕酮受体(PRWT)和各种突变体孕酮受体与孕酮结合后,在hTERT-HM细胞中抑制相关基因能力的表达。这些过程包括一个SUMO化突变、一个防止PR二聚化的铰链结构域突变,以及DNA结合结构域(DBD)中3个氨基酸的突变。其中PR-DBD的突变可以阻止P4对前炎症基因的抑制。因此,与表达PRWT的细胞相比,在稳定表达PR-A或PR-B DNA结合域突变体(PRmDBD)的细胞中,P4介导的反式抑制显著降低。对hTERT-HM细胞的免疫共沉淀(ChIP)分析显示,P4/PRWT抑制活性在COX-2和IL-8的启动子上与P4诱导PR募集和抑制NF-κB p65以及RNA Pol Ⅱ募集到的NF-κB上反应元件有关。重要的是在P4处理后,PRWT与PRmDBD均募集至COX-2和IL-8启动子。这表明P4/PR对COX-2和IL-8表达的抑制作用不是通过直接结合DNA来介导的,而可能是通过与NF-κB形成共抑制子来介导的。因此推测核蛋白与PR-DBD相互作用可能介导P4/PR的转录抑制。Chen等[4]对使用ChIP获取的蛋白进行质谱分析,鉴定了与PRWT相互作用较强而与PR-DBD突变体相互作用较弱的蛋白质,如含2B的GATA锌指结构域(GATAD2B)的转录阻遏物,它与PR-DBD的相互作用是P4/PR抑制前炎症反应和CAP基因表达必需的。经过P4处理后PRWT hTERT-HM细胞增加内源性GATAD2B向COX-2和IL-8启动子募集的效率,用siRNA敲除GATAD2B则显著降低P4-PRWT对COX-2和 IL-8 的转录抑制。值得注意的是,在分娩过程中,妊娠母鼠和人子宫肌层GATAD2B的表达显著下降。总之GATAD2B在妊娠期间可作为P4/PR抑制促炎反应和CAP基因表达的新介体。因此,短期内GATAD2B表达下降可能导致PR功能丧失,从而导致分娩。
妊娠子宫肌层中的前炎症刺激对CX43表达的诱导部分是由AP1家族成员(包括Fos/Jun异二聚体或Jun/Jun同型二聚体)的转录活性增加介导的(图3)。Mitchell等[29]发现与相对较弱的Jun/Jun同型二聚体相比,Fos/Jun异二聚体是CX43表达的强诱导剂。Nadeem等[30]发现P4与PR-B结合后,在CX43启动子上募集无活性的Jun/Jun同型二聚体以及p54nrb/Sin3A/HDAC形成共抑制子来抑制CX43表达。有研究表明子宫肌层中20α-羟类固醇脱氢酶(20α-HSD)会增加P4的代谢[31],并且由炎症引起的PR-A/PR-B比值增加[2,32-33]而出现大量游离的PR-A配体。而这些游离的PR-A配体与P4结合后募集相对活跃的Fra2/JunD异二聚体[29-30],从而激活CX43表达。
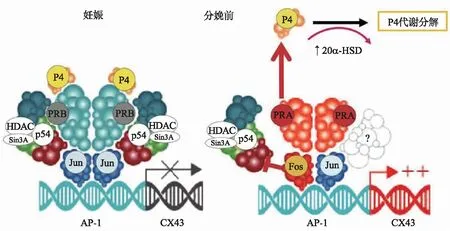
图3 分娩前后P4/PR对Cx43转录的调控[29]Fig.3 Regulation of CX43 transcription by P4/PR during pregnancy and labour[29]
2.3 P4/PR通过诱导上调CAP基因转录阻遏物ZEB1/2和STAT5b的表达维持肌层静止
2.3.1 ZEB1/2和miRNAs在P4/PR功能性阻断引发分娩过程中发挥重要作用Renthal等[34-35]的研究表明,P4/PR可以通过诱导锌指结合E-box的转录抑制物ZEB1/TCF8/dEF1保持肌层静止。它们不仅是miR-200家族成员的靶基因,也与CAP基因CX43以及OXTR的启动子结合抑制其表达。miR-200的下调促进ZEB1和相关转录因子ZEB2/SIP2的进一步上调(图4)。Spoelstra等[36]发现ZEB1在小鼠子宫肌层中高表达,并被P4/PR上调。此外Renthal等[35]还观察到ZEB1和ZEB2的表达在交配后15.5 d妊娠小鼠的子宫肌层组织中升高,并随着循环P4和PR功能的下降而急剧下降。使用RU486或细菌内毒素脂多糖(LPS)处理妊娠小鼠能够诱导早产,并且显著抑制ZEB1/2的表达。与足月未分娩的小鼠子宫肌层组织相比,分娩子宫肌层中ZEB1和ZEB2的水平也降低。对怀孕的小鼠子宫肌层的ChIP-qPCR分析表明,内源性ZEB1以相对较高水平结合到小鼠CX43和OXTR启动子的E-box含区,在交配后15.5 d妊娠时显著下降。重要的是,ZEB1在人hTERT-HM细胞中的过度表达显著抑制了OXTR和CX43mRNA的表达,并通过体外收缩试验证明其阻断了催产素诱导的细胞收缩[35]。因此,ZEB1表达的减少和与CAP基因启动子的结合可能会促进OXTR和CX43的上调并导致分娩。
为了进一步评估P4对ZEB表达的影响,每天定时给交配后15.5~18.5 d妊娠的小鼠注射P4或生理盐水。与注射生理盐水的小鼠相比,P4处理组延迟分娩,引起ZEB1显著上调并抑制了子宫肌层CX43和OXTR基因的表达。P4对ZEB1表达的刺激作用是通过PR与ZEB1启动子内的反应元件的直接结合介导的,仅在基因转录水平上起作用。值得注意的是ZEB2并不受P4/PR的直接调控。ZEB1和ZEB2是序列高度保守的miR-200家族的靶向基因[37-40],它们的表达量在足月分娩时的小鼠和人子宫肌层显著增加,与ZEB1和ZEB2表达的下降有直接关系[35]。此外ZEB1和ZEB2还负调控miR-200表达。因此,ZEB1/2和miR-200存在于激素调节的负反馈回路中。因此,在怀孕期间升高的P4/PR会增加ZEB1的表达,从而抑制miR-200家族以及与收缩相关基因。miR-200表达减少进一步上调ZEB1,并增加ZEB2的表达。在母体接近分娩时循环中的P4和/或PR功能下降会导致ZEB1表达下调,进而导致miR-200家族上调,进一步抑制ZEB1和ZEB2。这会降低CAP基因的表达,导致子宫收缩力增加(图4)。
miR-200家族在妊娠期上调,与足月未分娩子宫肌层组织相比,保守的miR-199a/214簇在小鼠和人类[35,41]临近分娩时子宫肌层中均显著下调。由miR-199a-5p、miR-199a-3p和miR-214组成的miR-199a/-214 簇在ynamin 3基因(Dnm3os)的6 kb反义转录本中编码,该转录本在怀孕子宫肌层高水平表达[42]。Williams等[41]发现 E2对去卵巢小鼠子宫的miR-199a-3p/-214表达有抑制作用,而P4则有增强作用。由此可见这些相反的激素效应是由ZEB1介导的,它是由P4诱导增强并由E2抑制。ZEB1直接与miR-199a/-214启动子结合以激活其转录(图4),其中miR-199a-3p和miR-214都靶向COX-2mRNA。以上发现均揭示了ZEB1作为miR-200家族抑制剂和miR-199a/-214簇诱导剂的重要作用,P4功能性阻断和E2浓度增加则反向调节它们的下游功能(图4)。

图4 ZEB1、ZEB2和miRNAs介导P4/PR在妊娠和分娩前期对子宫肌层收缩力调控作用[34]Fig.4 Opposing actions of P4/PR on myometrial contractility during pregnancy and labor mediated by ZEB1,ZEB2 and miRNAs[34]
2.3.2 信号转导子和转录激活子STAT5b分娩前期P4在子宫肌层和子宫颈中的局部代谢增加会使PR功能下降,这对哺乳动物的分娩是至关重要的。Piekorz等[6]发现敲除20α-羟基类固醇脱氢酶(20α-HSD)基因的小鼠孕酮维持高水平,并表现出分娩时期延迟现象,说明20α-HSD在动物分娩过程中起到重要的调节作用。在足月孕妇的子宫肌层中,观察到P4与20α-二氢孕酮(20α-OHP)的比值显著降低,而后者是由20α-HSD产生的无活性的P4代谢产物。Williams等[31]研究发现miR-200直接靶向P4诱导的转录因子STAT5b,而后者是生殖组织中20α-HSD的负调控因子[6]。因此可推断在分娩期间小鼠和人子宫肌层中miR-200表达的上调与抑制STAT5b和诱导20α-HSD有关。与此相反,在整个妊娠的大部分时间里,P4水平升高会上调ZEB1并抑制子宫内膜中miR-200的表达;而在妊娠期间STAT5b的上调表达会抑制20α-HSD的表达以维持升高的内源性P4水平和肌层静止(图4)。
2.4 P4/PR可能通过诱导Caspase级联反应活化并降解CAP蛋白以维持肌层静息状态
Shynlova等[43]在大鼠的妊娠早期至中期子宫平滑肌细胞培养液中加入5-溴脱氧尿嘧啶核苷,再对增殖细胞核抗原(PCNA)染色后,发现子宫肌层细胞表现出较高增殖能力,而到了分娩前期17 日胎龄(足月为23 日胎龄)却急剧下降,并伴随着肥大性细胞的增加;在12~15 日胎龄的子宫平滑肌细胞中出现了显著的应激诱导的半胱天冬酶(Caspase)级联反应(即出现了裂解的Caspase 9、3、6和7)。所以,Caspase酶激活可能导致抑制肌层增生活性并促进向肥大和平滑肌细胞分化的转变。此外,Jeyasuria等[44]在妊娠小鼠12~15 日胎龄(足月为 19 日胎龄)子宫肌层,也观察到类似的Caspase级联激活的诱导变化。与空白组相比,胱天蛋白酶3的激活反应在P4处理组中尤为明显。Kyathanahalli等[45]报道,Caspase 3的激活伴随着一系列肌细胞收缩相关蛋白(CAP)如平滑肌α-和γ-肌动蛋白的裂解以及间隙连接蛋白CX43的下调表达。因此,可以认为P4/PR在怀孕期间维持肌层静止是通过其诱导Caspase级联反应和引起参与肌层收缩蛋白质降解而发挥作用。妊娠子宫肌层在妊娠晚期PR功能性阻断导致Caspase酶激活通路被抑制,使得CAP在细胞中积累。此外值得注意的是,Suresh等[46]研究发现子宫肌细胞中Caspase酶的激活还与内质网应激反应(endoplasmic reticulum stress response,ERSR)的诱导有关,而ERSR是可以通过其他生理或机械刺激来增强其作用的。
3 雌性哺乳动物P4/PR功能性阻断引起分娩启动的主要机制
P4对于妊娠的建立和维持是必不可少的[47]。Corner等[48-49]在19世纪20年代进行了开创性的工作,到50代由Csapo[50]提出了“孕酮阻断”假说。雌性哺乳动物妊娠期间血液中的孕酮水平主导着妊娠的内分泌环境,但孕激素的来源因物种而异。在某些物种(如小鼠、大鼠、兔子)中,孕酮是由母体黄体(corepus luteum,CL)合成的,而在其他物种(如绵羊)中,它是由胎盘合成的。此后,大量的临床、动物体内和体外研究结果都有力地支持了“孕酮阻断”假说。目前的共识是,孕酮对妊娠的建立和维持是必不可少的,抑制孕酮的产生和/或干扰/调节其在子宫肌层细胞中的活性会导致足月分娩或早产,该事件是分娩启动的关键性因素。随着研究的深入,已经认识到甾体激素影响靶细胞的分子机制和黄体酮促进肌层静止的机制,以及如何从功能上撤销其分娩阻断作用以引发人类分娩。现在很清楚雌性动物子宫肌层细胞中孕激素的作用主要是由该孕激素受体(PR)亚型PR-A和PR-B介导的,PR亚型作用的调节是功能性孕激素阻断的关键[51]。下面就引起孕酮功能性阻断的主要机制进行阐述和图示(图5)。
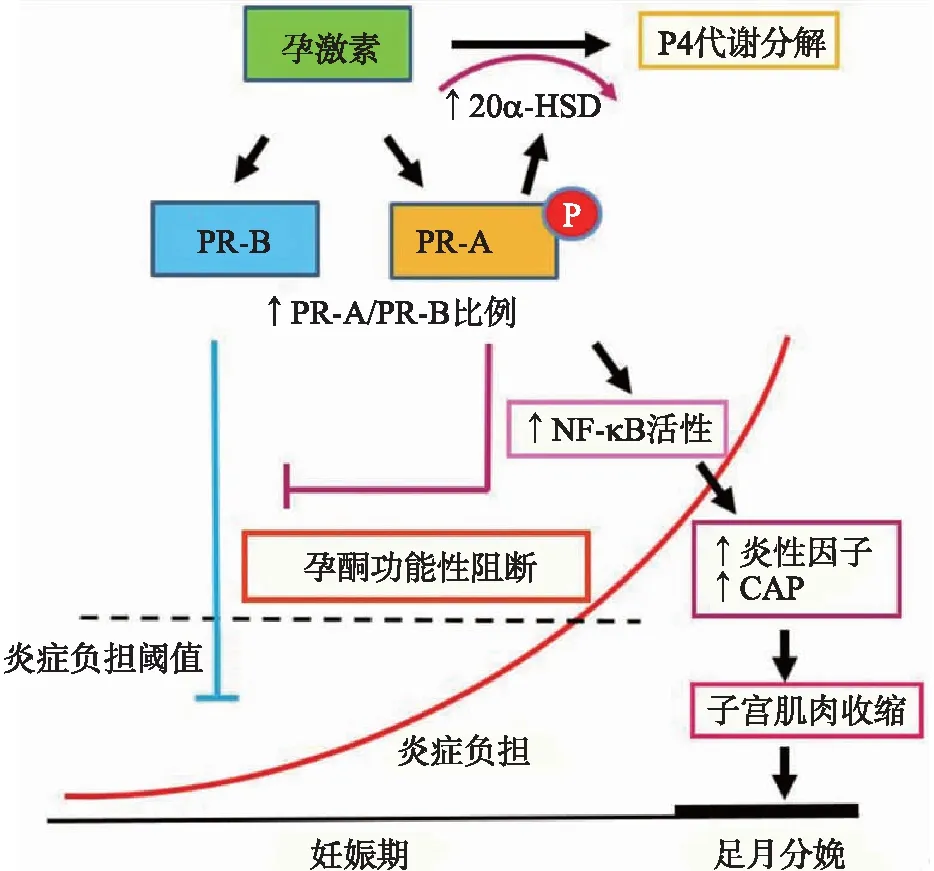
图5 雌性哺乳动物P4/PR功能性阻断引起分娩启动的主要机制Fig.5 The mechanisms for initiation of term parturition induced by P4/PR functional blockade in female mammals
3.1 子宫肌层细胞通过PR-A丰度的变化及其对PR-B的反式抑制转录活性来降低对P4的反应性
目前解释功能性黄体酮阻断的主要假设是基于PR-A对PR-B的相反式抑制转录活性。大多数孕酮反应性细胞中,包括子宫肌层细胞都表达两种PR同工型(PR-A、PR-B),PR-A和PR-B的净转录活性代表了对孕酮的反应。最初在使用人工启动子-报告基因检测的研究中,发现PR-B在大多数细胞中的转录活性均高于PR-A,并且PR-A会降低PR-B的转录活性(称为转录抑制)。这些发现引出PR-A/PR-B致功能性孕酮阻断的假说,认为在子宫内膜细胞中PR-A相对于PR-B的增加抑制了孕激素-PR的抗炎阻滞作用。后来的研究数据也表明足月女性分娩的发生与子宫内膜中PR-A相对于PR-B的增加有关[3,52-54],并且PR-A降低了孕激素诱导的PR转录和PR-A/PR-B假说支持肌层细胞培养物中的抗炎活性[25,32]。子宫肌层细胞中PR-A丰度和反式抑制活性的调节是功能性黄体酮阻断机制引起分娩的关键因素。
3.2 通过翻译后修饰调节PR的活性,调控抗炎和CAP基因等转录因子(如NF-κB和AP-1)的表达
Peters等[32]发现促炎性刺激增加了肌层细胞中PR-A的丰度和反式抑制活性。Amini等[33]发现促炎性刺激作用是通过诱导PR-A的位点特异性丝氨酸磷酸化来实现的。PR-A和PR-B的磷酸化是PR转录活性的细胞特异性和环境特异性调节机制,以调节靶细胞孕酮反应性[51]。Chen等[4]在稳定表达PR-A或PR-B的hTERT-HM子宫肌层细胞中,观察到与表达PR-B的细胞相比,P4在表达PR-A的细胞中的抗炎活性显著降低[4]。此外,炎症前刺激以P4依赖性方式增加了Ser344/345上PR-A同工型的磷酸化,并增强了其抑制PR-B的抗炎活性[33]。值得注意的是,在分娩和非分娩雌性子宫肌层中,Ser345的磷酸化仅发生在PR-A上。相对于总PR-A来说,分娩子宫肌层的磷酸Ser345-PR-A的丰度显著高于非分娩子宫肌层,并且这种磷酸化的PR-A有助于增加NF-κB的活化能力。
3.3 妊娠晚期子宫肌层PR抗炎活性的转录共抑制子减少
靶基因表达的P4/PR活化取决于共活化复合物的募集,该复合物含有引起染色质结构解开的组蛋白乙酰转移酶[55-56]。Condon等[57]的研究表明分娩前的雌鼠子宫肌层中环磷酸腺苷反应元件结合蛋白(cAMP-response element-binding protein,CREB)和类固醇受体共激活因子(steroid receptor coactivator,SRC)的表达急剧下降,显著低于妊娠期雌鼠子宫肌层组织中的表达量。值得注意的是,对妊娠晚期孕鼠注射曲古抑素A(一种特异性组氨酸去乙酰化酶抑制剂)可增加组蛋白乙酰化,并将分娩启动延迟24~48 h,表明组蛋白乙酰化在雌鼠分娩启动中发挥重要作用。在含HDAC抑制剂培养的人子宫肌层细胞的研究中,促炎基因下调表达,并强烈抑制了人子宫肌层的收缩性[58-59]。上述研究表明,妊娠后期子宫肌层中PR共激活因子的表达降低和组蛋白乙酰化可能会削弱P4/PR上调维持子宫肌层静止基因的能力,并增加子宫对前列腺素和其他收缩因子的敏感性。Leitet等[60]在培养人肌细胞中发现TNFα抑制SRC-1和SRC-2的表达,引起PR-B转录活性降低。因此,短期内子宫肌层中共激活因子的减少可能是由诱导前炎症介质引起的。此外,与PR相互作用并介导其抑制促炎症和CAP基因表达的GATAD2B[4]和p54nrb(non-POU-domain-containing octamer binding protein,不含POU域八聚体结合蛋白)[61]等共抑制因子在分娩前孕鼠子宫肌层减少,也将进一步导致PR功能下降。
3.4 P4在子宫肌层和子宫颈中的代谢水平增加导致PR功能下降和分娩
在大多数雌性动物的卵巢黄体和胎盘产生大量孕酮,维持整个妊娠过程血浆中较高的孕酮水平[62],同时妊娠期间子宫肌层中PR高水平表达可保证孕酮激素的正常功能[5]。而在妊娠后期雌性动物子宫肌层中的孕酮与20α-二氢孕酮(20α-OHP)的比例显著降低。小鼠分娩的启动伴随着P4代谢酶表达的增加,如子宫中20α-HSD的表达[31]和子宫颈中5α-还原酶Ⅰ型的表达。即使母体血浆中的P4水平正常下降,敲除Ⅰ型5α-还原酶基因的小鼠也会因子宫颈成熟度不足而无法完成分娩。同样,20α-HSD基因敲除小鼠表现出严重的分娩延迟[7,63]。因此,短期内子宫和子宫颈中P4的局部代谢增加导致PR功能下降,并且对于分娩的启动起着重要影响。
4 结论与研究展望
4.1 妊娠期间,P4/PR在维持肌层静止中的关键作用主要是由其抑制炎症途径和抑制CAP基因表达的能力介导
在整个妊娠期间P4/PR在维持肌层静止中的关键作用主要是由其抑制炎症途径和抑制CAP基因的表达能力介导的,主要是通过几种合作机制发生的(图2)。这些机制包括:P4/PR通过与促炎基因和CAP基因启动子内NF-κB反应元件(NF-κB PRE)结合的NF-κB p65结合,募集不同的共抑制子发挥抗炎和抑制收缩的作用。P4/PR通过与AP-1转录因子(Jun/Jun同源二聚体)结合,通过与转录共抑制因子p54/Msin3A相互作用,并将其招募到AP-1共有结合位点,介导Cx43的转录抑制。
P4/PR通过与IκBα和MKP-1启动子结合并增强其表达,它们在子宫肌层抑制NF-κB活化、CAP基因表达和促炎症。P4/PR的升高还上调了转录因子ZEB1的表达,该转录因子ZEB1与OXTR和CX43基因的启动子直接相互作用,抑制其表达并抑制miR-200家族的表达。miR-200表达的降低导致其靶标STAT5b(20α-HSD的转录抑制剂)上调,从而防止子宫肌层中的P4代谢增强。增加的ZEB1还上调了直接靶向COX-2的miR-199a/-214簇成员的表达,从而抑制收缩性前列腺素的合成(图2、4)。P4/PR通过活化Caspase级联反应降解收缩性蛋白,起到维持子宫肌层静息的作用。
4.2 妊娠后期各种因素导致PR功能性阻断是子宫肌层从静息状态向活化状态转变的关键信号
在母体和胎儿的共同信号作用下会引起足月妊娠子宫肌层向炎性收缩状态的转变(图1)。这些活化的免疫细胞然后迁移到母体子宫,通过激活NF-κB和AP-1而促进炎症反应,导致PR功能下降,并在子宫内膜中增加炎症原和CAP基因的表达(图1)。目前,引起子宫肌层PR功能性阻断主要由以下因素介导:炎症诱导的PR-A相对于PR-B表达丰度增加,并对PR-B的转录活性产生反式抑制作用;ZEB1的表达降低并协调诱导miR-200家族表达,导致STAT5b的抑制,20α-HSD的上调和P4的局部代谢的增加;NF-κB p65与PR的直接相互作用;PR共激活因子的下降。此外,ZEB1的下降还有助于OXTR和CX43的上调,并通过诱导靶标COX-2和PGF2α的合成来降低miR-199a/-214的表达。妊娠晚期子宫肌层中E2的增加会激活ERα,而这会引起子宫肌层出现炎症前反应和CAP基因表达的增加。这部分作用主要是通过抑制ZEB1/2和降低miR-181b的表达来介导的,上调ERα、肿瘤坏死因子α(Tumor necrosis factor α,TNFα)以及c-FOS等靶基因。这些高度协调的分子事件、子宫肌层扩张增加以及PR共表达的下调,最终导致子宫肌层收缩力增加从而引起分娩。通过上面对孕期子宫肌层静息及其在分娩前转变为活化状态机制的阐述不难看出,P4及其受体在此过程中起到了关键作用,可为我们进一步研究人类及生产性动物分娩启动提供有益的参考。
4.3 展望
早产导致大量新生儿发病和死亡,是目前亟待解决的重要社会问题。通过上面对孕期子宫肌层静息及其在分娩前转变为活化状态机制的阐述可以看出,P4及其受体在此过程中起到了关键作用,我们希望将这些研究结果应用于预防早产药物的开发。在维持子宫肌层静息状态的同时,产生更多非代谢性孕激素,或者是通过抑制炎症途径,以防止早产高危孕妇的子宫肌层活化。进一步研究免疫调节剂在抑制子宫肌层炎症反应过程中的作用,并对高危孕妇的早产风险进行重新评估。此外对孕酮功能阻断机制如miRNA簇信号分子作用途径的研究,不仅可为人类开发新的靶向性药物来预防早产提供理论依据,也可为精确调控生产性哺乳动物分娩时间和缩短产程提供新的药物处理方案。
