一Peutz-Jeghers 综合征家系致病位点分析及产前基因检测
2021-07-22赵亚松吕远李闯张志涛陈浩暘
赵亚松,吕远,李闯,张志涛,陈浩暘*
Peutz-Jeghers 综合征(Peutz-Jeghers syndrome,PJS)又称为家族性黏膜皮肤色素沉着胃肠道息肉病,简称为黑斑息肉综合征,是一种罕见的常染色体显性遗传病,其发生率在新生儿中约为1/50 000-1/200 000[1-2]。PJS主要的临床表现为口唇、黏膜等皮肤特定部位散在的色素沉着斑及多发性胃肠道息肉,部分PJS患者也存在有胆囊、支气管、膀胱等肠道外位置的息肉[3-4]。PJS患者经常并发多种相关疾病如肠道出血、肠套叠及肠梗阻等,同时罹患多种肠道及肠外肿瘤的风险较正常人也大大增加,有研究显示其中最常见的肿瘤是结直肠癌,其次为乳腺癌、小肠癌、胃癌及胰腺癌等[5]。PJS主要由STK11基因突变引起,该基因定位于染色体19p13.3,由10个外显子组成,编码区全长为10kb,编码丝氨酸/苏氨酸基因家族成员,其生物学功能十分复杂。
本研究对一临床表现为PJS的家系患者进行遗传学检测,明确其致病基因位点,并根据结果对先证者妻子进行羊水基因检测,为其后续的诊疗提供依据。
1 对象与方法
1.1 研究对象
先证者就诊于中国医科大学附属盛京医院妇产科,临床诊断为PJS患者,先证者发病年龄为12岁,临床特征为面部、嘴唇、指趾散在黑色素沉着斑点,肠镜检查发现多发大肠及小肠息肉并经手术切除(见图1)。询问家族史发现其父亲也有相似症状,但已经去世。先证者妻子已妊娠,就诊于本院产科遗传咨询门诊并进行羊水穿刺。本研究取得先证者及其家属知情同意,并通过本院伦理委员会论证。

图1 先证者面部、嘴唇散在黑色素沉着斑点
1.2 方法
1.2.1 全外显子检测及Sanger测序验证 抽取先证者外周血2 mL并经EDTA抗凝作为检测样本,使用DNA提取试剂盒(中国天根公司)提取外周血白细胞基因组DNA。将基因组DNA打断片段化并制备文库,使用高通量测序技术进行全外显子检测筛查可疑突变位点,并结合先证者临床表型分析,挑选出与患者临床特征相关的基因突变位点。针对可疑致病位点进行引物设计,并对相应基因组DNA区域进行聚合酶链式反应(Polymerase Chain Reaction,PCR)扩增,扩增结束后对产物进行纯化定量,使用ABI3130xl测序仪进行Sanger测序验证。检索ClinVar、HGMD、OMIM、Pubmed等数据判断该基因突变位点是否为已知致病性变异,并通过ACMG遗传变异分类标准与指南[6]对该突变位点进行分类。
1.2.2 孕中期羊水检测及Sanger测序 于先证者妻子孕中期行羊膜腔穿刺抽取羊水20 mL作为检测样本,提取羊水中胎儿游离DNA并进行纯化。针对与先证者一致的基因突变位点设计引物,使用PCR核酸扩增仪对目的基因片段进行扩增,并将获得目的基因片段序列与人类正常基因组序列进行比对,明确胎儿是否携带有与先证者一致的基因突变位点。
2 结果
2.1 先证者全外显子组测序结果
结合先证者临床表型分析,先证者携带 STK11 基因 c.95delC (p.Thr32fs)杂合突变(见图2),为移码突变。通过比对该位点突变在 ClinVar 数据库有收录,在 HGMD 数据库中记录为致病性变异;在 ExAC 数据库、gnomAD 数据库等东亚正常对照人群中无记录。根据 ACMG 致病变异分级标准[6],判断该位点为致病性。

图2 先证者全外显子测序结果
2.2 先证者 Sanger测序结果
提示与高通量测序结果一致,进一步明确先证者携带STK11 基因 c.95delC (p.Thr32fs)杂合突变(见图3)。
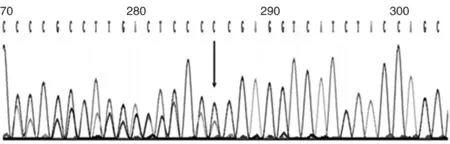
图3 先证者Sanger测序结果
2.3 先证者妻子羊水检测结果
先证者妻子羊水检测结果提示胎儿携带有与先证者一致的基因突变位点即STK11 基因 c.95delC (p.Thr32fs)杂合突变(见图4)。
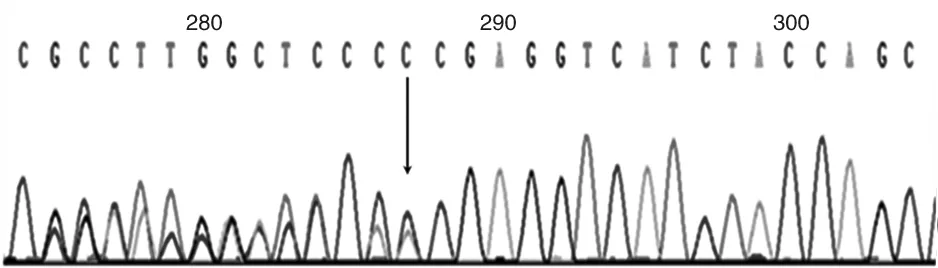
图4 先证者妻子羊水检测结果
3 讨论
PJS作为罕见的遗传性疾病,其诊断主要依赖于患者的临床特征及遗传学检测。为了更好地在临床上识别出PJS患者,临床诊断标准如下,当患者符合下列任一条件时即可被临床确诊为PJS:① 经病理诊断明确的2个或2个以上的PJ息肉;② 任意数目的PJ息肉结合PJS家族病史;③ 典型的皮肤黏膜色素沉着斑结合PJS家族病史;④ 任意数目的PJ息肉结合典型的皮肤黏膜色素沉着斑[7-8]。该家系先证者临床特征为面部、嘴唇、指趾散在黑色素沉着斑点,肠镜检查发现多发小肠息肉,并且先证者父亲亦有相似症状,符合PJS的临床诊断。基于目前的基因检测水平,STK11基因突变被认为是PJS的主要致病原因,然而其基因变异类型是否与PJS的临床异质性相关尚无明确解释,Amos等[9]经研究认为STK11基因无义突变患者可能相较于其他变异类型患者临床症状迟发。Mehenni等[10]发现基因突变发生于STK11第6个外显子可能导致PJS患者具有更高的癌症发生率。而Hearle等[11]基于419例PJS患者的临床研究表明不同的基因变异类型并不导致PJS患者具有更高的癌症发生风险,因此针对PJS的临床型-基因型相关性仍有待进一步研究确认。
STK11基因生物学功能十分复杂。STK11可通过G1细胞阻滞、WAF1信号及p53介导的细胞裂解来调控细胞增殖[12-13]。并且在调节细胞极性、细胞增殖及能量平衡等方面也起着重要作用,STK11作为AMP活化蛋白激酶上游调节因子,可进一步作用于TSC及mTOR信号通路[14-15]。因此当STK11蛋白失去功能时将导致息肉甚至癌症的发生。
本研究中先证者经临床诊断为PJS,遗传学检测结果提示其携带STK11基因c.95delC (p.Thr32fs)杂合突变,为移码突变,导致蛋白编码在32位苏氨酰胺处发生改变,并在新阅读框的3位过早产生终止密码子,导致产生截短蛋白,预测蛋白质功能丧失,从而导致患者临床表型的发生。同时经Sanger测序验证结果提示其胎儿携带与先证者相同的基因突变位点,为孕期的诊疗提供了证据。充分知情同意后,该家庭选择终止妊娠,引产后胎儿皮肤未见任何色素沉着斑。该家系选择再次妊娠,鉴于PJS为常染色体显性传染病,其后代患病率为50%,因此建议其可选择辅助生殖并经胚胎植入前遗传学检测选择正常胚胎植入子宫从而获得健康后代。或选择经正常方式妊娠,但应于孕中期常规进行有创产前检测如羊膜腔穿刺检查或绒毛膜活检明确胎儿是否携带有STK11基因c.95delC(p.Thr32fs)致病变异。
本研究通过临床表型分析及遗传学检测明确了一PJS家系致病原因,为该家系的产前基因检测及遗传咨询提供了依据,并进一步补充了表型谱与基因变异数据库,加强了该病的表型与基因型的联系。
