丘脑底核电刺激对6-羟基多巴胺致帕金森大鼠黑质神经元线粒体神经的保护作用及其机制
2021-07-16隋云鹏
陈 宁,隋云鹏,阎 娜
(1首都医科大学附属北京天坛医院神经外科,北京 100070;2北京大学首钢医院神经内科;*通讯作者,E-mail:yannacn@163.com)
帕金森病(Parkinsin’s disease, PD)是一种进行性的神经退行性疾病[1],而脑深部电刺激(deep brain stimulation,DBS)是近十几年逐渐发展起来的一种外科治疗方法,被认为是运动障碍性疾病治疗领域内的一个重要的里程碑,丘脑底核(subthalamic nucleus, STN)是目前DBS治疗PD的首选治疗靶点[2]。既往基础及临床研究[3-6]提示STN-DBS对黑质多巴胺神经元可能具有神经保护作用,但是具体保护机制仍不明确。本研究拟建立PD大鼠模型并植入大鼠电刺激器,利用免疫组化、透射电子显微镜及免疫印迹等技术手段,观察STN-DBS对黑质线粒体形态、功能及线粒体相关凋亡蛋白影响,探讨STN-DBS对6-OHDA引起的黑质线粒体损伤的保护作用及机制。
1 实验方法
1.1 帕金森大鼠模型的建立
选取体质量250-300 g健康雄性SD大鼠(购于中国军事医学科学院动物中心)32只,随机分为4组(每组n=8):对照组、模型组、假刺激组和电刺激组。对照组大鼠左侧前脑内侧束仅注射等剂量生理盐水;模型组大鼠左侧前脑内侧束多点注射6-OHDA;假刺激组大鼠左侧前脑内侧束多点注射6-OHDA并于模型建立1月后植入STN刺激电极,但不进行电刺激;电刺激组大鼠左侧前脑内侧束多点注射6-OHDA并于模型建立1月后植入STN刺激电极同时进行高频电刺激2个月。将SD大鼠用10%水合氯醛(0.4 ml/100 g)腹腔注射进行麻醉,麻醉成功后将大鼠固定在脑立体定位仪上,参照Paxinos和Watson大鼠脑立体定位图谱[7],确定左侧前脑内侧束靶点(前囟后3.5 mm,向左旁开0.5 mm,硬脑膜下9.0 mm和前囟后4.4 mm,向左旁开1.5 mm,硬脑膜7.8 mm),向左侧前脑内侧束多点注射6-OHDA(用含0.2%的抗坏血酸的生理盐水溶解6-OHDA)2.5 μl、3.0 μl,每侧注射时间5 min,留针10 min,缓慢退针。所有操作均在无菌条件下进行,皮肤切开处用青霉素抗菌,缝合伤口。阿扑吗啡诱发实验:给予阿扑吗啡0.2 mg/kg肌肉注射,注射后观察3 h,记录旋转总次数和每分钟旋转的圈数。平均旋转圈数>7圈/min,认为PD大鼠模型建模成功。
1.2 STN电刺激
PD模型建立1个月后,电刺激组及假刺激组于左侧STN坐标处[7](前囟后3.8 mm,中线向左旁开2.5 mm,硬脑膜下7.6 mm)植入刺激电极,电刺激组给予持续电刺激,假刺激组仅植入电极而不给予刺激。刺激参数为:电压2.0 V,频率130 Hz,脉宽60 μs。
1.3 酪氨酸羟化酶(TH)免疫组化检测大鼠黑质中TH阳性神经元数
3个月后实验动物处死后取脑,标本经冰冻切片,进行多巴胺神经元(TH)免疫组化染色(ABC法)。切片放入烤箱中60 ℃ 30 min,0.01 mol/L PBST浸洗3次,5 min/次;5%羊血清封闭抗原60 min,放入0.01 mol/L PBST稀释TH(1 ∶10 000),室温过夜;0.01 mol/L PBST浸洗3次,5 min/次;入1 ∶300稀释的生物素标记的山羊抗小鼠IgG 2-3 h,37 ℃;0.01 mol/L PBST浸洗3次,5 min/次;入1 ∶300稀释的辣根过氧化物酶标记的链霉卵白素三抗2-3 h,37 ℃;0.01 mol/L PBST浸洗3次,5 min/次;浸入配好的DAB显色液中显色10-30 min。每只大鼠各取黑质相同部位3张,通过Nikon显微镜采集图像,用NIS-Elements图像分析系统进行分析,根据灰度值选取TH阳性细胞,计算黑质区域TH阳性细胞数目。
1.4 透射电镜观察黑质线粒体结构
标本用2%多聚甲醛-2.5%戊二醛固定4 ℃ 2 h;二甲砷酸钠缓冲液(pH7.2)冲洗,10 min×3;1%锇酸(OsO4)固定2 h;双蒸水冲洗10 min×3;梯度酒精脱水,50%酒精10 min,70%酒精过夜;90%酒精10 min,100%酒精15 min×2;环氧丙烷置换15 min;室温下环氧丙烷 ∶树脂1 ∶1,1 h,环氧丙烷 ∶树脂1 ∶4,1 h,纯树脂浸透2 h,环氧树脂Epon812包埋;聚合:35 ℃ 16 h;45 ℃ 8 h,55 ℃,14 h;65 ℃,48 h;包埋块修整;1 μm半薄切片,天青一美兰染色,光学显微镜定位;醋酸双氧铀/枸橼酸铅染色,Hitachi H-7650透射电子显微镜观察。
1.5 Western blot检测线粒体相关凋亡蛋白
线粒体及胞浆成分的提取:分离中脑黑质组织剪碎,按照线粒体/胞浆细胞组分提取试剂盒(Biovision)操作说明进行线粒体及胞浆成分的提取。取适量线粒体和胞浆成分分别加入10 μl裂解缓冲液中。将裂解液放在冰上孵育30 min,然后再超声破碎两次,在4 ℃下以12 000 r/min离心分离,收集上清液,蛋白质含量用Bradford方法测定。蛋白质样品用聚丙烯酰胺凝胶电泳。随后转移至硝酸纤维素膜。将膜孵育在新鲜的封闭缓冲液中,室温30 min,然后用一抗Cyto-C(1 ∶1 000)、AIF(1 ∶1 000)、Caspase-3(1 ∶1 000)、Caspase-9(1 ∶1 000)孵育,4 ℃过夜,PBS/Tween 20洗涤3次,加入辣根过氧化物标记的羊抗鼠或羊抗兔IgG抗体,室温下与杂交膜孵育2 h,PBS/Tween 20洗膜,ECL发光液进行化学发光检测,Gel-Del凝胶成像系统扫描分析处理。
1.6 统计学方法
所有计量数据均采用均数±标准差表示,应用SPSS20.0软件进行数据分析,采用方差分析方法分析各组之间的差异,进一步两两比较采用SNK-q法,以P<0.05为差异有统计学意义。
2 结果
2.1 行为学检测结果及STN电刺激对PD大鼠脑组织内TH表达的影响
模型建立1个月后,经APO诱导后,正常对照组无明显旋转现象,而模型组、假刺激组及电刺激组旋转圈数与正常对照组相比明显增多(P<0.05)。电刺激治疗2个月后,电刺激组大鼠旋转圈数与模型组相比明显减少(P<0.05),而假刺激组大鼠旋转圈数与模型组相比无明显减少(P>0.05)。与模型组相比,电刺激组黑质部位的TH阳性细胞明显增加(P<0.05),而假刺激组与模型组相比,大鼠黑质部位TH阳性细胞无明显增加(P>0.05,见图1)。上述结果表明,STN电刺激可以有效地缓解6-OHDA损伤所导致的大鼠脑组织损伤并改善大鼠的运动功能。
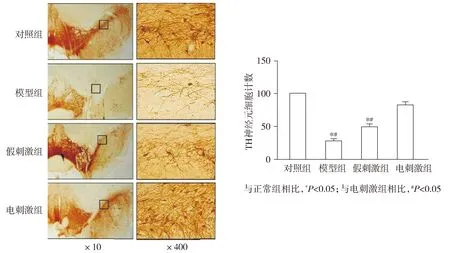
图1 STN电刺激对6-OHDA损伤模型动物中多巴胺神经元(TH)免疫组化分析Figure 1 The expression of nigral TH+ neurons after STN stimulation by immunohistochemistry
2.2 STN电刺激对PD大鼠黑质线粒体的影响
通过透射电子显微镜观察线粒体的超微结构变化,正常对照组的线粒体具有良好的圆形或者卵圆形线粒体结构,线粒体膜结构清晰、线粒体膜内嵴排列致密有序;模型组发现线粒体变得肿胀,线粒体内膜内嵴结构消失,结构紊乱,呈空泡样改变;电刺激组与模型组相比,线粒体结构整体比较完整,保留了有序排列的膜内嵴结构(见图2)。上述结果表明,STN电刺激可以缓解6-OHDA损伤所导致的大鼠脑组织黑质线粒体损伤。
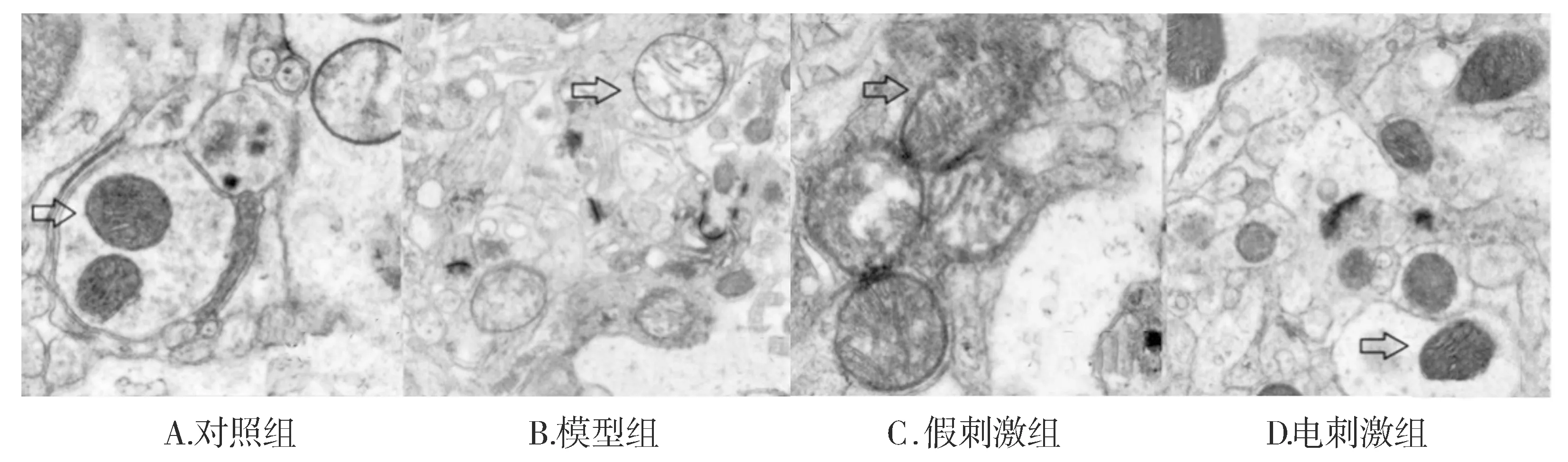
图2 透射电子显微镜观察各组黑质神经元线粒体损伤情况 (×3 000)Figure 2 The structure of mitochondria under transmission electron microscope (×3 000)
2.3 STN电刺激可以有效抑制6-OHDA损伤导致的线粒体凋亡物质的释放
Western blot初步研究结果表明:与正常对照组相比,模型组可见cleaved-Caspase-3、Caspase-9显著升高;而电刺激组与模型组相比6-OHDA所导致的cleaved-Caspase-3、Caspase-9的释放明显被抑制(P<0.05,见图3)。通过对线粒体及细胞浆中cyto-C、AIF的结果分析,我们发现模型组细胞浆中cyto-C、AIF含量与正常对照组相比明显升高,而电刺激组胞浆中cyto-C、AIF含量与模型组相比明显减少(P<0.05,见图4)。但是模型组体线粒体中cyto-C、AIF含量与对照组相比明显降低,电刺激组线粒体中cyto-C、AIF含量与模型组相比明显增加(P<0.05,见图4)。上述结果表明STN电刺激可以抑制线粒体中cyto-C、AIF等凋亡因子的释放,从而抑制细胞凋亡的发生发挥神经保护作用。
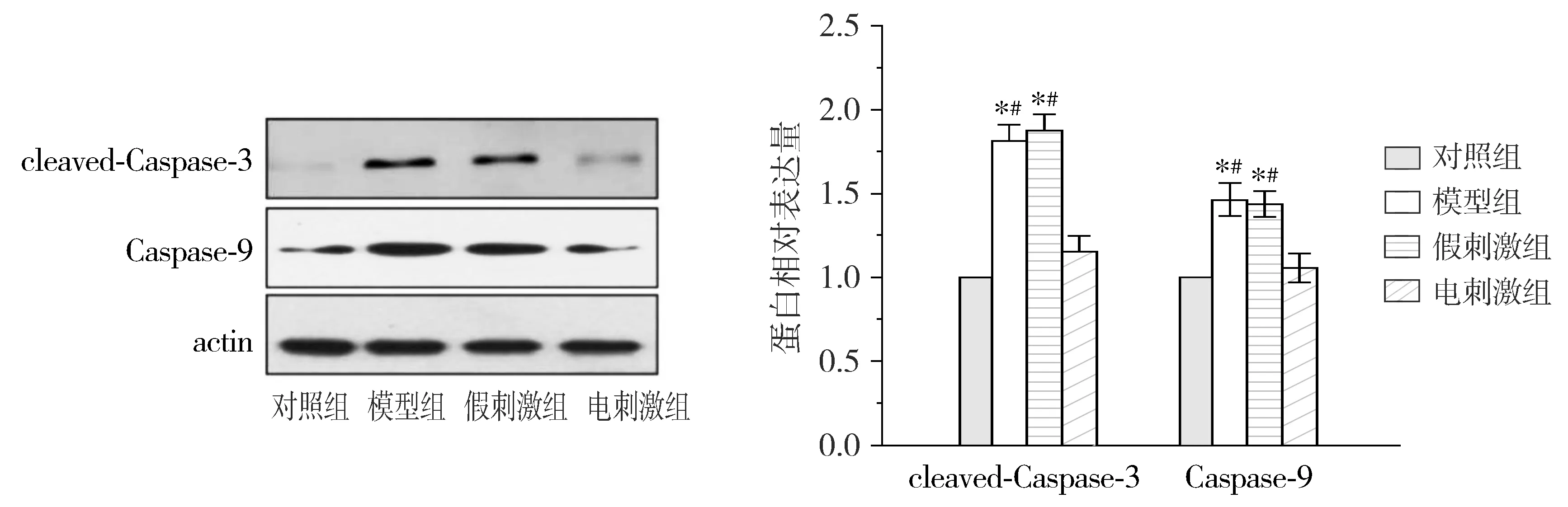
与正常组相比,*P<0.05;与电刺激组相比,#P<0.05图3 Western blot分析STN电刺激对6-OHDA损伤模型动物黑质神经元中cleaved-Caspase-3、Caspase-9表达Figure 3 Effect of STN stimulation on the expression of cleaved-Caspase-3 and Caspase-9 in 6-hydroxydopamince-induced Parkinson’s rats
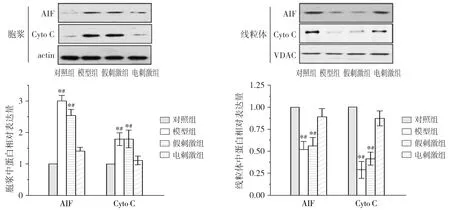
与正常组相比,*P<0.05;与电刺激组相比,#P<0.05图4 Western blot分析STN电刺激对6-OHDA损伤模型动物黑质神经元线粒体及胞浆中cyto-C和AIF含量Figure 4 Effect of STN stimulation on the mitochondrial release of AIF and cyto C in 6-hydroxydopamince-induced Parkinson’s rats
3 讨论
帕金森的病理表现主要是中脑黑质致密部多巴胺能神经元缺失变性,脑内多巴胺递质含量下降,从而导致基底节环路调节运动的功能发生障碍[8]。目前临床上治疗PD主要是以左旋多巴类药物治疗为主,然而药物替代治疗仅可以改善患者的一些临床症状,但不能减缓黑质神经元退行性变的进程,即不能阻止或逆转疾病的病程进展[9]。STN是目前DBS治疗PD的首选靶点,既往的临床研究及动物实验表明,DBS可能对PD有神经保护作用,减缓甚至阻止了病程的进展[3-6],但是STN-DBS对黑质多巴胺神经元保护作用的具体机制仍不明确,需要进一步深入、系统的研究。在本研究中我们通过TH免疫组化发现PD大鼠模型中脑黑质TH阳性细胞减少,证明6-OHDA可引起PD大鼠黑质神经元的丢失,而电刺激2个月后,电刺激组明显增加黑质区TH阳性细胞数,进一步证明了STN电刺激对PD大鼠黑质神经元具有一定的神经保护作用。
既往研究表明,PD黑质多巴胺能神经元的死亡不是坏死而是凋亡,且中脑黑质多巴胺能神经元细胞凋亡是PD发病的重要机制之一[10]。细胞凋亡是一种特殊细胞死亡过程,它是一个复杂的过程,其中线粒体被认为在细胞凋亡过程中起着重要的调控作用[11,12]。
线粒体不同空间分布不同的酶和生物因子,外膜上有Bcl-2蛋白家族蛋白及离子通道蛋白,膜间隙分布着cyto-C、AIF和procaspase3、9;内膜上则是电子传递链复合物的聚集部位等。在受到各种因素的刺激后,线粒体的跨膜电位下降甚至消失,线粒体基质会释放出致凋亡活性物质进入胞质,激活caspase级联反应引发细胞凋亡[13]。越来越多的研究表明,线粒体功能障碍在包括PD在内的神经退行性疾病发生中起重要作用[14]。本研究中,我们通过透射电子显微镜从形态学水平观察线粒体结构的结果发现,6-OHDA损伤后可致模型组大鼠黑质线粒体变得肿胀,线粒体内膜内嵴结构消失,结构紊乱,呈空泡样改变,提示线粒体功能障碍;电刺激组与模型组相比,可见线粒体结构整体比较完整,保留了有序排列的膜内嵴,提示STN电刺激可缓解6-OHDA对线粒体的损伤,具有保护线粒体的功能。而且Western blot初步研究结果表明:cyto-C、AIF在模型组细胞浆中明显升高,而电刺激组胞浆中cyto-C、AIF含量与模型组相比明显减少,但cyto-C、AIF在模型组线粒体中明显降低,电刺激组线粒体中cyto-C、AIF含量与模型组相比明显增加。并且模型组可见cleaved-Caspase-3、Caspase-9显著升高;而电刺激组与模型组相比cleaved-Caspase-3、Caspase-9的含量明显降低。这些结果表明STN电刺激可以通过保护线粒体的功能,从而抑制线粒体中cyto-C、AIF等凋亡因子的释放,进而抑制细胞凋亡的发生对黑质神经元产生神经保护作用。
综上所述,STN电刺激对6-OHDA诱导的帕金森大鼠具有神经保护作用,它可能是与抑制线粒体的途径的细胞凋亡有关,但是仍需要进一步深入研究。
