腹腔注射右旋糖酐铁对大鼠嗅球、黑质和纹状体区DAT蛋白表达的影响
2020-06-08温晓鸣谢俊霞宋宁
温晓鸣 谢俊霞 宋宁
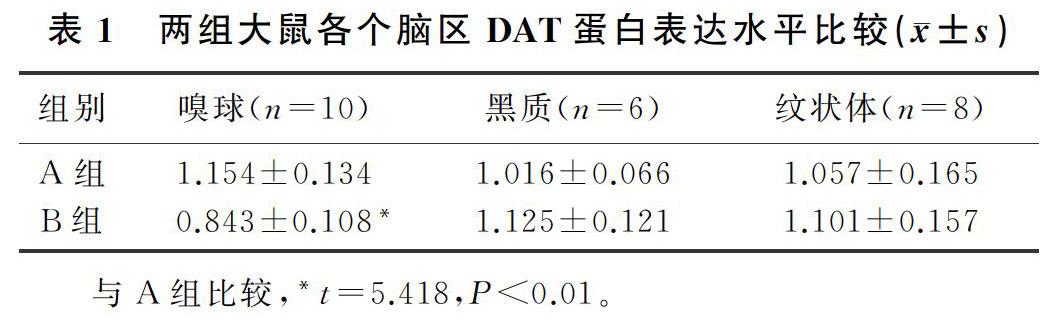
[摘要] 目的 研究腹腔注射右旋糖酐铁对大鼠嗅球、黑质和纹状体区多巴胺转运蛋白(DAT)蛋白表达的影响。方法 21 d离乳Wistar大鼠分别腹腔注射右旋糖酐铁(10 mg/d)和生理盐水,1周注射3次。1周后取大鼠嗅球、黑质和纹状体样本,采用免疫印迹法(Western blot)检测各脑区DAT蛋白表达情况。结果 与注射生理盐水组相比,注射右旋糖酐铁大鼠嗅球中DAT蛋白表达出现显著降低(t=5.418,P<0.01),而黑质和纹状体中DAT蛋白表达未发生明显改变(t=1.719、0.489,P>0.05)。结论 腹腔注射右旋糖酐铁1周后引起大鼠嗅球中DAT蛋白表达的显著下降。
[关键词] 铁右旋糖酐复合物;嗅球;黑质;纹状体;多巴胺质膜转运蛋白质类;大鼠,Wistar
[中图分类号] R338.2 [文献标志码] A [文章编号] 2096-5532(2020)02-0150-03
doi:10.11712/jms.2096-5532.2020.56.066 [开放科学(资源服务)标识码(OSID)]
[网络出版] http://kns.cnki.net/kcms/detail/37.1517.R.20200417.0915.009.html;2020-04-17 16:04
[ABSTRACT] Objective To explore the effect of intraperitoneal injection of iron dextran on the expression of dopamine transporter (DAT) protein in the olfactory bulb, substantia nigra, and striatum of rats. Methods Weaned Wistar rats aged 21 days were intraperitoneal injected with iron dextran (10 mg/d) or normal saline three times a week. One week later, the olfactory bulb, substantia nigra, and striatum were collected to analyze DAT protein expression in each brain region by immunoblotting (Western blot). Results Compared with the saline group, the rats injected with iron dextran had significantly reduced expression of DAT protein in the olfactory bulb (t=5.418,P<0.01), while the expression of DAT protein in the substantia nigra and striatum did not change significantly (t=1.719,0.489;P>0.05). Conclusion Intraperitoneal injection of iron dextran for one week can significantly decrease the expression of DAT protein in the olfactory bulb of rats.
[KEY WORDS] iron-dextran complex; olfactory bulb; substantia nigra; corpus striatum; dopamine plasma membrane transport proteins; rats, Wistar
帕金森病(PD)是一种常见的神经退行性疾病,其主要病理特征之一是黑质-纹状体系统多巴胺能神经元的进行性退变,纹状体多巴胺含量减少,导致机体运动功能障碍[1]。酪氨酸在酪氨酸羟化酶的作用下生成左旋多巴,之后又通過芳香族氨基酸脱羧酶的作用生成多巴胺。多巴胺可以通过囊泡释放到突触间隙,作用于相应的受体,突触间隙中的多巴胺也可以经多巴胺转运蛋白(DAT)被重新摄取到突触前神经元[2-4],从而维持多巴胺水平在突触间隙处于一种稳定状态。DAT介导的多巴胺重摄取可以增加细胞质中多巴胺的含量进而可能导致细胞损伤[5-6]。研究表明,在PD病人和PD动物模型中都有黑质致密区铁的选择性沉积[7-8]。大鼠腹腔注射右旋糖酐铁可以导致铁在黑质致密区的选择性沉积[9-10]。本研究的主要目的是在大鼠腹腔注射右旋糖酐铁1周后观察嗅球、黑质和纹状体中DAT蛋白表达的变化。
1 材料和方法
1.1 动物分组与处理
SPF级21 d离乳Wistar大鼠20只,购于北京维通利华公司,饲养于室温(21±2)℃、湿度(50±5)%、12 h/12 h昼夜循环光照环境下,可自由饮食。注射用右旋糖酐铁购自Sigma公司。本实验将大鼠随机分为注射生理盐水组(A组)和注射右旋糖酐铁组(B组),每组10只,分别注射生理盐水和右旋糖酐铁(10 mg/d),1周注射3次。
1.2 大鼠脑区样本提取
大鼠腹腔注射右旋糖酐铁或生理盐水1周后,断头取嗅球、黑质和纹状体样本,称量嗅球、黑质和纹状体样本净质量。
1.3 免疫印迹法(Western blot)检测DAT蛋白的表达
按照样本质量分别加入一定量的蛋白裂解液,充分超声研磨,以12 000 r/min离心25 min,采用BCA试剂盒检测蛋白浓度,加入Loading buffer后95 ℃水浴5 min,之后将蛋白样本进行聚丙烯酰胺凝胶电泳,并湿转到PVDF膜上,使用50 g/L的脱脂奶粉溶液室温摇床孵育2 h,用DAT(1∶1 000)和β-actin(1∶10 000)一抗4 ℃孵育过夜,再用山羊抗兔HRP-IgG (1∶10 000)二抗室温孵育1 h,利用ECL化学发光试剂显影。应用Image J软件进行条带灰度分析,目的蛋白的表达水平以目的蛋白与内参蛋白β-actin条带灰度值的比值来表示。
1.4 统计学分析
采用Prism 6软件进行数据的统计分析,所得计量资料数据以±s表示,组间比较采用t检验,P<0.05表示差异具有统计学意义。
2 结 果
与注射生理盐水组相比,注射右旋糖酐铁组大鼠嗅球中DAT蛋白表达出现显著降低(t=5.418,P<0.01),而黑质和纹状体中DAT蛋白表达未发生明显改变(t=1.719、0.489,P>0.05)。见表1。
3 讨 论
PD作为一种多发于中老年人群的神经退行性疾病,其主要发病因素包括遗传因素、环境因素、年龄等[1,11]。PD病人脑内纹状体多巴胺含量下降是其发病的重要原因。多巴胺作为一种神经递质,一方面可以通过囊泡释放到突触间隙作用于相应的受体,一方面本身易被氧化,可以与细胞内的铁作用生成有害物质,例如6-羟基多巴胺(6-OHDA)[5-6,12]。DAT介导的多巴胺重摄取可维持多巴胺水平在突触间隙处于一种稳定状态。去铁胺(DFO)是一种铁螯合剂,可以螯合细胞内的铁。有研究结果表明,DFO可以通过影响细胞内吞作用和DAT mRNA的稳定性而影响DAT的重吸收作用[13-14]。但是关于铁对DAT的调节却鲜有报道,故本研究通过腹腔注射右旋糖酐铁制备大鼠高铁模型,探讨铁对DAT蛋白表达的影响。
已有研究表明,PD病人纹状体囊泡摄取功能障碍可能导致多巴胺能神经元死亡[15],主要原因可能是囊泡摄取多巴胺的能力下降,导致细胞质中游离多巴胺的水平增加,多巴胺代谢副产物包括羟基自由基等物质可以对细胞造成损伤。DAT将多巴胺摄取至细胞内可能会增加多巴胺能神经元中多巴胺的含量,多巴胺氧化可产生6-OHDA和醌类等有毒物质[5],从而对多巴胺能神经元造成损伤;同时,DAT还可以将某些有毒物质摄取到细胞中[16]。1-甲基4-苯基-1,2,3,6-四氫吡啶(MPTP)可以被单胺氧化酶催化转变为1-甲基-4-苯基吡啶(MPP+),通过DAT进入细胞后可以造成线粒体功能障碍。DAT敲除小鼠可以抵抗MPTP的毒性作用[17],而DAT过表达小鼠对MPTP的毒性作用更敏感[18]。另外,可卡因及其类似物可以阻止DAT将多巴胺转运至细胞的过程,安非他命及其类似物可以翻转DAT转运多巴胺的过程,将细胞内的多巴胺转运至突触间隙[19],促使突触间隙的多巴胺含量增加。因此,DAT在多巴胺能神经元损伤的机制中具有非常重要的作用。
有研究结果表明,与正常人相比,PD病人黑质纹状体系统中突触前末梢和胞体中DAT表达均出现显著降低[20]。DAT的活性可以受到某些翻译后修饰的调节,例如磷酸化、泛素化和糖基化等,这些翻译后修饰主要影响DAT的转运动力学和在细胞中的分布,例如蛋白激酶C可以通过磷酸化作用促进DAT的内化[19],胞外信号调节激酶则可以上调DAT的表达水平和活性[21]。此外,有研究表明,在细胞模型中DFO可以降低DAT蛋白的表达和活性[13-14]。铁能够促进多巴胺氧化过程,铁和多巴胺反应生成的6-OHDA是线粒体复合体Ⅰ和复合体Ⅳ的抑制剂,可以导致线粒体功能障碍,从而减少ATP的产生,最终导致细胞的死亡;6-OHDA的代谢还可以产生过氧化氢,参与Fenton反应生成羟基自由基,导致DNA加合物的合成、脂质过氧化、质膜完整性的丢失以及凋亡等[5]。PD的非运动症状包括嗅觉减退,嗅觉减退出现的时间比运动症状出现的时间更早。有研究结果表明,在注射MPTP的食蟹猴嗅球中,多巴胺含量增加,而且嗅球多巴胺含量的增加并不依赖于黑质纹状体多巴胺能神经元的退变[22],另外也有研究在PD病人嗅球中发现多巴胺能细胞数量的增加[23],这可能是由于其他神经递质系统早期损伤所产生的代偿导致的。在本研究中,注射右旋糖酐铁大鼠嗅球中DAT蛋白表达水平出现明显降低,但是黑质和纹状体中DAT蛋白表达水平并未出现明显改变,其确切的机制还需要进一步研究探讨。
[参考文献]
[1] KALIA L V, LANG A E. Parkinsons disease[J]. Lancet (London, England), 2015,386(9996):896-912.
[2] MULVIHILL K G. Presynaptic regulation of dopamine release: role of the DAT and VMAT2 transporters[J]. Neurochemistry International, 2019,122:94-105.
[3] GEORGE R U. Dopamine compartmentalization, selective dopaminergic vulnerabilities in Parkinsons disease and therapeutic opportunities[J]. Annals of Clinical and Translational Neurology, 2019,6(2):406-415.
[4] MCHUGH P C, BUCKLEY D A. The structure and function of the dopamine transporter and its role in CNS diseases[J]. Vitamins and Hormones, 2015,98:339-369.
[5] HARE D J, DOUBLE K L. Iron and dopamine: a toxic couple[J]. Brain: a Journal of Neurology, 2016,139(Pt 4):1026-1035.
[6] SONG Ning, XIE Junxia. Iron, dopamine, and α-Synuclein interactions in at-risk dopaminergic neurons in Parkinsons di-sease[J]. Neuroscience Bulletin, 2018,34(2):382-384.
[7] OAKLEY A E, COLLINGWOOD J F, DOBSON J, et al. Individual dopaminergic neurons show raised iron levels in Parkinson disease[J]. Neurology, 2007,68(21):1820-1825.
[8] WANG Jun, BI Mingxia, XIE Junxia. Ceruloplasmin is involved in the nigral iron accumulation of 6-OHDA-lesioned rats[J]. Cellular and Molecular Neurobiology, 2015,35(5):661-668.
[9] JIANG Hong, SONG Ning, WANG Jun, et al. Peripheral iron dextran induced degeneration of dopaminergic neurons in rat substantia nigra[J]. Neurochemistry International, 2007,51(1):32-36.
[10] WANG Ran, WANG Youcui, QU Le, et al. Iron-induced oxidative stress contributes to α-synuclein phosphorylation and up-regulation via polo-like kinase 2 and casein kinase 2[J]. Neurochemistry International, 2019,125:127-135.
[11] PRZEDBORSKI S. The two-century journey of Parkinson di-sease research[J]. Nature Reviews Neuroscience, 2017,18(4):251-259.
[12] ZUCCA F A, SEGURA-AGUILAR J, FERRARI E A, et al. Interactions of iron, dopamine and neuromelanin pathways in brain aging and Parkinsons disease[J]. Progress in Neurobio-logy, 2017,155(SI):96-119.
[13] WIESINGER J A, JAMES P B, CHRISTOPHER J C, et al. Down-regulation of dopamine transporter by iron chelationin vitrois mediated by altered trafficking, not synthesis[J]. Journal of Neurochemistry, 2007,100(1):167-179.
[14] NARASIMHA V H, GORDON L J, ERICA L U. Iron chelation down-regulates dopamine transporter expression by decreasing mRNA stability and increasing endocytosis in N2a cells[J]. Experimental Cell Research, 2011,317(4):405-412.
[15] PIFL C, RAJPUT A, REITHER H, et al. Is Parkinsons di-sease a vesicular dopamine storage disorder? evidence from a study in isolated synaptic vesicles of human and nonhuman primate striatum[J]. Journal of Neuroscience, 2014,34(24):8210-8218.
[16] KELLY M L, SHABABA T M, ALI S, et al. Membrane transporters as mediators of synaptic dopamine dynamics: implications for disease[J]. European Journal of Neuroscience, 2017,45(1):20-33.
[17] BEZARD E, CHRISTIAN E G, MARIE-CHRISTINE F, et al. Absence of MPTP-induced neuronal death in mice lacking the dopamine transporter[J]. Experimental Neurology, 1999,155(2):268-273.
[18] MASOUD S T, VECCHIO L M, BERGERON Y, et al. Increased expression of the dopamine transporter leads to loss of dopamine neurons, oxidative stress and l-DOPA reversible motor deficits[J]. Neurobiology of Disease, 2015,74:66-75.
[19] CHRISTOPHER L G, MICHELLE G B, MCFADDEN L M, et al. Regulation of the dopamine and vesicular monoamine transporters: pharmacological targets and implications for di-sease[J]. Pharmacological Reviews, 2015,67(4):1005-1024.
[20] FAZIO P, SVENNINGSSON P, CSELNYI Z, et al. Nigrostriatal dopamine transporter availability in early Parkinsons disease[J]. Movement Disorders, 2018,33(4):592-599.
[21] ELIZABETH A B, BRONWYN K, JALIGAM V, et al. D2 receptors regulate dopamine transporter function via an extracellular signal-regulated kinases 1 and 2-dependent and phosphoinositide 3 kinase-independent mechanism[J]. Molecular Pharmacology, 2007,71(5):1222-1232.
[22] PIFL C, HARALD R, DEL REY N L, et al. Early paradoxical increase of dopamine: a neurochemical study of olfactory bulb in asymptomatic and symptomatic MPTP treated monkeys[J]. Frontiers in Neuroanatomy, 2017,11:46.
[23] IAKI-CARRIL M, MARIA-CRISTINA C, CRISTINA O, et al. Increased dopaminergic cells and protein aggregates in the olfactory bulb of patients with neurodegenerative disorders[J]. Acta Neuropathologica, 2011,122(1):61-74.
(本文編辑 马伟平)
