不同细胞标记物对大鼠牙髓干细胞体外标记的生物学影响
2021-07-16姬小婷李子夏唐成芳王丹杨
谢 娜,姬小婷,李子夏,唐成芳,陆 磊,王丹杨*
(1西安医学院口腔医学院口腔内科学教研室,西安 710021;2陕西中医药大学附属医院口腔科;3西安医学院口腔医学院口腔修复学教研室;*通讯作者,E-mail:kqwangdy@xiyi.edu.cn)
组织工程技术在临床中的应用是近年来很多学者研究的热点问题之一,由于干细胞具备多向分化的潜能,将干细胞移植在体内可用于机体各种组织修复以及组织再生,因而干细胞在临床中具有巨大的应用潜力[1-3]。
目前,利用干细胞进行活体移植后,干细胞在移植体内的归巢、分化机制是组织工程研究的重点问题,而对所移植的干细胞如何进行有效的标记以及示踪则是开展该项研究的前提[4]。
研究表明,氯甲基苯甲酰氨(氯甲基-1,1-十八烷基-3,3,3’,3’-四甲基-吲哚-羧花青-高氯酸盐,chlormethylbenzamido-1,1’-dioctadecyl-3,3,3’,3’-tetramethylin-docarbocyamine,CM-DiI)是一种亲脂性长链碳花青荧光染料,易与细胞膜结合[5,6]。4’,6-二脒基-2-苯基吲哚(4’,6-diamidino-2-phenylindole,DAPI)能透过细胞膜快速进入活细胞中与DNA相结合。因此二者均可用于多种活细胞的标记[7,8]。
由于不同种属、不同来源的细胞生物学性能有所不同,因此对标记物的敏感程度可能也存在着一定的差异。本实验旨在对比CM-DiI和DAPI这两种不同的细胞标记物对大鼠牙髓干细胞生物学性能的影响,为进一步的动物实验提供理论支持,以及为需要进行细胞标记以及示踪的实验研究提供理论参考依据。
1 材料和方法
1.1 材料
选取2个月龄健康的清洁级Sprague-Dawley(SD)大鼠20只,均为雄性,体质量为(250±20)g,由西安交通大学医学院动物实验中心提供。
DMEM/F12培养基、胎牛血清(Hyclone公司,美国);Ⅰ型胶原酶、Dispase酶(Gibco公司,美国);波形丝蛋白鼠来源单克隆抗体、角蛋白鼠来源单克隆抗体(上海生工生物工程技术服务有限公司,上海);地塞米松、吲哚美辛、丙酮酸钠、IBMX、β-甘油磷酸钠(Sigma公司,美国);CM-DiI、DAPI(Molecu-lar Probe公司,美国);乳酸脱氢酶(LDH)试剂盒(南京建成生物工程研究所,南京);CCK-8细胞毒性检测试剂盒(博士德公司,武汉);细胞培养箱(Thermo公司,美国);倒置相差显微镜(Nikon公司,日本)。
1.2 方法
1.2.1 大鼠牙髓干细胞原代培养与纯化 10%水合氯醛麻醉后脱颈处死大鼠,在超净工作台内劈开实验所用的牙齿,轻柔地取出大鼠的牙髓组织,将其浸泡在按1 ∶1比例混合的Ⅰ型胶原酶和Dispase酶中,用外科手术剪将牙髓组织均匀剪成0.5-1 mm3大小的组织块。随后将其转移至5% CO2、37 ℃的细胞培养箱中孵育45-60 min,孵育期间每15 min吹打一次消化液,直至组织块完全消化、溶解。将培养皿中的消化液转移至离心管中,1 000 r/min离心5 min后弃除上清液,加入PBS液重悬沉淀后,再1 000 r/min离心5 min,用此方法漂洗所得的沉淀物2次,用3-4 ml含15%胎牛血清的DMEM/F12培养基(培养基中加入100 U/ml青霉素,100 μg/ml链霉素和2 mmol/L的L-谷氨酰胺)重悬细胞沉淀,将全部液体转移至60 mm的培养皿中培养,待有细胞贴壁生长后首次换液,其后每2-3 d更换培养液一次,采用有限稀释法对所培养的细胞进行纯化。
1.2.2 细胞来源鉴定 取生长状态良好的第3代大鼠牙髓细胞,调整细胞密度为1×104个/ml,将其接种至预先装有酸处理过的普通盖玻片的12孔培养板中,用含10%胎牛血清的DMEM/F12培养基培养,倒置显微镜下观察细胞铺满盖玻片的70%-80%时,按照免疫组化SAB法对其进行角蛋白、波形丝蛋白染色,光学显微镜下观察、记录染色结果。
1.2.3 细胞多向诱导分化实验
1.2.3.1 成脂诱导分化 使用成脂诱导液(含浓度为0.5 mol/L的IBMX、0.25 μmol/L的地塞米松、10 μmol/L的吲哚美辛、L-谷氨酰胺2 mmol/L、L-抗坏血酸2-磷酸盐100 μmol/L的DMEM/F12培养基),对第3代大鼠牙髓细胞培养4周后油红-O染色,倒置显微镜下观察、记录脂滴的生成情况。
1.2.3.2 成骨细胞诱导分化 使用矿化诱导液(含浓度为10 nmol/L的地塞米松、50 μg/L的维生素C、β-甘油磷酸钠10 mmol/L、L-谷氨酰胺2 mmol/L的DMEM/F12培养基)对第3代大鼠牙髓细胞培养4周后茜素红染色,倒置显微镜下观察、记录矿化结节的生成情况。
1.2.3.3 成牙本质细胞诱导分化 取第3代大鼠牙髓细胞使用成骨诱导液连续培养21 d后,按照碱性磷酸酶(ALP)染色试剂盒说明书进行固定、染色,镜下观察。
1.2.4 CM-DiI工作液配制及细胞标记 取生长状况良好的第3代大鼠牙髓干细胞消化离心,调整细胞浓度为1×105个/ml,取细胞悬液1 ml,移入离心管内。取50 μg装的CM-DiI一支,溶于0.5 ml的DMSO中,混匀,配为100 μg/ml的母液。
细胞悬液中加入母液,使CM-DiI的终浓度为5 μg/ml。静置于37 ℃条件下15 min,4 ℃条件下5 min,1 500 r/min离心5 min,弃上清,PBS重悬细胞,1 500 r/min再次离心5 min,以去除未与细胞结合的染料,加入2 ml基础培养基重悬细胞。
1.2.5 DAPI工作液配制及细胞标记 采用CM-DiI工作液的具体配制过程,将配制好的工作液加入细胞浓度为1×105个/ml细胞悬液中,按照CM-DiI细胞标记液配置中的具体要求,配制终浓度为5 μg/ml的DAPI细胞标记液。
1.2.6 CM-DiI/DAPI标记后细胞增殖情况检测 调整CM-DiI和DAPI标记后的细胞悬液浓度,以2×103个/孔的浓度各自接种于96孔板内,板内每孔含细胞悬液量为200 μl,将此孔的细胞作为实验组。对照组为未使用标记物做过标记的细胞,常规培养。自接种后第1,2,4,7天采用CCK-8检测试剂盒对所接种的细胞进行细胞增殖检测,具体操作步骤为:PBS漂洗3遍,每孔加入20 μl的CCK-8液,37 ℃条件下孵育2 h,酶标仪检测450 nm波长处的吸光度值(optical density,OD值),记录为A值,每组设有3个复孔,取平均值。
1.2.7 CM-DiI/DAPI标记后LDH释放检测 调整CM-DiI和DAPI标记后的细胞悬液浓度,以2×103个/孔的浓度各自接种于96孔板内,板内每孔含细胞悬液量为200 μl,将此孔的细胞作为实验组。对照组为未使用标记物做过标记的细胞,常规培养。分别收集培养12,24,48,72 h的细胞培养液,1 500 r/min离心后取上清,按照LDH试剂盒说明书进行操作,酶联检测仪490 nm波长测定每孔吸光度值OD值。细胞LDH释放率=(实验组OD值-对照组OD值)/对照组OD值×100%;每组设有3个复孔,取平均值。
1.2.8 统计学分析 使用SPSS13.0软件进行统计分析。数据以均值±标准误表示。LDH释放率以及细胞标记后增殖情况采用单因素方差分析进行统计检验;检验水准α=0.05。
2 结果
2.1 大鼠牙髓细胞的培养及形态观察
采用酶解组织块法对大鼠牙髓细胞进行原代培养,培养24 h后就可见有少量细胞从组织块中爬出(见图1A),3-5 d后细胞就可伸展开来,大多数伸展开来的大鼠牙髓细胞呈长梭状,类似于成纤维细胞的形状;少数为多角形、椭圆形或者呈现出纺锤形(见图1B)。
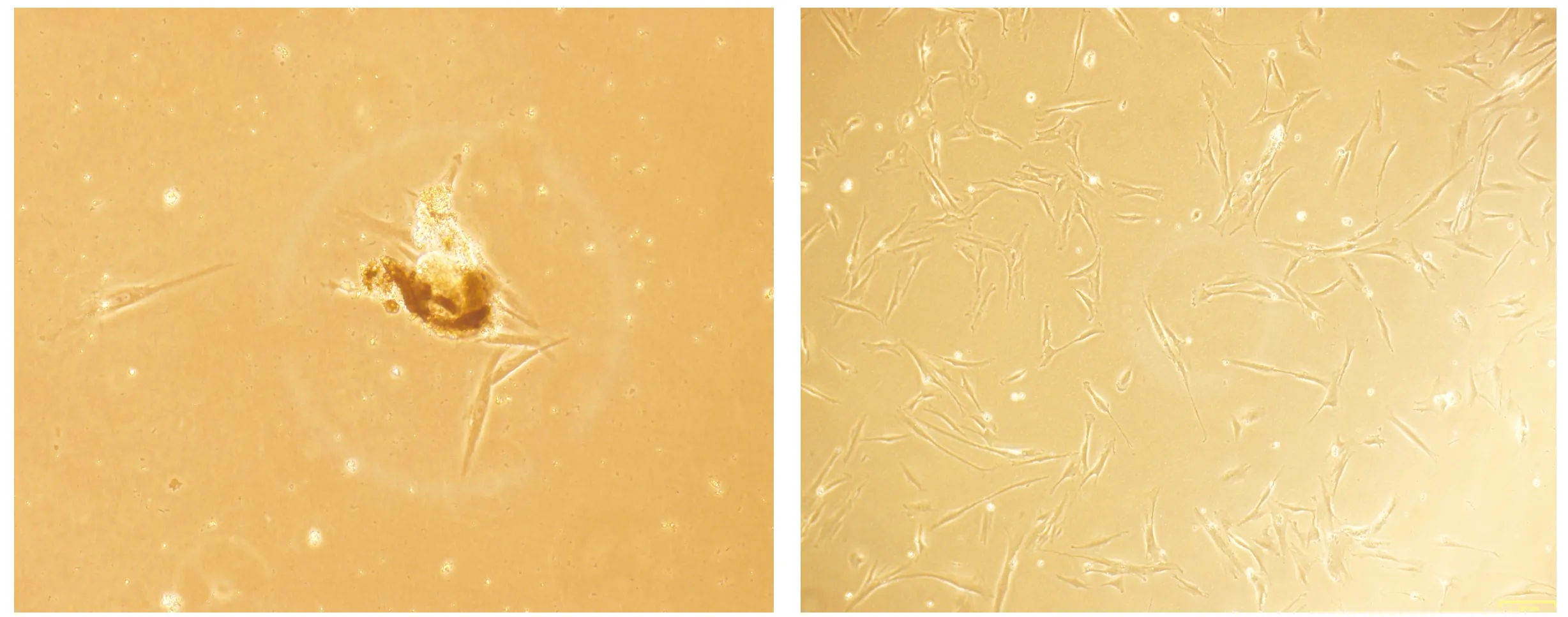
A.培养24 h大鼠牙髓细胞的形态 B.培养3-5 d后大鼠牙髓细胞的形态图1 倒置相差显微镜下观察大鼠牙髓细胞的形态 (bar=161 μm)Figure 1 Morphology of rat dental pulp cells observed under inverted phase contrast microscope (bar=161 μm)
2.2 大鼠牙髓干细胞的鉴定
2.2.1 细胞来源鉴定 培养的第3代大鼠牙髓细胞抗波形丝蛋白免疫组化染色后呈阳性表达(见图2A);抗角蛋白染色后呈阴性表达(见图2B)。证实所培养的大鼠牙髓细胞来源于间充质组织。
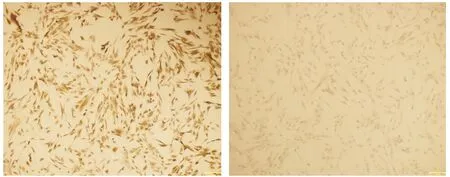
A.抗波形丝蛋白染色后呈阳性表达 B.抗角蛋白染色后呈阴性表达 图2 大鼠牙髓细胞免疫组化染色结果 (bar=161 μm)Figure 2 Immunohistochemical staining of rat dental pulp cells (bar=161 μm)
2.2.2 细胞多向分化能力检测 成脂诱导后经油红-O染色发现实验组有许多边界清楚的小圆球状橘红色脂肪颗粒,部分细胞密集区颗粒可连接成串珠状(见图3A)。成骨诱导后经茜素红染色发现实验组细胞红染,细胞间可见边界不清的红色矿化结节(见图3B)。经矿化诱导液培养后进行ALP染色发现,诱导组细胞浆出现棕黄色条索状或团块状阳性着色(见图3C)。
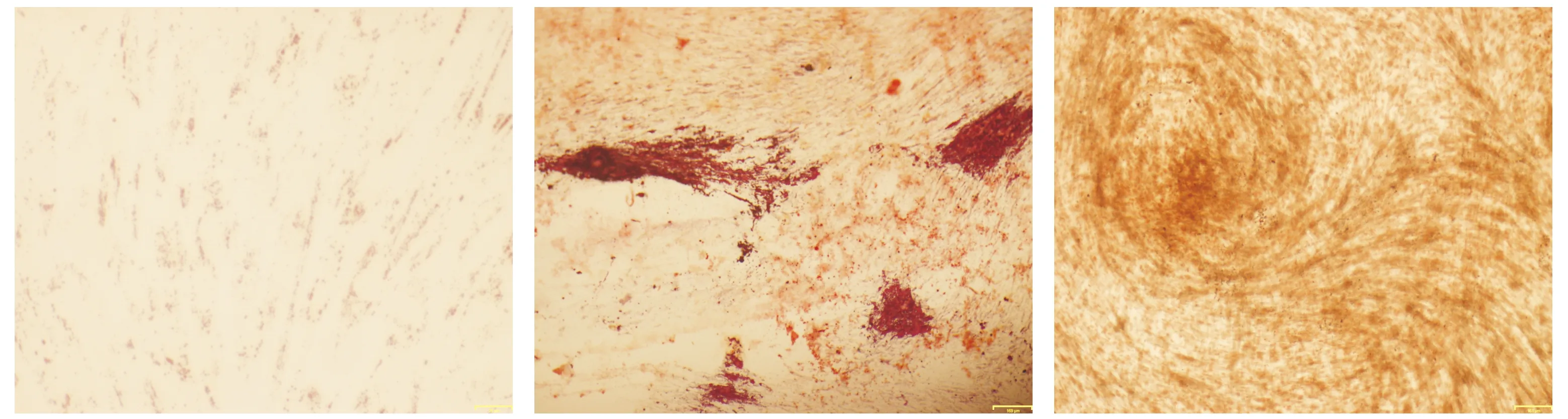
A.油红-O染色 B.茜素红染色 C.ALP染色图3 大鼠牙髓细胞多向分化能力检测 (bar=161 μm)Figure 3 Multidirectional differentiation ability of rat dental pulp cells (bar=161m)
2.3 细胞标记后观察
荧光显微镜下观察可见CM-DiI染色后,大鼠牙髓干细胞的细胞浆呈现红色荧光条带,胞核未染,细胞呈现出良好的生长状态(见图4A);DAPI标记后,细胞核为蓝色,细胞生长状况良好(见图4B)。
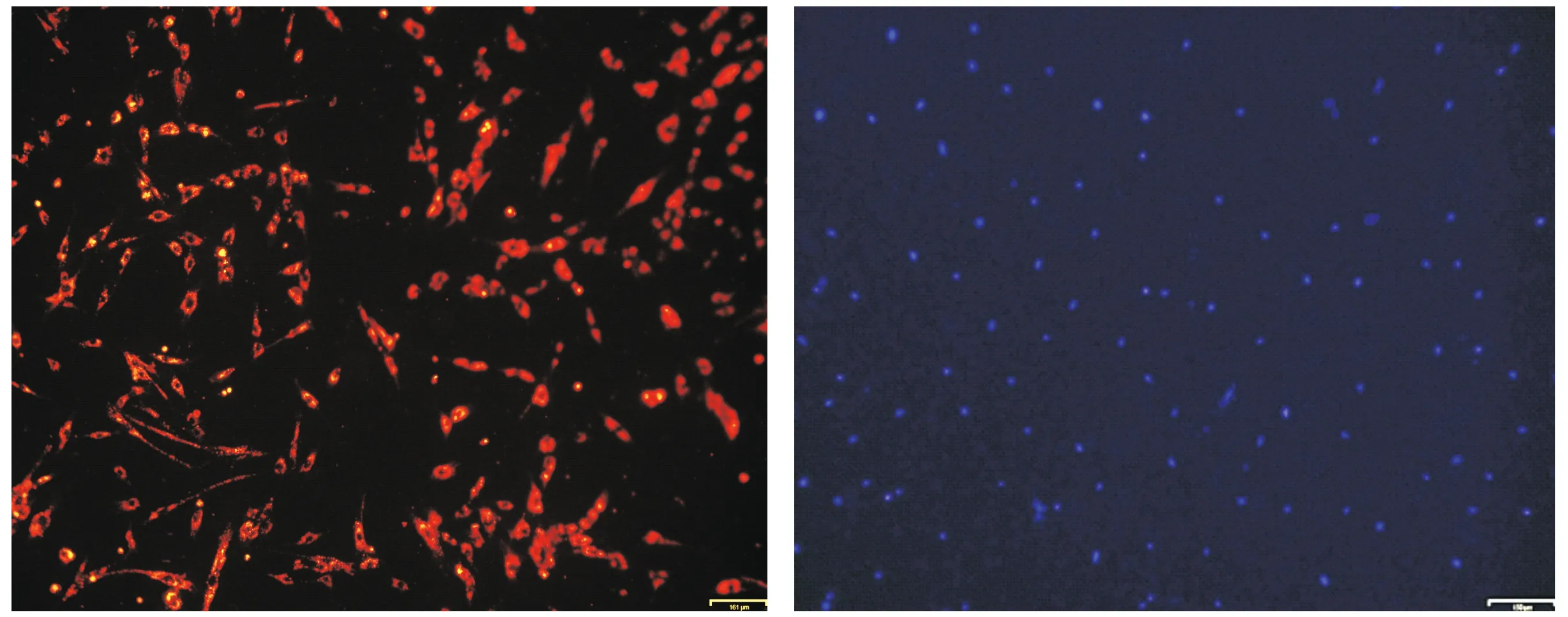
A.CM-DiI染色 B.DAPI染色图4 荧光显微镜下观察CM-DiI/DAPI标记的大鼠牙髓干细胞 (bar=161 μm)Figure 4 Observation of CM-DiI/DAPI-labeled rat dental pulp stem cells under fluorescence microscopy (bar=161 μm)
2.4 CM-DiI/DAPI标记后细胞增殖情况
两种材料标记后的细胞与未标记细胞相比,在所选择的4个时间点的OD值均无统计学差异(P>0.05,见表1),说明CM-DiI以及DAPI标记物对细胞增殖并未产生明显影响。
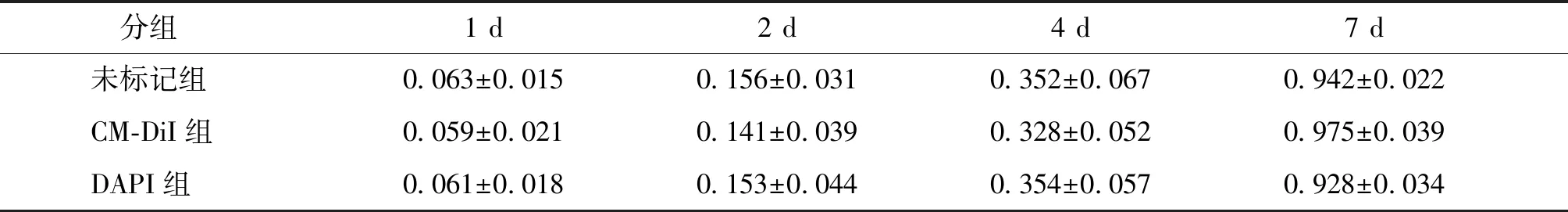
表1 标记物标记后细胞增殖情况Table 1 Cell proliferation after marker labeling
2.5 CM-DiI/DAPI标记后细胞LDH释放率比较
通过比较两种细胞标记物标记后12,24,48,72 h培养液中的LDH含量发现,DAPI组的LDH释放率在选取的4个测量时间点的OD值具有高于CM-DiI组的趋势,但两者差异无统计学意义(P>0.05,见图5)。
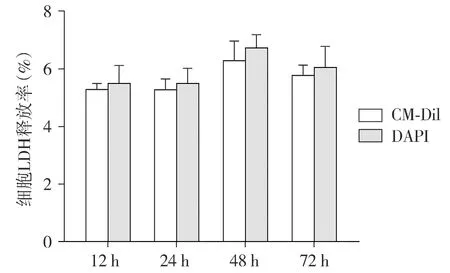
图5 CM-DiI/DAPI标记后LDH释放率比较Figure 5 Comparison of LDH release rate after CM-DiI/DAPI labeling
3 讨论
组织工程一直是近年来很多学者研究的热点问题之一。自2000年Gronthos等[9]成功地将牙髓干细胞从成人恒牙中分离出来,关于牙髓干细胞如何更好地应用于临床治疗就是很多学者关注的问题。
很多学者长时间致力于研究干细胞的分化机制,发现干细胞可分化为成骨细胞、成软骨细胞、脂肪细胞、神经细胞、血管内皮细胞等,因此干细胞如何更好地应用于临床中的组织修复和组织再生是大家关注的问题[10-13]。
干细胞进行活体组织内移植,要观察细胞移植后在植入体内是如何分化、迁移、存活以及体内分布,这些都离不开细胞标记以及示踪技术,细胞标记效果的好坏直接影响到体内示踪的效果。理想的细胞标记物应满足以下条件:①操作简便,不影响所标记细胞的生物学行为以及正常生理功能;②不影响宿主正常代谢功能;③标记产物稳定,可长时间存在于所标记的细胞内,易观察到细胞在宿主体内的增殖、走行、组织分化以及体内分布等情况;④标记方法特异性强,灵敏度高,信号易于捕捉,易分辨产生新组织的来源[14-18]。目前常用的标记方法有:Y染色体标记、荧光染料标记、绿色荧光蛋白标记、分子细胞标记、影像学成像技术标记等。
对于不同种属来源的细胞,标记物可能各有不同。但是目前哪种标记方法对间充质来源的牙髓干细胞标记效果更好,尚未有类似文献报道,因此本实验选取目前用于实验中最具代表性的荧光染料标记物CM-DiI和DAPI对大鼠牙髓干细胞进行体外标记,旨在挑选出更适合大鼠牙髓干细胞的标记物,为随后进一步的动物实验以及需要进行大鼠牙髓干细胞标记以及示踪的实验提供理论指导。
本实验通过酶解组织块法获得大鼠牙髓细胞,采用有限稀释法对所培养的细胞进行纯化,分离纯化出具有克隆集落式生长的大鼠牙髓细胞。通过免疫组化证实所培养的细胞为间充质来源,并且培养的细胞具有向脂肪细胞、成骨细胞、成牙本质细胞分化的潜能,进一步证实所培养的细胞为大鼠牙髓干细胞。
CM-DiI作为一种亲脂性、难溶于水的荧光染料,其易嵌入生物体的细胞膜内,并且嵌入后易在生物膜内做侧向扩散运动,进而对整个细胞膜进行标记。根据文献报道[19-22],该染料使用方便,在20 min左右即可使活细胞均匀着色,并且几乎对所标记的活细胞无毒性作用,不影响细胞的存活、生长,是较为理想的细胞标记方法。DAPI是一种可使标记细胞的细胞核染色的荧光染料标记物,它能与细胞核内的DNA发生特异性结合,通过紫外光的激发可发出浅蓝色荧光。DAPI可穿透活体细胞的细胞膜,对标记的细胞无明显细胞毒性,是理想的细胞标记示踪剂[23]。经CM-DiI/DAPI标记后的细胞,要检测两种不同类型的细胞标记物对标记后细胞的生物学影响,多通过标记物是否会对细胞代谢功能、酶活性、细胞膜完整性等这些方面进行综合评价、对比。LDH是一种存在于活细胞胞浆内的糖酵解酶,当细胞膜受损后会产生释放。因此可通过检测细胞培养上清液中的LDH的活性或含量,作为检测标记物是否会产生细胞毒性的敏感指标之一[24]。本实验中选取两种标记物在标记后12,24,48,72 h这4个不同的时间点,对两种标记物标记后的细胞进行细胞毒性检测,虽然组间差异并不具有统计学意义,但仍提示我们DAPI较CM-DiI而言,LDH的释放率具有增加的趋势。
本实验证实,CM-DiI与DAPI这两种标记物对大鼠牙髓干细胞进行体外标记时,具有操作方法简便、染色速度快、标记率高的特点,这两种标记物对所标记细胞毒性极小,但是相较DAPI而言,CM-DiI标记后LDH的释放率更小。因此,CM-DiI能更为有效地对大鼠牙髓干细胞进行体外标记,是大鼠牙髓干细胞标记与示踪的理想试剂。但是CM-DiI这种标记物对细胞活体内移植后组织分化、迁移的、存活的影响有待于进一步的动物实验所证实。
