白血病抑制因子抑制缺氧缺血新生大鼠模型神经元凋亡的机制研究
2021-07-16汤丽萍
汤丽萍,闫 瑾,王 浩,范 芳*
(1空军军医大学西京医院儿科,西安 710032;2西安医学院医学技术学院;*通讯作者,E-mail:76709358@qq.com)
新生儿缺氧缺血性脑病(hypoxic ischemic encephalopatly,HIE)可引起神经炎症,并导致神经元凋亡并进一步加重脑损伤。小胶质细胞和星形胶质细胞是神经炎症的主要因子[1]。尤其是小胶质细胞活化和富集是缺氧缺血的病理特征。激活的小胶质细胞产生多种细胞毒因子触发神经炎症并引起神经元功能障碍[2]。
白血病抑制因子(leukemia inhibitory factor,LIF)是白细胞介素6细胞因子家族中的一种糖蛋白,在中枢神经系统,LIF主要由星形胶质细胞释放,可促进神经活动增加、少突胶质细胞分化和神经元存活[3]。据报道,在新生儿脑梗死后,LIF的表达显著增加,LIF通过诱导信号转导和转录激活因子3(signal transducer and activator of transcription 3,STAT3)磷酸化以及Delta-like-1和Notch1的表达来调节新生儿脑缺血急性恢复期间神经前体细胞的扩张[4]。然而,目前尚不清楚LIF对HIE损伤后的神经保护机制。
核苷酸结合寡聚化结构域样受体蛋白3(nucleotide-binding oligomerization domain-like receptor protein 3,NLRP3)[5]和核转录因子-κB(nuclear transcription factor-κB,NF-κB)[6]是与脑缺血后小胶质细胞活化和随后的炎症反应相关的关键转录因子。NF-κB部分依赖于NLRP3炎症体的调节,并共同参与神经炎症过程。适当抑制NLRP3炎症体和NF-κB p65核转位可以有效抑制缺血后小胶质细胞的激活和神经炎症[7]。
目前,关于LIF在新生大鼠HIE模型中调节神经元凋亡的机制尚不明确。因此,本研究旨在从NLRP3和NF-κB信号通路介导的神经炎症方面来揭示LIF在HIE发病过程中的作用机制。
1 材料与方法
1.1 材料和试剂
过表达LIF的慢病毒(LV-LIF)和对照慢病毒(LV-NC)购自上海吉玛制药技术有限公司。2,3,5-三苯基四氮唑氯(TTC)购自美国Sigma-Aldrich公司;尼氏染色和TUNEL染色试剂盒购自瑞士罗氏公司;Trizol、Prime Script TM RT Reagent试剂盒、SYBR PreMix Ex Taq Ⅱ购自日本Takara Biotechnology公司;核质蛋白提取试剂盒、酶联免疫吸附试验(ELISA)试剂盒购自武汉博士德生物工程有限公司;BCA蛋白分析试剂盒购自碧云天生物技术研究所;Alexa Fluor 488-偶联山羊抗鼠IgG购自美国Proteintech公司,其余抗体均购自美国Cell Signaling Technology公司;增强的化学发光(ECL)试剂盒购自美国Bio-Rad公司;DAPI购自美国Sigma公司。
1.2 实验动物
90只7日龄SPF级Sprague-Dawley(SD)新生大鼠由西安医学院[SYXK(陕)2016-004]提供,体质量16-20 g,雌雄不限。大鼠在12 h的光/暗周期、21-24 ℃、55%相对湿度的环境下饲养,由母鼠自由哺乳。
1.3 新生大鼠缺氧缺血诱导模型
将新生大鼠置于温控室中,用乙醚进行全身麻醉诱导。新生大鼠被固定在一个立体定向器中,暴露右侧颈总动脉,分离神经和静脉,用5-0丝线结扎颈总动脉,缝合伤口。1 h后,将新生大鼠暴露在37 ℃的低氧密封室(92% N2和8% O2)中2 h。结束后,将新生大鼠送回母鼠笼中。假手术大鼠仅暴露颈总动脉,但不结扎总动脉,也不低氧处理。
1.4 动物分组及处理
在HIE建模前7 d,对50只新生大鼠脑室注射过表达LIF的慢病毒(LV-LIF)或对照慢病毒(LV-NC)。大鼠用10%水合氯醛(0.35 ml/100 g)腹腔注射麻醉,在右侧大脑半球钻孔,将10 μl注射器立体定向插入为脑室注射准备的孔中。右侧大脑半球分别注射5 μl LV-LIF(1×109TU/ml)或LV-NC(1×109TU/ml),注射速率为0.5 μl/min。LV-LIF或LV-NC给药及HIE建模后,根据处理方法将新生大鼠分为以下4组:假手术组(n=15):仅进行假手术;HIE组(n=15),仅进行HIE建模;HIE+LV-NC组(n=15):在HIE模型大鼠基础上进行LV-NC脑内给药;HIE+LV-LIF组(n=15):在HIE模型大鼠基础上进行LV-LIF脑内给药。
1.5 梗死体积检测
建模48 h后分离脑组织,在-20 ℃冰冻20 min后,连续冠状切片5片(2 mm厚),然后将切片孵育在37 ℃下用2% 2,3,5-三苯基四氮唑氯(TTC)染色25 min。用Image J软件分析梗死体积。
1.6 神经行为评估
根据Longa评分[8]进行神经行为评估,用Longa评分检测神经功能缺损程度。0分,无明显缺陷;1分,左前爪不能充分伸展;2分,左前肢伸展困难,向左转圈;3分,向左倾倒;4分,不能自发行走,意识水平下降。得分越高,损害越严重。2分和3分的动物纳入研究中,而得分为0,1,4分的HIE新生大鼠则被排除在外。
1.7 尼氏染色和TUNEL染色检测大鼠脑细胞凋亡
建模48 h后,用水合氯醛麻醉新生大鼠,快速移出大脑,在4 ℃下4%多聚甲醛固定。冠状切开脑组织,厚度为4 μm。根据制造商的说明对切片进行尼氏染色和TUNEL染色。每组随机选择5片,并用OLYMPUS CKX41显微镜分析。通过Image J软件计算细胞凋亡指数(AI)。AI=凋亡细胞数/细胞总数×100%。
1.8 RT-PCR检测大鼠脑组织LIF mRNA表达水平
用Trizol提取脑组织总RNA,用Prime Script TM RT Reagent试剂盒逆转录成cDNA。在Bio-Rad Q5实时荧光定量PCR仪上使用SYBR PreMix Ex Taq Ⅱ进行PCR。循环条件包括95 ℃ 30 s,95 ℃ 5 s,60 ℃ 30 s,72 ℃ 60 s,共40个循环。引物序列如下所示:LIF正向:5′-TGCTCTGGCTTTAGTGGAAAATATG-3′,反向:5′-CTCTTAGGAGTGGATAGTCAGTCCG-3′;β-actin正向:5′-TGACGACCATTCTGACAGGA-3′,反向:5′-GTGTGGGTGAACTCAGGTAA-3。
1.9 Western blot检测LIF、NLRP3、ASC、Caspase-1、NF-κB p65和IκBα蛋白表达水平
取缺血半影区的脑组织。通过核质蛋白提取试剂盒提取蛋白质。用BCA蛋白分析试剂盒检测蛋白的浓度。用10%SDS-PAGE电泳分离总蛋白(50 μg),并转移到PVDF膜上。在室温下用5%脱脂牛奶封闭1 h,并用以下一抗在4 ℃孵育过夜:抗LIF(1 ∶2 000)、抗NLRP3(1 ∶2 000)、抗ASC(1 ∶2 000)、抗Caspase-1(1 ∶1 000)、抗NF-κB p65(1 ∶2 000),抗IκBα(1 ∶2 000)、抗Lamin B1(1 ∶1 000)和抗β-actin(1 ∶1 000)兔单克隆抗体。用TBST洗涤3次后,用辣根过氧化物酶标记的特异性二抗在37 ℃孵育1 h,通过增强的化学发光(ECL)试剂盒显影。Lamin B1作为细胞核蛋白内参,β-actin作为细胞质蛋白内参。
1.10 酶联免疫吸附试验(ELISA)检测大鼠脑组织匀浆中TNF-α、IL-1β和IL-6的水平
用酶联免疫吸附试验(ELISA)试剂盒测定脑组织匀浆中肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)和白细胞介素-6(IL-6)的水平。
1.11 免疫荧光试验检测大鼠脑切片中Iba-1的表达
脑切片在室温下用4%甲醛溶液固定30 min,用1% Triton X-100孵育30 min,用5%山羊或驴血清在37 ℃封闭1 h,然后用以下一抗在4 ℃孵育过夜:Iba-1(1 ∶200)。用PBS洗涤3次后,切片与Alexa Fluor 488-偶联山羊抗鼠IgG(1 ∶200)荧光二抗在37 ℃反应1 h。用DAPI(1 ∶200)在37 ℃染色10 min。所有图像均使用尼康A1R/A1激光共聚焦显微镜观察和获取。
1.12 数据统计学分析
使用IBM SPSS 19.0软件进行数据分析,结果表示为平均值±标准差。使用单因素方差分析及LSD检验进行组间比较。P<0.05表示差异具有统计学意义。
2 结果
2.1 LIF在HIE新生大鼠脑组织中的表达
与假手术组相比,HIE组大鼠LIF的mRNA和蛋白表达水平均显著增加(P<0.05)。与HIE组和HIE+LV-NC组相比,HIE+LV-LIF组过表达LIF的慢病毒给药后大鼠LIF mRNA和蛋白的表达水平均升高(P<0.05),HIE组与HIE+LV-NC组的LIF mRNA和蛋白的表达水平无显著差异(P>0.05,见图1)。

A.Western blot检测LIF蛋白的表达B.RT-PCR检测LIF mRNA的表达与假手术组比较,*P<0.05;与HIE组比较,#P<0.05;与HIE+LV-NC组比较,&P<0.05图1 LIF在不同干预的新生大鼠脑组织中的表达Figure 1 Expression of LIF in the brain tissue of newborn rats after different treatment
2.2 过表达LIF对HIE新生大鼠的神经行为的影响
假手术组新生大鼠的神经功能缺损评分为0分,说明该组大鼠无明显神经缺陷。HIE组和HIE+LV-NC组新生大鼠的神经功能缺损评分分别为2.7±0.5分和2.6±0.3分。与HIE组和HIE+LV-NC组相比,HIE+LV-LIF组的神经功能缺损评分(1.5±0.4)显著降低(P<0.05,见图2)。
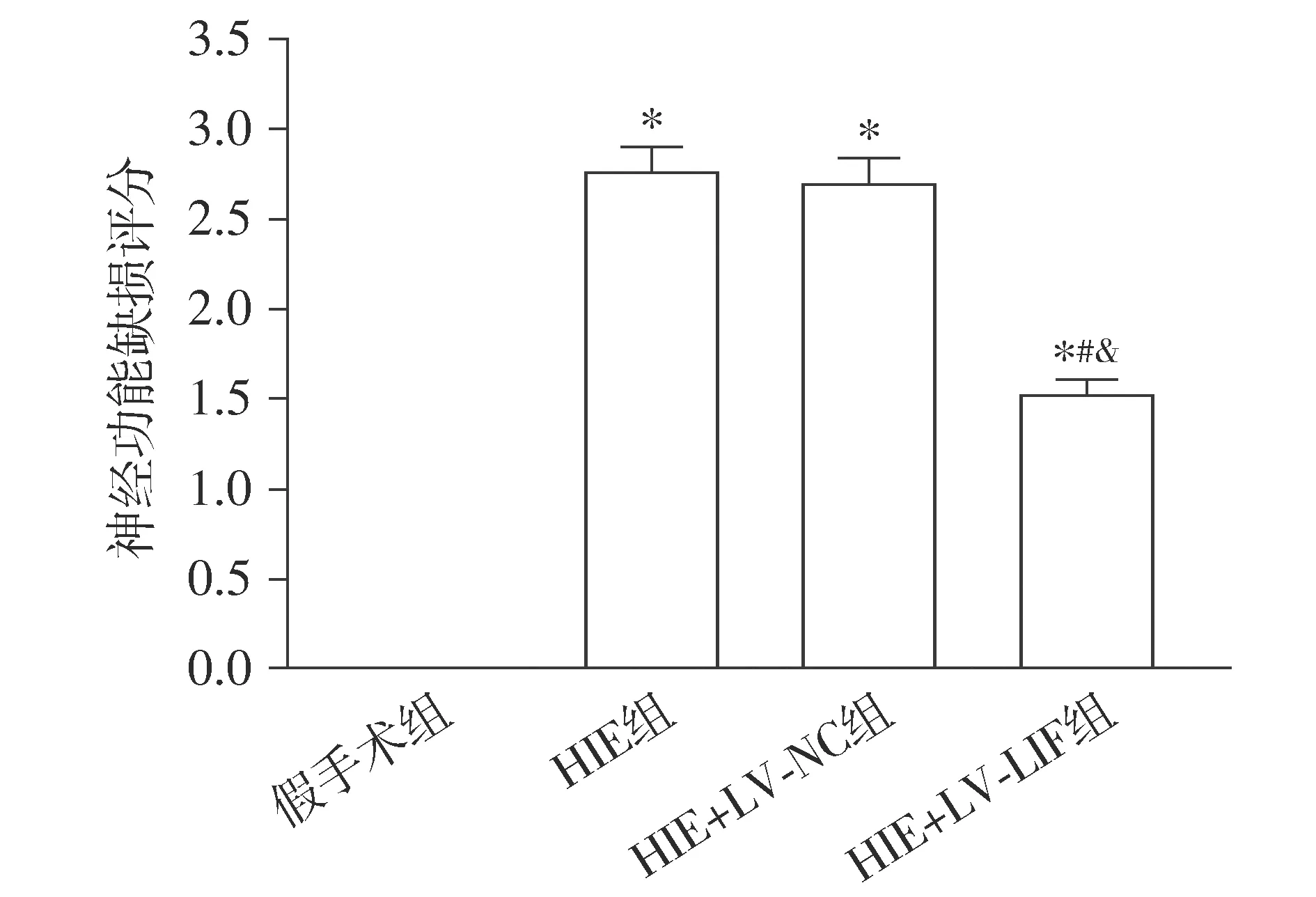
与假手术组比较,*P<0.05;与HIE组比较,#P<0.05;与HIE+LV-NC组比较,&P<0.05图2 新生大鼠的神经功能缺损评分Figure 2 Neurological deficit score of newborn rats after different treatment
2.3 过表达LIF对HIE新生大鼠脑梗死体积的影响
TTC染色结果显示,假手术组新生大鼠无脑梗死区域,HIE组和HIE+LV-NC组的脑梗死体积分别为27.6%±3.1%和26.8%±3.1%。与HIE组和HIE+LV-NC组相比,HIE+LV-LIF组大鼠的脑梗死体积(14.8%±2.6%)显著降低(P<0.05,见图3)。
2.4 过表达LIF对HIE新生大鼠神经元凋亡的影响
尼氏染色结果显示,与假手术组相比,HIE组梗死区空泡化、神经元丢失和组织破坏增加;与HIE组和HIE+LV-NC组相比,HIE+LV-LIF组的空泡化、神经元丢失和组织破坏明显减轻。TUNEL染色结果显示,与假手术组相比,HIE组细胞凋亡指数增加(P<0.05);与HIE组和HIE+LV-NC组相比,HIE+LV-LIF组的细胞凋亡指数明显降低(P<0.05,见图4,5)。
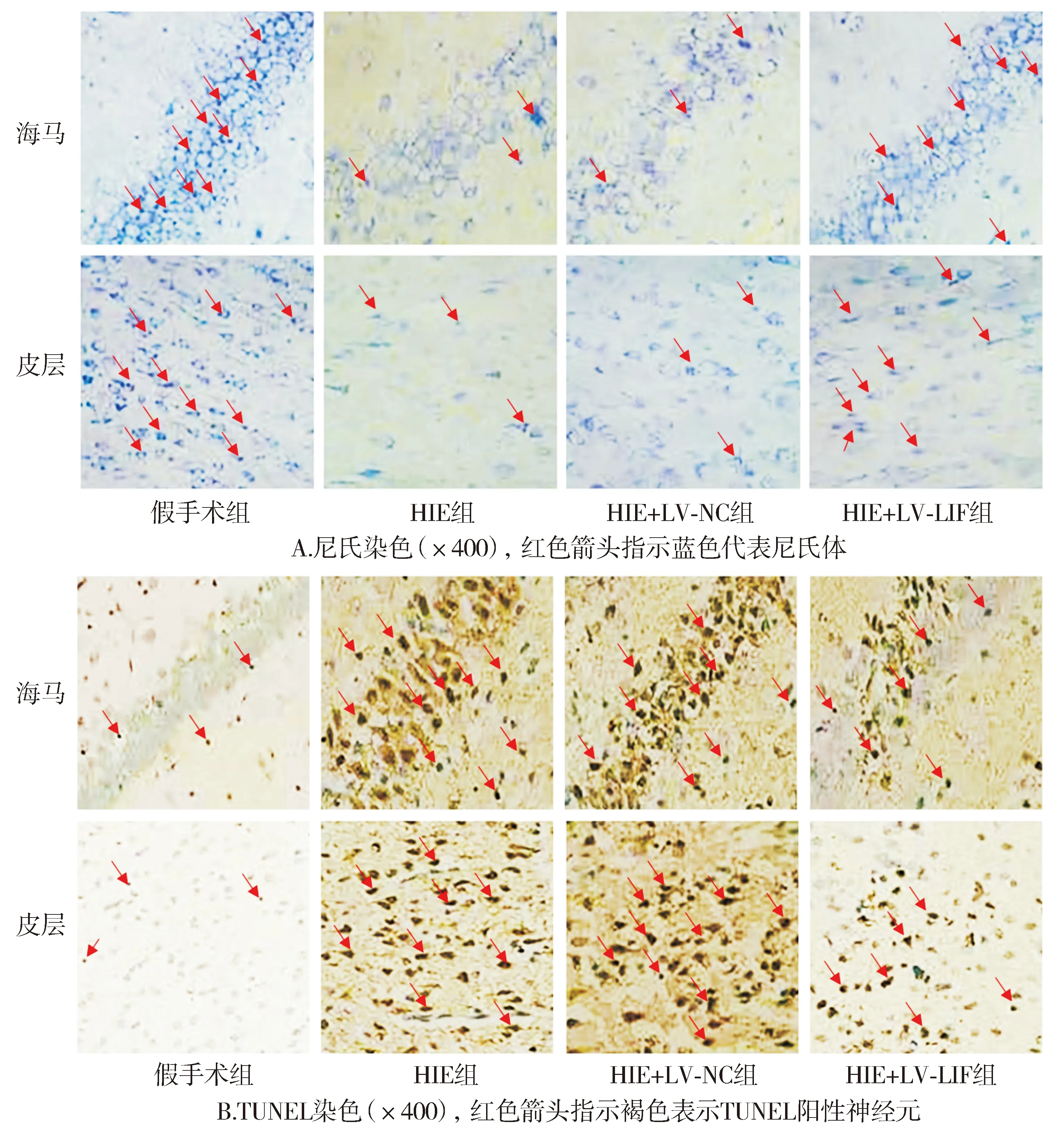
图4 新生大鼠脑组织的尼氏染色和TUNEL染色Figure 4 Nissl staining and TUNEL staining of neonatal rat brain tissue
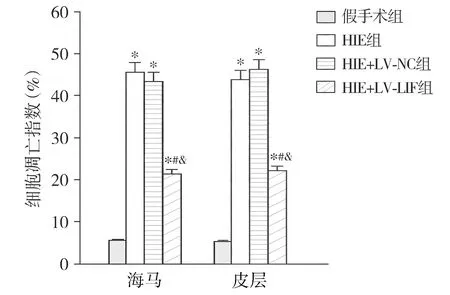
与假手术组比较,*P<0.05;与HIE组比较,#P<0.05;与HIE+LV-NC组比较,&P<0.05图5 TUNEL染色评估新生大鼠海马和皮层的细胞凋亡指数Figure 5 Apoptosis index of hippocampus and cortex of newborn rats by TUNEL staining
2.5 过表达LIF对HIE新生大鼠神经炎症的影响
与假手术组相比,HIE组新生大鼠脑组织匀浆中TNF-α、IL-1β和IL-6的水平均升高(P<0.05);与HIE组和HIE+LV-NC组相比,HIE+LV-LIF组脑组织匀浆中TNF-α、IL-1β和IL-6的水平均降低(P<0.05,见图6)。
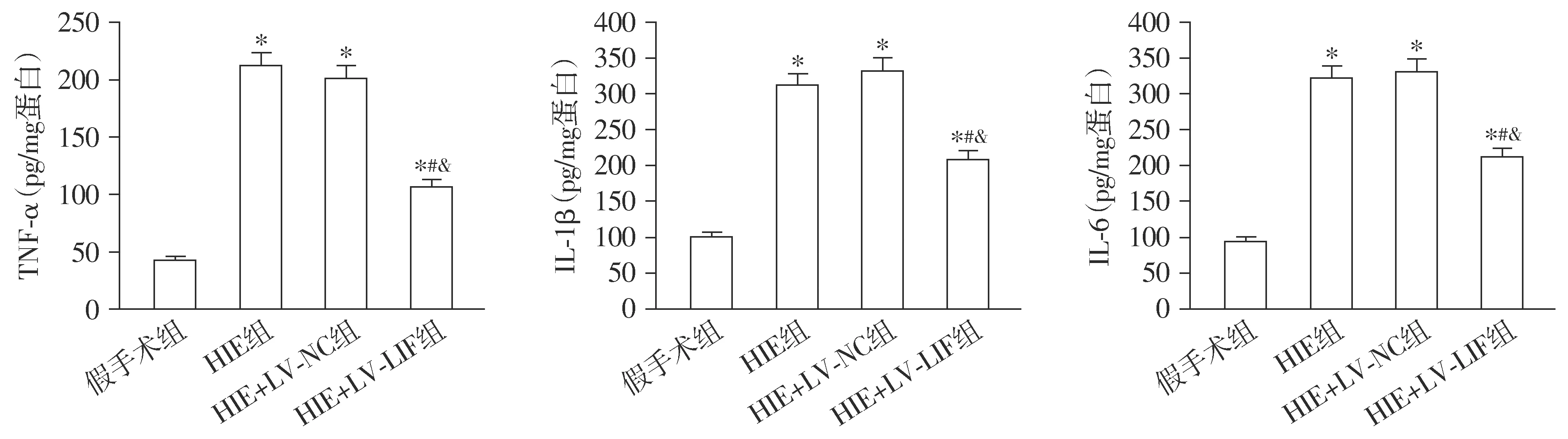
与假手术组比较,*P<0.05;与HIE组比较,#P<0.05;与HIE+LV-NC组比较,&P<0.05图6 新生大鼠脑组织匀浆中TNF-α、IL-1β和IL-6的水平Figure 6 The levels of TNF-α, IL-1β and IL-6 in the brain homogenate of newborn rats
2.6 过表达LIF对HIE新生大鼠小胶质细胞活化的影响
与假手术组相比,HIE组新生大鼠脑组织中Iba-1的相对荧光强度显著升高(P<0.05);与HIE组和HIE+LV-NC组相比,HIE+LV-LIF组脑组织中Iba-1的相对荧光强度显著降低(P<0.05,见图7)。
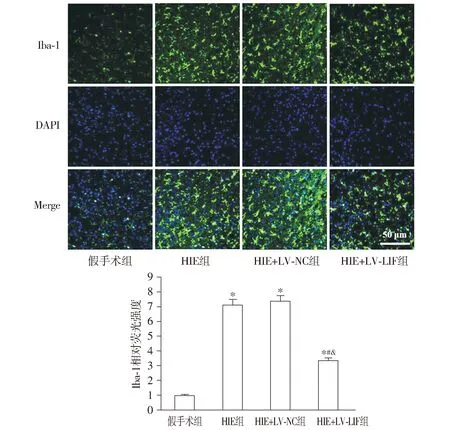
与假手术组比较,*P<0.05;与HIE组比较,#P<0.05;与HIE+LV-NC组比较,&P<0.05图7 新生大鼠脑组织中Iba-1的免疫荧光染色Figure 7 Immunofluorescence staining of Iba-1 in the brain tissue of newborn rats
2.7 LIF对HIE新生大鼠脑缺血半影区内NLRP3和NF-κB信号通路的影响
与假手术组相比,HIE组大鼠脑缺血半影区内NLRP3、ASC和Caspase-1的蛋白表达水平均升高(P<0.05);与HIE组和HIE+LV-NC组相比,HIE+LV-LIF组大鼠脑缺血半影区内NLRP3、ASC和Caspase-1的蛋白表达水平均降低(P<0.05,见图8)。与假手术组相比,HIE组大鼠脑缺血半影区内NF-κB p65的蛋白表达水平升高,而IκBα的蛋白表达水平降低(P<0.05);与HIE组和HIE+LV-NC组相比,HIE+LV-LIF组大鼠脑缺血半影区内NF-κB p65的蛋白表达水平降低,而IκBα的蛋白表达水平升高(P<0.05,见图9)。
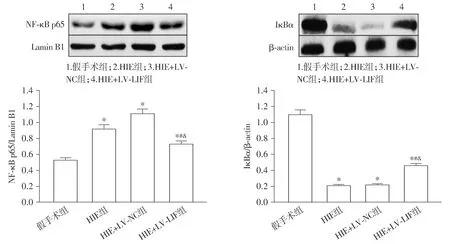
与假手术组比较,*P<0.05;与HIE组比较,#P<0.05;与HIE+LV-NC组比较,&P<0.05图9 新生大鼠脑缺血半影区中NF-κB p65和IκBα的蛋白表达Figure 9 Protein expression of NF-κB p65 and IκBα in the penumbra of cerebral ischemia in neonatal rats
3 讨论
白血病抑制因子是一种多功能的高度糖基化蛋白,在体内多器官和组织中合成和分泌,参与内分泌、生殖、炎症和免疫系统的许多重要生物学功能,并在中枢神经系统中作为神经营养因子发挥作用[4]。LIF通过与其受体以及糖基化的gp130蛋白复合物结合,激活多条下游信号通路。根据组织类型、细胞和发育阶段的不同,LIF可以激活和调节各种类型的信号通路,包括JAK/STAT3、PI3K/AKT和MAPK信号通路[9-11]。在正常组织中,LIF的转录水平很低,但在损伤后其表达显著增加[12]。有研究显示,在LIF单倍体缺陷小鼠中,LIF缺陷小鼠有更严重的运动和感觉缺陷,伴随着细胞死亡和轴突变性增加[12]。Gresle等[13]发现LIF基因缺失的小鼠更容易患实验性自身免疫性脑脊髓炎。然而,LIF在HIE中的作用仍不明确,本研究显示,LIF在HIE新生大鼠模型脑内上调。为了进一步揭示LIF在HIE中的作用机制,本研究对HIE新生大鼠脑内注射了过表达LIF的慢病毒。发现过表达LIF改善了HIE新生大鼠的神经行为并减少了脑梗死体积,说明LIF密切参与HIE的发病过程。
缺氧减少了葡萄糖和氧气的输送,从而引起细胞呼吸紊乱和代谢异常并导致氧化应激和自由基的产生,进一步诱导炎症介质释放,导致血脑屏障的破坏和继发性脑损伤[14]。继发性神经元损伤与以小胶质细胞和星形胶质细胞激活为特征的神经炎性反应有关,而过度的神经炎症也是神经元凋亡的主要原因。因此,抑制HIE中的神经炎症是减少神经元死亡及疾病进展的关键。本研究表明,过表达LIF可有效抑制神经炎症及神经元凋亡。
小胶质细胞是中枢神经系统中介导脑缺血后神经炎症的主要免疫细胞[15],负责监测中枢神经系统的微环境[16]。当脑内缺氧缺血后,小胶质细胞会经历一系列的表型变化转变成具有较少和较厚突起或变形虫形状的活化细胞形态[17]。一方面,活化的小胶质细胞迁移到缺血区,清除有害物质并维持组织稳态。另一方面,活化的小胶质细胞产生过量的炎性细胞因子、趋化因子和氧/氮自由基加剧组织损伤和神经元死亡[18]。因此,抑制小胶质细胞的过度激活可以抑制神经炎症并预防脑损伤。本研究显示,过表达LIF可明显抑制活化的小胶质细胞标志物Iba-1的表达。因此,上述结果提示LIF可能通过抑制HIE引起的小胶质细胞活化来减轻神经炎症。
NLRP3炎症体主要包括NLRP3、ASC和Caspase-1[19]。NLRP3激活后通过与NEK7相互作用,并与ASC和Caspase-1形成复合物(NLRP3炎症体),然后将非活性炎性细胞因子如IL-1β转化为成熟的炎性细胞因子,进而促进NF-κB的转录活性[20]。NF-κB途径是脑梗死所致神经炎症的关键转录途径[21]。NF-κB主要以p65和p50组成的异源二聚体存在。在静息细胞中,NF-κB存在于细胞质中,并与NF-κB抑制蛋白α(inhibitor a of NF-κB,IκBα)结合。在各种刺激下,IκBα被IκB激酶磷酸化并降解,这种降解导致p65/p50 NF-κB的核转位,并促进许多促炎细胞因子基因的转录[22,23]。抑制NF-κB p65核转位可以有效抑制缺血后小胶质细胞的激活和神经炎症[7,24]。本研究结果表明,过表达LIF抑制了HIE新生大鼠脑缺血半影区中NLRP3炎症体和NF-κB信号通路,从而抑制了神经炎症。
总之,LIF可通过抑制NLRP3炎症体和NF-κB信号通路的激活来有效抑制HIE后的小胶质细胞活化和神经炎症。因此,LIF与NLRP3炎症体和NF-κB信号通路的相互作用可能是预防和治疗HIE的一种策略。
