虎杖苷通过激活TrkA抑制芬太尼诱导的海马神经元细胞凋亡
2021-05-14李佩佩
李佩佩,郝 钰,杨 磊
1宁夏医科大学总医院麻醉科;2宁夏医科大学总医院心内科;3宁夏医科大学总医院中医骨伤科,银川 750004
尽管全身麻醉被认为是世界上数百万诊所每天都采用的安全且常规的医疗程序,但是近几十年的研究发现,在某些情况下,全身麻醉可能会导致中枢神经系统严重和不可逆转的神经损伤,尤其是在年轻和婴儿患者中[1]。在几种广泛使用的麻醉药中,芬太尼被证实在动物模型中可诱导神经元生长锥塌陷,神经突变性和其他组织病理学损害。近年来的研究指出,药物或遗传干预可以对芬太尼诱导的神经毒性发挥挽救作用,例如地塞米松可通过PI3K/Akt和ERK信号通路减轻芬太尼诱导的神经损伤[2,3]。
脑源性神经营养因子(BDNF)是由BDNF基因编码的一种生物活性蛋白,属于神经营养因子家族成员,集中分布于神经系统,通过与其高亲和力原受体酪氨酸激酶受体(Trk)相结合从而调节其下游信号转导通路发挥生物学效应,在中枢神经系统神经元及突触的生长,成熟,分化以及存活等过程中发挥重要作用,并通过抑制神经元凋亡,改善神经元的病理状态维持成熟神经元,发挥长时程增强作用,进而促进理解和记忆能力,此外BDNF/Trk还可通过与中脑边缘叶的多巴胺能系统相互作用,调节多巴胺释放,诱导多巴胺相关行为,改善或恶化认知和记忆功能。动物实验指出,敲除受体酪氨酸激酶受体基因的小鼠长时程增强显著受损,理解和记忆能力显著损伤[4-6]。虎杖苷为芪类有机化合物,是我国传统中药虎杖的干燥根茎中分离提取的天然活性成分之一,近年来的研究指出虎杖苷可以通过增加自由基清除或诱导淀粉β蛋白降解来预防神经退行性疾病,包括帕斯病或阿尔茨海默氏病[7,8],但是,目前虎杖苷是否在麻醉诱导的中枢神经系统毒性中发挥神经调节功能性作用尚不清楚,因此,我们通过使用虎杖苷预处理海马神经元细胞,以检测虎杖苷对芬太尼麻醉后的神经保护功能及其潜在机制。
1 材料和方法
1.1 仪器与试剂
聚D赖氨酸、10%胎牛血清、青霉素链霉素、DMEM培养基、成像载玻片(Thermo Fisher Scientific,美国);玻璃盖玻片、12孔板(CST,美国);虎杖苷和芬太尼(Sigma Aldrich,美国);TrkA封闭抗体、非特异性IgG抗体(Creative Biolabs,美国);RBFOX3/NeuN抗体(Novus,美国);Click-iT TUNEL Alexa Fluor 468成像分析仪,TRIzolTMPlus RNA纯化试剂盒,抗TrkA、TrkB、TrkC兔多克隆抗体,抗磷酸化TrkA、TrkB、TrkC兔多克隆抗体,抗cleaved-Caspase-9抗体,ECL Plus试剂(Invitrogen,美国);Caspase-9抗体(Abcam,中国);Axiovert显微镜(Zeiss,德国);逆转录试剂盒(罗氏,美国);SYBR Green Mix(TOYOBO,日本);TrkA、TrkB和TrkC的引物(Sangon Biotech,中国);RIPA裂解缓冲液、BCA试剂盒、SDS-PAGE凝胶、PVDF膜(Beyotime,中国);ChemiDocTM触摸成像系统(Bio-Rad,美国);ImageJ软件(NIH,美国)。
1.2 海马神经元细胞的体外培养
从宁夏医科大学实验动物中心购买5周大的C57BL/6小鼠,饲养于大学动物试验中心,环境温度22~26 ℃,湿度45%~55%,自由饮食饮水,饲养一周后用氯胺酮/甲苯噻嗪麻醉并通过颈椎脱臼法迅速处死,无菌条件下快速提取小鼠海马神经组织,将分离海马神经元细胞接种在层粘连蛋白/聚D赖氨酸的玻璃盖玻片的12孔板中,并在补充10%胎牛血清和青霉素链霉素的DMEM培养基中孵育,在5%CO2的湿润组织培养箱中,37 ℃下培养。
1.3 药物处理
虎杖苷(polydatin)和芬太尼(fentanyl)在DMSO中溶解,并在培养基中稀释至工作浓度,NMAC13(TrkA封闭抗体)和非特异性IgG抗体于TBST中稀释至工作浓度。
虎杖苷预处理组:将海马神经元细胞培养物用浓度为(0.01、0.05、1、5、10、50、100 μM)的虎杖苷预处理12 h,除去虎杖苷后使用常规培养基培养12 h,使用5 mM芬太尼处理2 h后将培养基更换为常规培养基,孵育24 h;阴性对照组细胞使用5 mM 芬太尼处理海马神经元细胞 2 h,将培养基更换为常规培养基,室温孵育24 h;然后进行TUNEL、qRT-PCR和Western blot分析。
使用NMAC13(20 μg/mL,NMAC13组)或IgG(20 μg/mL,IgG对照组)处理海马神经元细胞 24 h后用虎杖苷(50 μM)处理12 h,除去虎杖苷后使用常规培养基培养12 h,使用5 mM芬太尼处理2 h后将培养基更换为常规培养基,孵育24 h,然后进行TUNEL、qRT-PCR和Western blot分析。
1.4 TUNEL法检测细胞凋亡
PBS洗涤三次后,铺好至多聚赖氨酸载玻片上,4%多聚甲醛中固定25 min,室温孵育过夜,根据制造商说明书,添加Alexa Fluor 647偶联的RBFOX3/NeuN抗体,避光孵育45 min后,从12孔板中取出盖玻片并置于成像载玻片上,使用Click-iT TUNEL Alexa Fluor 468成像分析仪评估海马神经元细胞凋亡。
1.5 免疫组织化学染色
将获取的小鼠海马神经组织经固定、脱水、包埋、切片处理后,用二甲苯脱蜡并用梯度乙醇和蒸馏水处理,在沸腾的0.01 M柠檬酸盐缓冲液中加热90 s后将切片冷却,与3%过氧化氢温育10 min后与Caspase-9抗体(1∶1 000)室温孵育2 h,加入Max Vision TM,HRP标记的小鼠二抗室温孵育30 min,使用Axiovert显微镜观察染色。
1.6 RNA提取和实时定量PCR(qRT-PCR)
使用TRIzol?Plus RNA纯化试剂盒从海马神经元细胞中提取总RNA,然后根据试剂商说明书使用逆转录试剂盒将其反转录为cDNA。使用SYBR Green Mix在C1000TM PCR仪上进行QRT-PCR。小鼠Tropomyosin受体激酶A、B和C(TrkA、TrkB和TrkC)的引物购自Sangon Biotech。以β-肌动蛋白为内参,根据2-ΔCtCt方法将基因表达标准化,引物序列见表1。
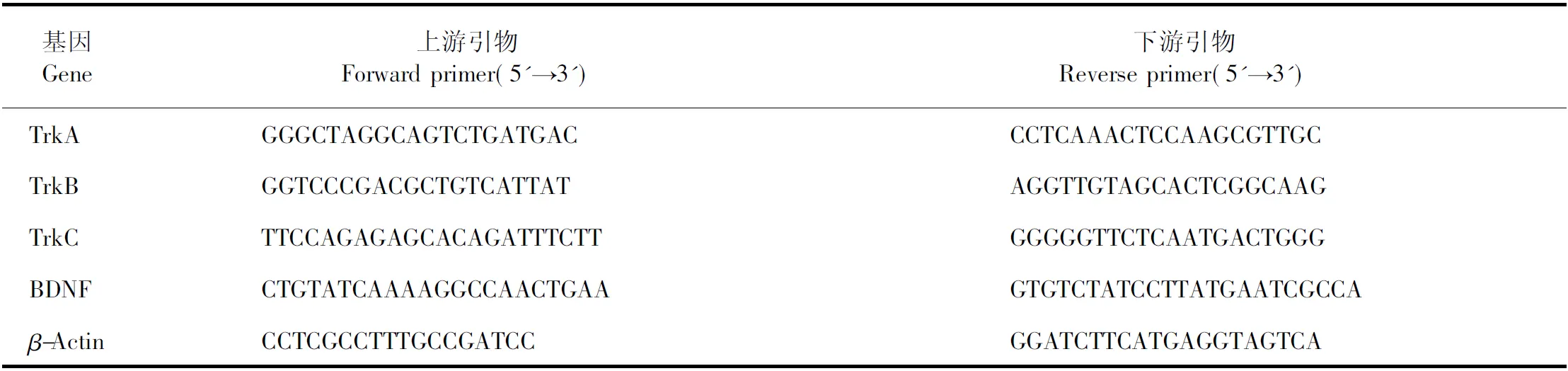
表1 PCR所用引物序列
1.7 蛋白质印迹分析
当细胞生长至对数生长期后胰酶消化收集细胞,根据制造商的说明书,使用RIPA裂解缓冲液从海马神经元细胞培养物中提取总蛋白,并使用BCA试剂盒进行定量。对于每份样品,将等量的蛋白质在SDS-PAGE凝胶上120 V,90 min电泳,然后室温转移到PVDF膜上。与相应一抗室温孵育过夜,包括抗TrkA兔多克隆抗体(1∶500),抗TrkB兔多克隆抗体(1∶500),抗TrkC兔多克隆抗体(1∶500),抗磷酸化TrkA兔多克隆抗体(1∶500),抗磷酸化TrkB兔多克隆抗体(1∶500)和抗磷酸化TrkC兔多克隆抗体(1∶500),抗Caspase-9抗体(1∶500),然后在室温下孵育HRP偶联的二抗室温孵育2 h。用ECL Plus试剂进一步增强印迹,并使用ChemiDocTM触摸成像系统对其进行可视化。使用ImageJ软件进行光密度分析。以β-肌动蛋白为内参进行蛋白表达的标准化。
1.8 动物实验
莫里斯水迷宫:将直径为120 cm,高度为50 cm的圆形罐放置在黑暗的测试室中,黑暗测试室内的水深高于平台,圆形水箱分为四个相等的部分,分别设计用于北部,东部,南部和西部区域。将直径为8 cm的黑色圆形平台放置在恒定位置,该位置位于水箱的东北区域,其顶点在水平面以下1 cm,水用无毒的黑色染料染色,水下平台的位置不可见。在所有实验中,将动物从水箱的西南象限释放,找到平台后,让小鼠在平台上停留30 s,每只小鼠每天定期训练4次,使其最终找到水下潜藏平台的时间低于60 s。
随机将训练后的小鼠分为对照组和虎杖苷组,对照组腹腔注射芬太尼(5 mg/kg),每三天一次,虎杖苷组腹腔注射芬太尼(5 mg/kg)和虎杖苷(10 mg/kg)进行联合处理,每三天一次,持续处理两周后进行莫里斯水迷宫测试以评估虎杖苷组和对照组小鼠的学习和记忆能力,视频跟踪系统记录寻找逃生平台的时间,找到隐藏平台的时间作为学习能力指标,撤去水下平台,记录小鼠在1 min内越过原始平台的时间和保留时间,以评估其学习和记忆功能。
1.9 统计分析
所有实验均至少重复进行三次,所有数据均表示为平均值±标准误差(SEM)。使用SPSS软件17.0(SPSS,美国)对所有统计分析进行Studentt检验。P<0.05时,差异具有统计学意义。
2 结果
2.1 虎杖苷抑制芬太尼诱导的海马神经元细胞凋亡
与对照组相比,芬太尼处理后,细胞凋亡增加(图1A);与芬太尼相比,虎杖苷预处理可显著降低芬太尼诱导的神经细胞凋亡(图1A),此外在50 μM处虎杖苷处理显示出最大的神经元凋亡抑制作用,故后续选择此剂量。

图1 虎杖苷对芬太尼诱导的海马神经元细胞凋亡发挥保护作用
2.2 虎杖苷抑制Caspase-9表达
与对照组相比,芬太尼处理后,Caspase-9和cleaved-Caspase-9表达增加(P<0.05);与芬太尼相比,虎杖苷预处理组Caspase-9与cleaved-Caspase-9表达降低(P<0.05,图2)。
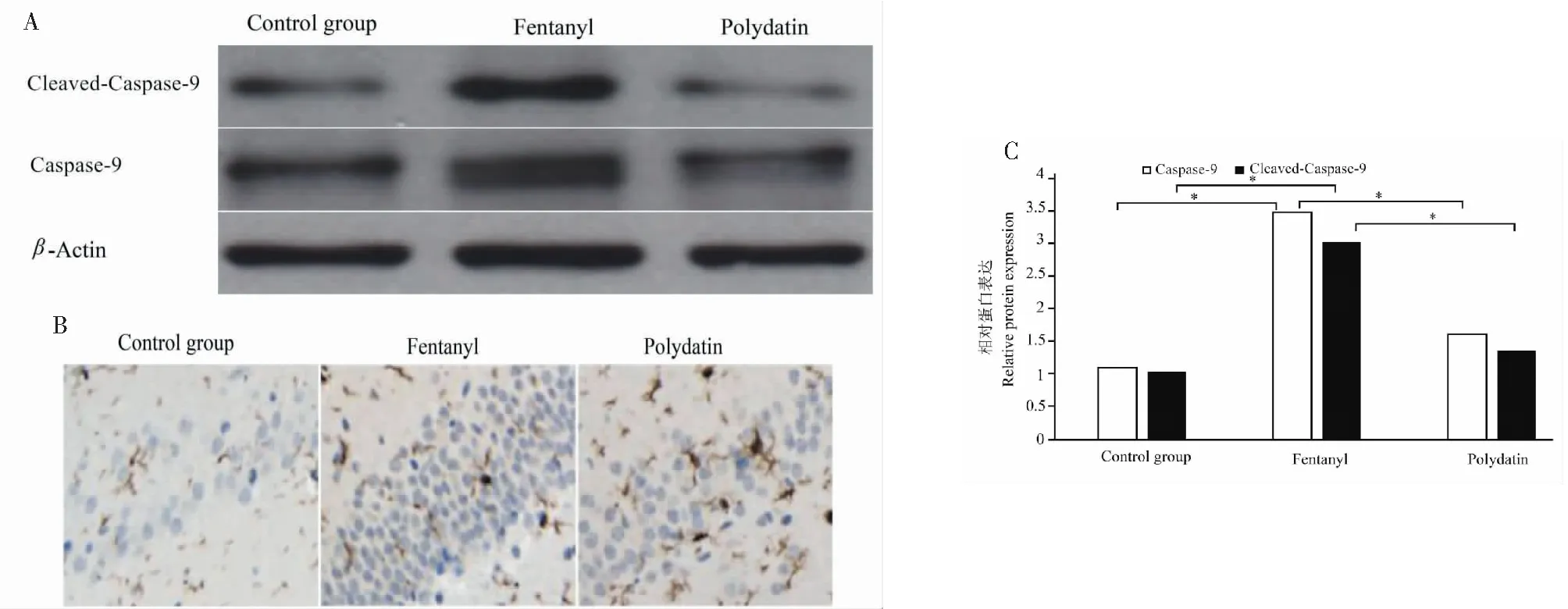
图2 虎杖苷抑制芬太尼诱导的Caspase-9的表达
2.3 虎杖苷激活芬太尼处理后海马神经元细胞中的TrkA与BDNF
与芬太尼相比,虎杖苷预处理组TrkA,TrkB或TrkC基因表达没有显著差异(图2A,P>0.05),BDNF转录水平显著增加(图2A,P<0.05),TrkA,TrkB以及TrkC的蛋白表达也无显著差异(图2B~F,P> 0.05),但BDNF和磷酸化TrkA的表达显著增加(图2B~C,2H~I,P<0.05)。
2.4 虎杖苷通过TrkA信号通路发挥神经保护作用
与IgG对照组相比,MNAC13组TrkA蛋白表达未受影响,但BDNF和磷酸化TrkA蛋白表达显著降低(图4A和4B,P>0.05),细胞凋亡显著增加(TUNEL阳性)(图4C~D,P<0.05)。
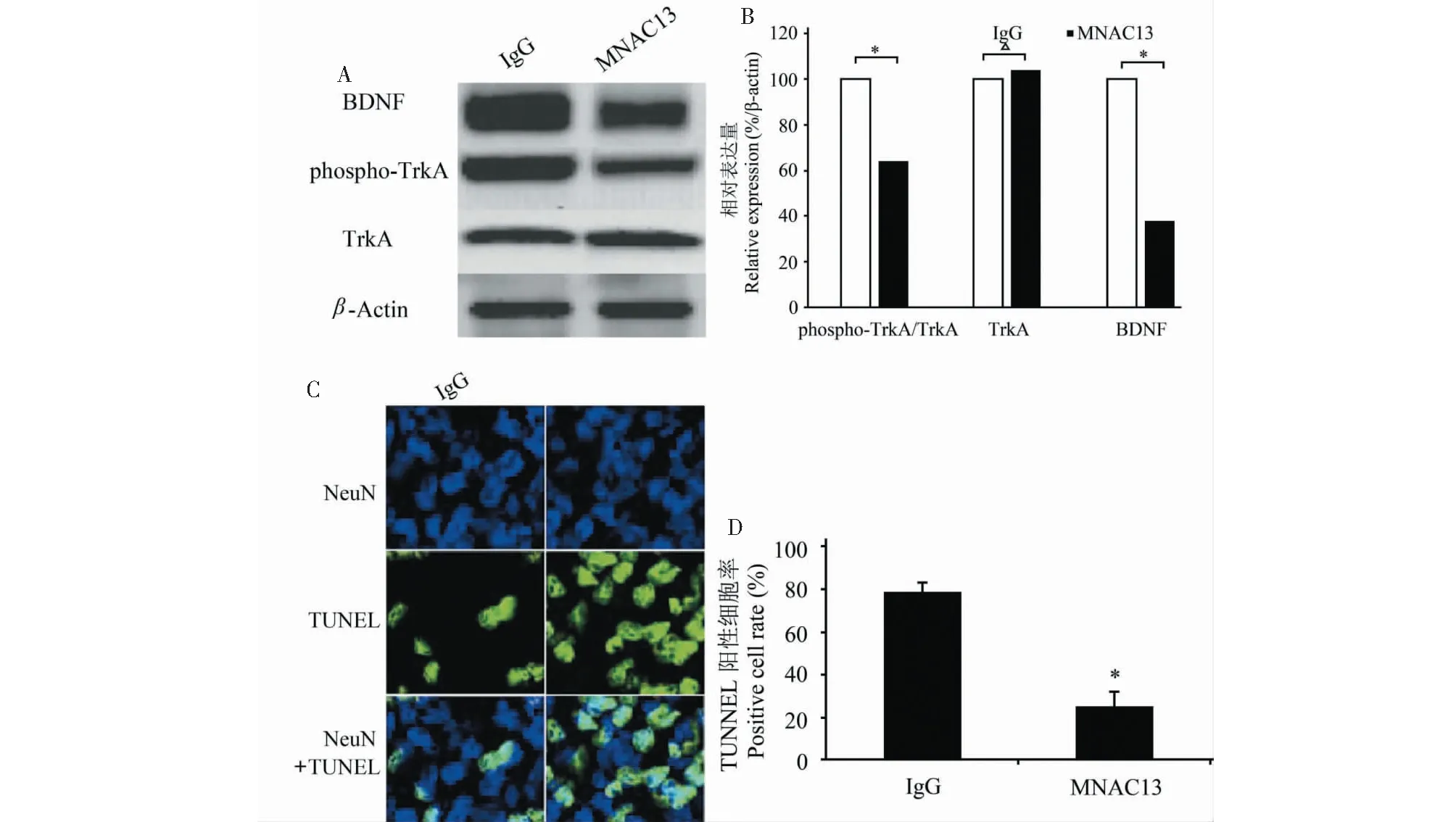
图4 虎杖苷通过TrkA信号通路发挥神经保护作用
2.5 虎杖苷改善小鼠学习和记忆能力
与对照组相比,芬太尼处理后,小鼠到达目标象限和穿越平台的时间显著增加,提示其学习记忆能力的下降(P<0.05,图5A和5B);与芬太尼相比,虎杖苷处理可显著降低芬太尼诱导的学习记忆能力的下降(P<0.05,图5A和5B)。
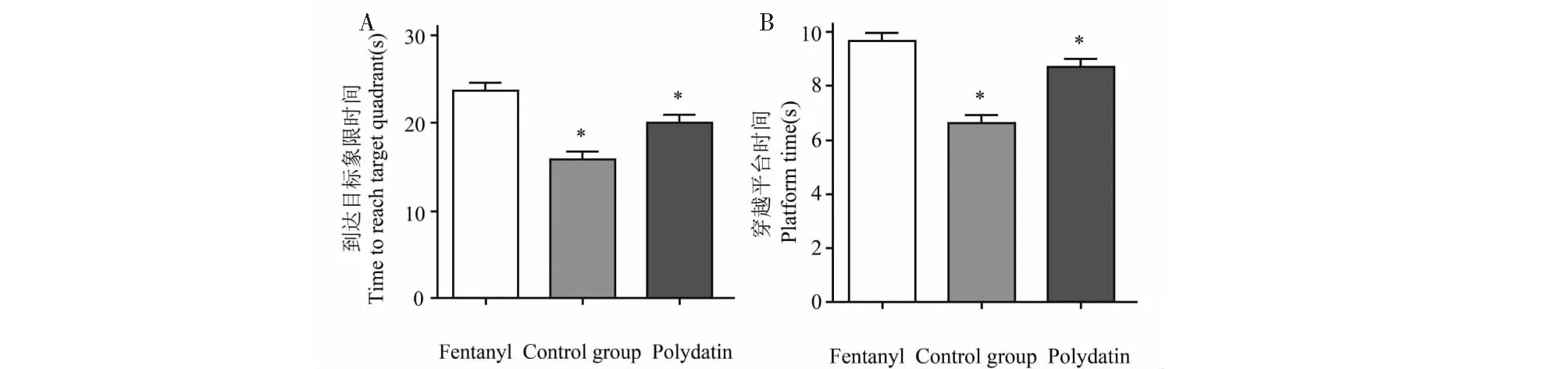
图5 莫里斯水迷宫测试
3 结论
高浓度的全身麻醉药(例如芬太尼)导致的麻醉持续状态可能引起缺血性缺氧和水肿,并诱发兴奋性氨基酸的释放,钠和钙的流入以及Caspase蛋白家族的活化,而Caspase的表达增加进一步激活下游效应子,导致包括海马神经元细胞在内的神经细胞凋亡,并诱发各种病理改变,例如神经元丢失和神经胶质细胞增生,导致中枢神经系统的急性和持续性损害,尤其是海马和其他边缘系统的神经元的损害,虽然少见,但可能对年轻和婴儿患者的发育中的大脑造成严重和永久的损害[9-12],因此研究麻醉诱导的中枢神经系统毒性的潜在机制以及其有效预防药物具有重要的临床意义,而我们的研究发现芬太尼处理可以显著诱导神经元细胞凋亡,抑制TrkA的磷酸化激活,促进Caspase-9的表达,损伤小鼠学习和认知能力,而虎杖苷预处理可以逆转芬太尼诱导的神经元凋亡和小鼠学习认知能力的损伤。
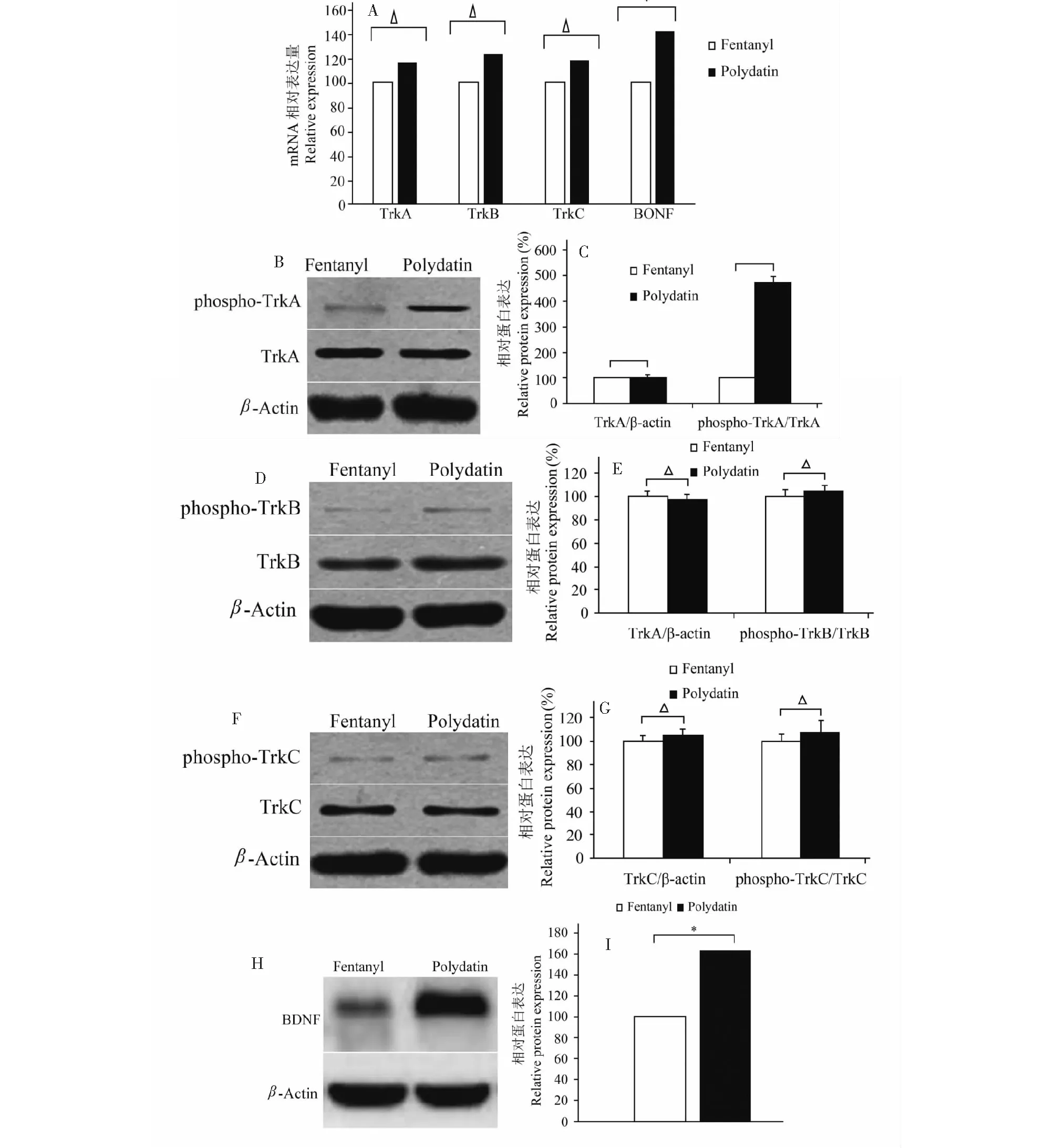
图3 虎杖苷对芬太尼处理的海马神经元细胞中TrkA /B/C与BDNF的作用
虎杖为蓼科多年生灌木状草本植物,以干燥根茎和根入药,虎杖中主要含有蒽醌类、黄酮类以及酚类化合物,具有有多种药理作用,包括抗炎,抗病毒,抗菌,调血脂,抗血栓,心肌保护,抗氧化,抗肿瘤,神经保护的作用[13]。虎杖苷是从其干燥根茎部中提取而来的活性成分,研究表明虎杖苷具有良好神经保护作用,可以通过进GLI-1(胶质瘤相关癌基因蛋白1)和SOD1(超氧化物歧化酶)的表达,下调NF-κB(核因子κB)活性,改善血脑屏障,进而保护脑中动脉缺血对大脑造成的损伤,减轻学习记忆障碍,改善认知障碍[14,15];在脊髓损伤的体内动物模型中,虎杖苷可通过增加超氧化物歧化酶,减少丙二醛和抑制凋亡相关信号通路而发挥神经保护作用[16-18]。最近研究发现,脑缺血后使用鞘氨醇处理可以通过激活Caspase-9/Caspase-3来促进海马神经元的凋亡,导致学习记忆能力下降,损害学习和记忆能力,而虎杖苷可以通过神经营养信号通路保护皮质神经元免受缺血性损伤,并通过下调Caspase-9抑制Caspase-3(半胱氨酸天冬氨酸蛋白酶-3)的激活,抑制神经元细胞凋亡,发挥神经保护功能,进而改善小鼠的学习和记忆能力[19-22]。我们的研究结果显示,虎杖苷可以显著抑制芬太尼诱导的Caspase-9上调神经元细胞凋亡,发挥神经元保护作用,改善小鼠学习和记忆能力。
原肌球蛋白受体激酶(Trk)受体(包括TrkA、TrkB和TrkC)在海马神经元发育过程中动态表达,通过与脑源性神经营养因子结合发生磷酸化,进而启动相关信号通路,并与神经营养蛋白信号通路相互作用以调节海马神经元的成熟,分化,存活,突触重塑或损伤,研究指出,通过激活神经营养信号通路中的TrkA/B可以会降低麻醉诱导的神经毒性[23-25],我们的研究发现,虎杖苷可以通过上调磷酸化激活的TrkA,显著抑制芬太尼诱导的神经元细胞凋亡,发挥神经元保护作用。
总之,我们的结果表明虎杖苷可以通过抑制Caspase-9的上调,促进TrkA的磷酸化激活降低芬太尼诱导的海马神经元细胞凋亡,发挥神经保护作用,改善小鼠学习和记忆能力。
