紫茎泽兰中泽兰酮类成分的抗炎活性研究
2021-05-11孙丽芳李海池葛发欢
孙丽芳,周 雪,汪 杰,李海池,葛发欢*
1广东药科大学中药学院,广州510006;2广东省中药超临界流体萃取工程技术研究中心,广州511458;3中山大学药学院,广州510006
紫茎泽兰(EupatoriumadenophorumSpreng)为菊科泽兰属多年生半灌木状草本植物,广泛分布于中国云南等西南地区。紫茎泽兰属于外来入侵物种,从上世纪50年代左右传入我国云南,繁殖能力极强,70 年代成为草害,给西南地区农、林、牧业造成难以遏制的生态灾害[1]。为了有效控制紫茎泽兰的蔓延,有学者进行过机械、化学、生物防治等尝试,虽然三种方法的结合运用是有效的治理方式,但需要浪费大量的人力、物力。因此,充分研究开发与利用这一丰富的天然资源、变废为宝成为解决紫茎泽兰问题的有效途径。
云南药用植物名录曾记载,紫茎泽兰全草具活血调经、清热解毒的功效,内用可治感冒发热、月经不调、跌打肿痛,外用可治足癣、无名肿痛、外伤出血[2]。近年来,人们利用现代药理的研究方法,对紫茎泽兰的生物活性进行研究,表明紫茎泽兰具有抗菌[3,12],抗病毒[4]、抗肿瘤[5]、抗氧化[6]以及杀虫[7]等活性。根据紫茎泽兰传统的调经活血、解热消肿的功效可推测,紫茎泽兰可能有一定的抗炎活性,然而目前仅见一篇对紫茎泽兰精油化学反应产物的抗炎活性的报道[8],紫茎泽兰中固有的天然成分的抗炎活性还未见报道,研究紫茎泽兰抗炎活性成分十分必要。本项目团队曾采用新型提取分离技术对紫茎泽兰提取、分离、纯化等进行过研究,得到了超临界CO2萃取、超临界CO2萃取-分子蒸馏富集等提取部位及2个泽兰酮单体[9,10](单体结构见图1),其中泽兰酮类成分是超临界CO2萃取部位、超临界CO2萃取-分子蒸馏富集部位的主要成分。在此基础上,本文对紫茎泽兰的超临界CO2萃取、分子蒸馏富集部位、甲醇提取部位的抗炎活性进行体外评价,寻找抗炎有效成分,为该植物的资源利用提供依据。
1 材料和方法
1.1 实验仪器
TDZ5-WS型离心机(上海卢湘仪离心机仪器有限公司);多功能酶标仪(美国Bio-rad公司);二氧化碳培养箱(上海智诚分析仪器制造有限公司);XDS-1B型倒置显微镜(重庆重光实业有限公司);DSX-280KB30型手提式压力蒸汽灭菌锅(上海申安医疗器械有限公司);细胞培养瓶、96孔板(美国Corning公司);XS205 DuaL Range型百万分之一分析天平、十万分之一分析天平(梅特勒-托利多仪器有限公司)。
1.2 实验材料
紫茎泽兰叶采自云南昆明市郊,由中山大学药学院葛发欢教授鉴定为菊科植物紫茎泽兰EupatoriumadenophorumSpreng.的叶,新鲜叶晒干。
euptox A(9-羰基-10,11-去氢泽兰酮,纯度≥98%)、9-oxoageraphorone(9-羰基-10-Hβ-泽兰酮,纯度≥98%);甲醇提取物(MSE,泽兰酮含量>8%)、超临界CO2提取物(SFE,泽兰酮含量>60%)、超临界CO2萃取-分子蒸馏提取物(MDE,泽兰酮含量>80%),均为葛发欢团队实验室自制;槲皮素对照品(纯度≥98%,北京索莱宝科技有限公司);脂多糖(LPS,Sigma公司);一氧化氮(NO)检测试剂盒(碧云天生物公司);小鼠TNF-αELISA试剂盒(索莱宝);DMEM培养基、PBS溶液、血清、0.25%胰酶、二甲基亚砜(DMSO)、青霉素-链霉素溶液等均来自美国Gibco公司;色谱级甲醇均来自美国Merck公司;小鼠巨噬细胞RAW264.7来自中山大学药学院。
2 实验方法
2.1 紫茎泽兰提取物的制备
按照文献[9],各个提取物的制备方法如下所述:
甲醇提取:精密称取紫茎泽兰干燥叶2.0 g,加入40 mL甲醇,室温超声提取30 min,提取液离心后,旋蒸,蒸干,计算收率。
超临界提取法:将紫茎泽兰叶粉碎,取300 g粉末,物料粒度80目,萃取温度50 ℃、萃取压力30 MPa、分离釜Ⅰ温度40 ℃、分离釜Ⅰ压力17 MPa,萃取2 h,即得。
超临界CO2萃取-分子蒸馏提取物:取一定量预热过的紫茎泽兰超临界萃取物加入进料口,保持进料口温度为35 ℃(保证样品流动性)蒸发温度133.99 ℃,真空度23.76 Pa,刮膜转速300 rpm,得到分子蒸馏二级产物。
2.2 MTT法检测细胞增殖活力
采用MTT法检测紫茎泽兰各个提取物及单体对小鼠单核巨噬细胞增殖活力的影响,筛选有效且安全的质量浓度。调整细胞浓度为6×104/mL接种至96孔板中,每孔100 μL,培养箱中培养24 h至细胞贴壁,吸去培养液,加入不同浓度的药液作为给药组,另设空白组(只加培养液)和阴性对照组(含有细胞和培养液),培养48 h后,避光加20 μL的MTT(5 mg/mL PBS溶液),继续培养4 h,培养结束后,吸去上清,每孔加入150 μL DMSO,充分振荡10 min,使用酶标仪在490 nm处检测吸光值。
2.3 Griess法检测小鼠单核巨噬细胞NO释放量
采用LPS诱导小鼠巨噬细胞RAW264.7炎症模型评价紫茎泽兰各提取物及单体抗炎活性。取对数生长期的RAW264.7细胞,空白培养基清洗2遍,向其中加入适量的完全培养基,吹打均匀,于细胞计数板计数后,加入完全培养基后将细胞稀释至浓度为5×105/mL,接种至96孔板,每孔100 μL,过夜培养至细胞贴壁,吸去培养液,每孔加入经培养基稀释至终浓度的待测样品,分为LPS组(阴性对照组),LPS+给药组,LPS终浓度均为1 μg/mL,空白组加入完全培养基,每个浓度设置3个复孔(0.2 mL/每孔),继续培养24 h后,在新的96孔板每孔加入50 μL培养液上清后,按炎症因子试剂盒说明书操作,测定NO 的释放量。用酶标仪测定吸光度值(波长540 nm),实验数据由GraphPad Prism 7 生物统计学软件计算药物对RAW细胞炎症因子NO释放抑制率IC50值。
2.4 ELISA法检测小鼠单核巨噬细胞TNF-α释放量
RAW264.7细胞接种密度为2×104/孔,其他操作与“2.3”相同,收集每孔细胞上清液,按照ELISA试剂盒说明书操作来测定各组培养孔内细胞上清液中炎性因子TNF-α的表达水平。
2.5 统计分析
采用SPSS 21.0 统计软件进行数据分析处理,数据以Mean ± SD表示,组间数据对比采用独立样本t检验,将数据通过Graphpad Prism 7.0绘图软件制作成直方图的形式表现实验结果之间的差异。
3 结果与分析
3.1 紫茎泽兰提取物泽兰酮类成分含量
按照文献[9,10],为了便于直观分析比较各提取物抗炎活性与泽兰酮类成分的关系,本研究所提供实验样品的含量汇总如下,见表1。
3.2 细胞活力分析
与阴性对照组相比,三个提取物质量浓度为100 μg/mL时,甲醇提取物(MSE)、超临界CO2提取物(SFE)、超临界CO2萃取-分子蒸馏提取物(MDE)细胞增殖活力均大于95%,见图2,说明三个提取物的质量浓度≤100 μg/mL的提取物药液对RAW264.7细胞活性没有显著性差异;两个单体摩尔浓度为300 μmol/L时,euptox A、9-oxoageraphorone的细胞增殖活力均大于90%,说明摩尔浓度≤300 μmol/L的单体药液对RAW 264.7细胞活性没有显著性差异。综上,三个提取部位在小于100 μg/mL的药液浓度是安全浓度范围,两个单体在小于300 μmol/L的浓度范围是安全浓度范围。

图2 紫茎泽兰各成分对小鼠巨噬细胞增殖活力的影响
3.3 紫茎泽兰三个提取物的抗炎活性
3.3.1 紫茎泽兰提取物对炎症因子TNF-α的影响
经ELISA法检测,与对照组相比,LPS组细胞上清液中TNF-α含量显著增高(P<0.05);20 μmol/L的槲皮素为阳性对照,TNF-α的释放量为21 722.55 pg/mL。三个提取物的不同浓度的给药组,与LPS共同处理24 h后,RAW264.7分泌TNF-α炎症因子较LPS组均减少,且随着各个提取物浓度的增加,炎症因子TNF-α减少更加明显,说明SFE、MDE、MSE对小鼠巨噬细胞分泌TNF-α均起到抑制作用,见图3。

图3 紫茎泽兰提取物对RAW264.7细胞产生的TNF-α表达的影响
3.3.2 紫茎泽兰提取物对炎症因子NO的影响
本实验利用LPS诱导RAW 264.7细胞,构建体外炎症模型,采用格里斯试剂法(Griess)检测细胞上清液中一氧化氮(NO)的分泌量。在确定不同提取物的无毒性剂量范围后,研究了不同提取物对LPS诱导的RAW264.7小鼠巨噬细胞NO生成量的影响,当细胞不受外界刺激时,细胞基本不表达NO,在终浓度为1 μg/mL LPS刺激24小时后,巨噬细胞释放出大量的NO。由图4可知,LPS组的NO释放量均显著高于对照组(P<0.001),表明造模成功。在测定中,以槲皮素为阳性对照(半抑制浓度IC50=14.23 μmol/L),与LPS组相比,质量浓度在5~100 μg/mL的三个提取部位的药液浓度均可降低NO释放量,且具有剂量依赖性。
由图4A可知,与模型组相比,SFE药液在质量浓度为5、10、15、25、50、100 μg/mL对LPS诱导的RAW264.7细胞NO生成量显著低于模型组(P< 0.05),NO的释放量随着药液浓度的增加而降低,IC50值为32.22 μg/mL。结果说明,SFE部位抗炎活性明显,超临界提取物的抗炎活性与提取物浓度呈现出明显的剂量依赖关系。
由图4B结果可知,不同浓度的MDE药液对RAW 264.7细胞均有不同程度的NO抑制作用(P<0.01),且当MDE药液的质量浓度大于50 μg/mL时,NO抑制率大于60%,IC50值为31.59 μg/mL。说明MDE部位有较明显的抗炎活性,MDE部位的抗炎活性随药液浓度的升高而升高。
由图4C可知,与模型组相比,各浓度MSE药液显著降低NO释放量(P< 0.05)。质量浓度大于25 μg/mL的MSE药液能显著降低NO的释放量(P<0.001),且随着药液浓度的增加,NO的释放量越低,IC50值为50.38 μg/mL。结果说明,甲醇提取物有一定的抗炎活性,与提取物浓度呈现出明显的剂量依赖关系。
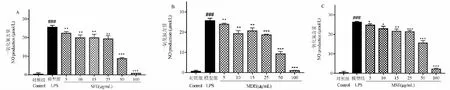
图4 紫茎泽兰提取物对RAW264.7细胞产生的NO表达的影响
综合以上研究结果,SFE、MDE、MSE的IC50值分别为32.22、31.59、50.38 μg/mL,说明SFE、MDE的抗炎活性相似,并显著高于好于MSE。根据课题组前期研究结果[9,10]可知,超临界CO2萃取及其分子蒸馏富集部位中euptox A、9-oxoageraphorone为主要成分,SFE和MDE富含泽兰酮类物质,euptox A、9-oxoageraphorone这两种泽兰酮总量均在60%以上[9],远高于MSE中的泽兰酮的含量,而SFE、MDE抗炎活性明显高于MSE的,因此推测,紫茎泽兰的抗炎活性可能与泽兰酮类物质有关。因此,进一步研究了泽兰酮单体euptox A、9-oxoageraphorone的抗炎活性。
3.4 紫茎泽兰单体euptox A、9-oxoageraphorone抗炎活性
3.4.1 Euptox A、9-oxoageraphorone对炎症因子TNF-α的影响
由图5可知,euptox A、9-oxoageraphorone的不同浓度的给药组,与LPS共同处理24 h后,RAW264.7分泌TNF-α炎症因子较LPS组均减少,且随着各个提取物浓度的增加,炎症因子TNF-α递减,说明euptox A、9-oxoageraphorone对小鼠巨噬细胞分泌TNF-α均起到抑制作用。
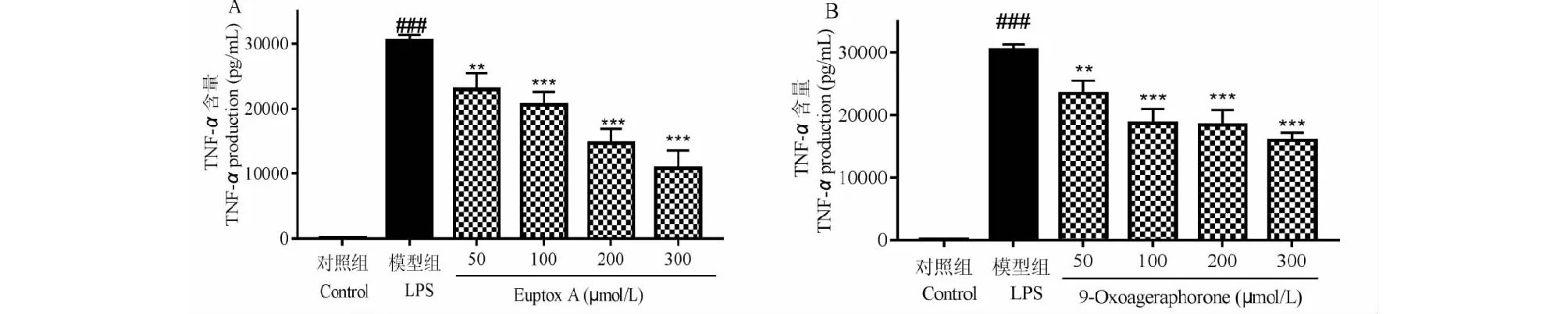
图5 化合物对LPS诱导的RAW264.7细胞的TNF-α生成量的影响
3.4.2 Euptox A、9-oxoageraphorone对炎症因子NO的影响
按照上述提取物抗炎活性测定方法,对单体euptox A进行了抗炎活性研究,结果见图6A。当摩尔浓度为25~300 μmol/L 时,euptox A药液极显著的降低NO的释放量(P<0.001)。不同摩尔浓度的euptox A对RAW 264.7细胞NO的释放均有抑制作用,且细胞中NO含量与提取物浓度有明显的剂量依赖性,随euptox A浓度的升高而降低。Euptox A的IC50值为69.98 μmol/L(16.23 μg/mL),显著低于三个提取物的IC50值,说明euptox A有显著的抗炎活性,且其抗炎活性优于各个提取物。
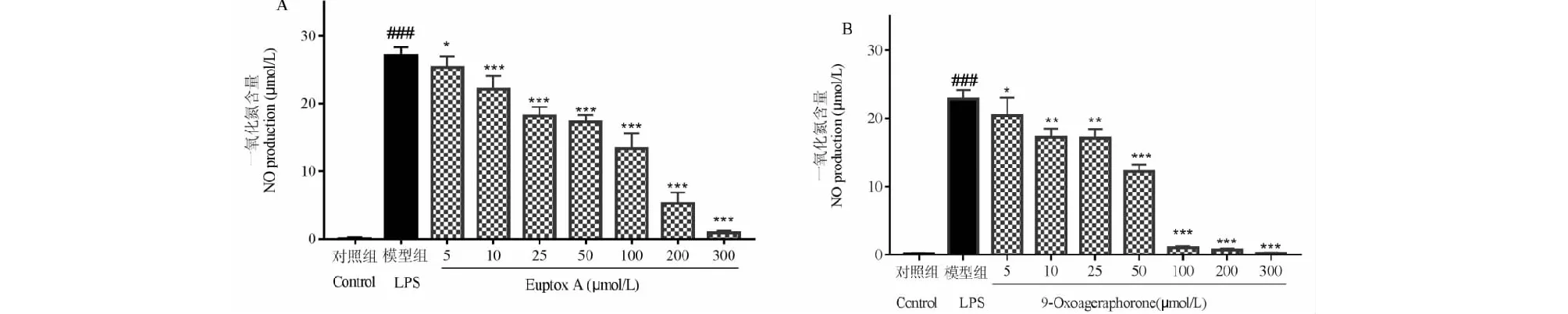
图6 化合物对LPS诱导的RAW264.7细胞的NO生成量的影响
由图6B结果可知,当摩尔浓度为50~300 μmol/L 时,9-oxoageraphorone药液极显著的降低NO的释放量(P<0.001)。不同摩尔浓度的9-oxoageraphorone药液对RAW 264.7细胞均有不同程度的NO抑制作用,9-oxoageraphorone药液的抗炎活性在5~100 μmol/L浓度范围内呈剂量依赖性,从100 μmol/L 开始进入了平台期。9-Oxoageraphorone的IC50值为43.14 μmol/L(10.09 μg/mL),结果显示泽兰酮单体9-oxoageraphorone具有显著的抗炎活性,其抗炎活性高于euptox A和三个提取物。

表2 紫茎泽兰各个样品的IC50值汇总
从以上研究结果可以看出,euptox A、9-oxoageraphorone两个单体化合物均有显著的抗炎活性,其中9-oxoageraphorone抗炎活性更强,说明euptox A、9-oxoageraphorone是紫茎泽兰中有效的抗炎成分之一。
4 小结与讨论
基于体外细胞炎症模型,本文首次对紫茎泽兰超临界CO2提取物、超临界CO2萃取-分子蒸馏提取物、甲醇提取物三个提取部位以及euptox A、9-oxoageraphorone的抗炎活性进行研究。从体外抗炎效果来看,超临界CO2提取物和超临界CO2萃取-分子蒸馏提取物表现出明显的抗炎活性;超临界CO2提取物和超临界CO2萃取-分子蒸馏提取物富含泽兰酮类成分,推测紫茎泽兰的抗炎活性与泽兰酮类物质有关。Euptox A、9-oxoageraphorone单体化合物具有显著的抗炎活性,且两个单体均好于各个提取物。结果证明泽兰酮类物质有良好的抗炎活性,是紫茎泽兰抗炎的有效成分之一。
本研究仅探讨了紫茎泽兰超临界CO2提取物和超临界CO2萃取-分子蒸馏提取物以及主要的泽兰酮单体化合物euptox A、9-oxoageraphorone的体外抗炎活性,紫茎泽兰中可能还含有少量9-羰基-12-羟基-10,11-去氢泽兰酮、9β-羟基泽兰酮、9-羟基泽兰酮乙酸酯等多种结构相似的泽兰酮类化合物[11],其他泽兰酮成分的体内外抗炎活性及抗炎机制值得深入系统研究。
