淫羊藿苷激活Nrf2信号通路保护D-半乳糖诱导损伤小鼠睾丸支持细胞15P-1作用初探
2021-05-11杨思琪张长城马琼艳赵海霞
杨思琪,张长城,马琼艳,尤 旭,杨 圆,张 艳,袁 丁,赵海霞
三峡大学医学院,宜昌 443002
随着经济社会的不断发展及人们生存压力的不断提高,不孕不育已成为一个全球性问题。研究发现,全世界约有15%的夫妇患有不育症,其中男性因素约占50%,而其机制尚不十分清楚[1]。睾丸支持细胞作为唯一与生精细胞相连的体细胞,在结构上包绕精原干细胞、精原细胞及各级生精细胞,通过多种紧密连接蛋白如闭合蛋白(Occludin)和密封蛋白-1(Claudin-1)等形成血睾屏障[2]。研究显示,睾丸支持细胞分泌各种生长因子如胶质细胞源性神经营养因子(glial cell line-derived neurotrophic factor,GDNF)、骨形成蛋白4(bone morphogenetic protein-4,BMP4)和干细胞因子(stem cell factor,SCF)等,调控精原干细胞增殖分化,促进精子形成[3]。另有研究发现,妊娠期暴露于六价铬的雄性大鼠成年后支持细胞紧密连接蛋白Occludin和Claudin-1表达下调,导致生精细胞凋亡增多,精子生成障碍[4]。在热应激刺激下,牛睾丸支持细胞发生损伤,GDNF、SCF mRNA水平下调,致使精子发生障碍。因此,改善支持细胞结构和功能可能是治疗男性不育症的新方向。
淫羊藿是我国传统补益中药,始载于《神农本草经》,具有补肾阳,强筋骨,祛风湿的功效。现代药理研究显示淫羊藿具有显著的延缓衰老和增强雄性生殖功能的作用,其主要活性成分为淫羊藿苷(icariin,ICA)。研究发现,ICA可促进大鼠原代Sertoli 细胞的增殖,增强雄性大鼠Sertoli细胞的功能[5]。研究显示,ICA可通过升高支持细胞卵泡刺激素受体和紧密连接蛋白Claudin-11 mRNA表达水平,提高睾丸组织的抗氧化应激能力,从而增强大鼠生殖功能[6]。核因子红细胞相关因子2(nuclear factor erythroid like 2,Nrf2)作为机体细胞防御系统的主要管理者,通过与抗氧化反应原件(antioxidant response element,ARE)的基因启动子调控区域中的增强子序列结合,调节一系列编码抗氧化蛋白和氧化应激反应蛋白等基因的表达,协调对各种应激条件和有害攻击的微调反应,实现细胞微环境稳态[7.8]。研究发现,淫羊藿可通过激活Nrf2减轻氧化应激介导的肝损伤[9]。本课题组前期研究发现,ICA可通过上调Nrf2减轻自然衰老大鼠睾丸生殖细胞DNA损伤。ICA可上调D-Gal诱导小鼠睾丸支持细胞株TM4细胞紧密连接相关蛋白Occludin和Claudin-1的蛋白表达。然而,ICA能否通过Nrf2信号通路改善D-Gal导致的15P-1细胞损伤,目前尚未见研究报道。前期研究显示,D-Gal可以诱导的小鼠睾丸支持细胞株TM4细胞紧密连接损伤。因此,本实验以D-半乳糖(D-galactose,D-Gal)诱导的15P-1细胞为损伤模型,从Nrf2信号通路探讨ICA对支持细胞损伤的保护作用及其机制。
1 材料和方法
1.1 材料与试剂
1.1.1 细胞株
小鼠睾丸支持细胞株15P-1细胞购自上海通派生物细胞库。
1.1.2 药物及试剂
DMEM、0.25%胰蛋白酶(美国Gibco公司);胎牛血清(Science Cell公司);D-Gal(Sigma公司);ICA单体(成都植标化纯生物技术有限公司),纯度98.61%。总RNA提取试剂盒、逆转录试剂盒(大连宝生物科技有限公司);PCR扩增试剂(Thermo Scientific公司);PCR相关引物由上海生工生物工程股份有限公司合成;ECL显影液(碧云天生物技术研究所);β-actin(4970L,美国Cell Signaling Technology公司);醌氧化还原酶-1[NAD(P)H quinone oxidoreductase-1,NQO-1](GB11282)、血红素氧化酶1(heme oxygenase-1,HO-1)(10701-1-AP)(武汉谷歌生物科技有限公司);GDNF(ab18956)、BMP4(ab39973)、Nrf2(ab31163)(美国Abcam公司);SCF(sc-13126)、Occludin(sc-5562)、Claudin-1(sc-166338)(美国Santa Cruze公司);辣根过氧化物酶(horseradish peroxidase,HRP)标记的山羊抗鼠IgG、HRP标记的山羊抗兔二抗(武汉科瑞有限公司)。
1.1.3 主要仪器
CKX41型光学倒置显微镜(日本Olympus公司);FORMA series Ⅱ二氧化碳培养箱(美国Thermo公司);SW-4T-2F型超净工作台(上海博讯实业公司医疗设备厂);TD25-WS型台式低速离心机(湖南省湘仪仪器有限公司);Centrifuge 5424 R型高速冷冻离心机(德国Eppendorf公司);HVA-85型高压灭菌锅(日本Hirayama公司);NANODROP 200型核酸蛋白检测仪(美国Thermo Scientific公司);StepOne Plus型PCR扩增仪(美国Applied Biosysterms公司);Gellogic 212型凝胶成像分析系统(美国Kodak公司);Power Pac TM Basic电泳仪(美国Bio-Rad公司);Bioshine Chemic Q 4800化学发光凝胶成像自动显影仪(上海欧翔科学仪器有限公司);A1R+激光共聚焦显微镜(日本Nikon公司)。
1.2 实验方法
1.2.1 15P-1细胞培养
复苏15P-1细胞,用含100 mL/L胎牛血清的DMEM培养基,置于37 ℃、50 mL/L CO2培养箱中培养,取处于对数生长期的细胞用于实验。
1.2.2 15P-1细胞分组及处理
前期我们采用100和150 mM D-Gal刺激15P-1细胞,Western blot及半定量PCR检测相关指标,进行模型条件的摸索,根据前期预实验结果,我们选择150 mM D-Gal进行后续实验。15P-1细胞按每孔5×104个/mL接种至六孔板中,分为对照组、D-Gal处理组、D-Gal+ICA(0.5 μM)组和D-Gal+ICA(1.0 μM)组。待细胞完全贴壁后,弃去培养基。Control组更换新鲜培养基,D-Gal处理组加入150 mM 的含D-Gal的培养基,D-Gal+ICA(0.5 μM)组加入含150 mM的D-Gal及0.5 μM ICA的培养基,D-Gal+ICA(1.0 μM)组加入含150 mM 的D-Gal及1.0 μM ICA的培养基刺激48 h。
1.2.3 MTT法筛选ICA适用浓度
将15P-1细胞按5×104个/mL的密度接种于96孔板,每孔100 μL。待细胞长出形态后,设置调零组、正常对照组(细胞+培养基)、D-Gal组、D-Gal+DMSO对照组、D-Gal+ICA组,每组5个复孔,给予不同浓度(0.125、0.25、0.5、1、2、4和8 μM)ICA预保护20 h后,吸去原培养基,正常对照组加入新配制的培养基,D-Gal处理组加入终浓度为150 mM D-Gal的新配制的培养基,D-Gal+ICA组加入终浓度为150 mM D-Gal及ICA终浓度为0.125、0.25、0.5、1、2、4和8 μM的新配制的培养基,刺激48 h后在每孔中加入终浓度为0.5 g/L MTT(5 g/L,PBS配制) 20 μL,继续避光培养4 h后去掉上清液,每孔加入150 μL DMSO后放在摇床上摇10 min后于酶标仪570 nm处测出OD值。最后通过细胞活力的计算公式:细胞活力=[A加药组-A调零组]/[A正常对照组-A调零组] ×100%,计算出各组的细胞的活力。
1.2.4 RT-PCR检测15P-1细胞相关因子GDNF、BMP4和SCF mRNA表达水平
将六孔板从培养箱中取出,吸除上清,每孔加入1 mL PBS洗涤细胞后,每组加入1 mL Trizol裂解液,提取总RNA。检测其完整性,核酸仪测定其浓度,按逆转录试剂盒说明进行逆转录得cDNA,PCR反应体系为:12.5 μL 2×PCR Master mix,10.5 μL ddH2O,分别加入0.5 μL GDNF、BMP4和SCF上下游引物,最后加入1 μL cDNA模板,引物序列见表1。RT-PCR反应条件:①变性:94 ℃ 30 s;②退火:57 ℃ 30 s;③延伸:72 ℃ 30 s;共30个循环。PCR产物经20 g/L琼脂糖凝胶电泳,利用凝胶成像仪拍照,用Image J软件扫描条带的吸光度(A)。
1.2.5 Western blot法检测15P-1细胞功能相关蛋白GDNF、BMP4、SCF、Occludin和Claudin-1及Nrf2信号通路相关蛋白Nrf2、HO-1和NQO-1蛋白表达水平
将六孔板从培养箱中取出,吸除上清,每孔加入1 mL PBS 洗涤细胞后,收集细胞。在收集好的各组细胞中加入100 μL裂解液,涡旋仪上剧烈振荡30 s,冰盒中静置15 min,共震荡3次,使细胞充分裂解。经4 ℃、12 000 rpm离心10 min后取上清,采用BCA蛋白浓度试剂盒测定蛋白浓度,定量后的蛋白样品加入上样缓冲液,于100 ℃水浴变性10 min。将蛋白样品进行电泳并转印至PVDF膜,PVDF膜放置于50 g/L脱脂牛奶封闭液中室温封闭1 h,分别加入鼠抗Claudin-1(1∶1 000)、兔抗Occludin(1∶2 000)、兔抗GDNF抗体(1∶1 000)、兔抗BMP4抗体(1∶1 000)、鼠抗SCF抗体(1∶1 000)、兔抗Nrf2抗体(1∶1 000)、鼠抗NQO-1抗体(1∶500)、兔抗HO-1抗体(1∶1 000)、兔抗 β-actin 抗体(1∶5 000),4 ℃冰箱摇床孵育过夜;次日,TBST洗膜,加HRP标记的山羊抗鼠 IgG(1∶5 000)或HRP标记的山羊抗兔二抗(1∶3 000),室温孵育1 h;TBST洗膜。ECL化学发光于凝胶成像系统中显影成像,用Image J软件对结果进行灰度扫描分析。
1.2.6 免疫荧光检测Nrf2表达及定位
将无菌圆形盖玻片放入24孔板中,无菌PBS洗净玻片上残留的酒精,将GC-1细胞悬液接种到无菌玻片上。待GC-1细胞长出形态后,按照“1.2.3”处理细胞后弃掉上清,PBS洗涤细胞,每5 min更换一次PBS,共洗涤20 min。洗涤完成后,4%的多聚甲醛固定细胞30 min后PBS洗涤细胞,每5 min更换一次PBS,共洗涤20 min。后经0.1% Triton X-100打孔15 min,PBS洗涤细胞,每5 min更换一次PBS,共洗涤20 min。1% BSA于温度为25 ℃下封闭1 h,弃掉封闭液后,置于4 ℃冰箱孵育一抗。一抗孵育完成后,25 ℃复温30 min以上,PBS洗涤细胞,期间每5 min更换一次PBS。于37 ℃的温度下避光孵育荧光二抗1 h,用PBS洗涤细胞后,避光孵育DAPI(0.5 μg/mL)5 min,PBS洗涤后封片,共聚焦荧光显微镜下观察取图。
1.2.7 数据处理及统计分析
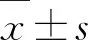
2 结果
2.1 ICA对15P-1细胞活力的影响
用不同浓度ICA处理15P-1细胞后,MTT法检测细胞活力,结果如图1所示,当ICA浓度在2.5 μM以下时,对正常细胞无明显影响;将15P-1细胞分为对照组、150 mM D-Gal处理组、150 mM D-Gal +DMSO处理组、150 mM D-Gal加不同浓度ICA(0.125、0.25、0.5、1、2、4和8 μM)处理组,用MTT法检测细胞活力。与D-Gal处理组相比,ICA浓度为0.5和1 μM时,对15P-1细胞活力有明显的保护作用,因此后续我们选择ICA用药浓度为0.5和1 μM研究D-Gal诱导15P-1细胞损伤的保护作用。
2.2 ICA对15P-1细胞形态的影响
光镜结果显示,与对照组相比,D-Gal处理组中,15P-1细胞数量明显减少,部分细胞形态不规则,而ICA干预后明显改善(见图2)。
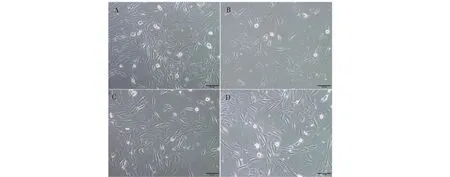
图2 ICA对15P-1细胞形态的影响(400×)
2.3 ICA对15P-1细胞相关因子GDNF、BMP4和SCF mRNA水平的影响
RT-PCR结果显示,与对照组相比,D-Gal处理组GDNF、BMP4和SCF mRNA水平均显著下调,提示D-Gal处理后,15P-1细胞功能下降,而给予ICA干预后,GDNF、BMP4和SCF的mRNA水平均显著上升(见图3)。
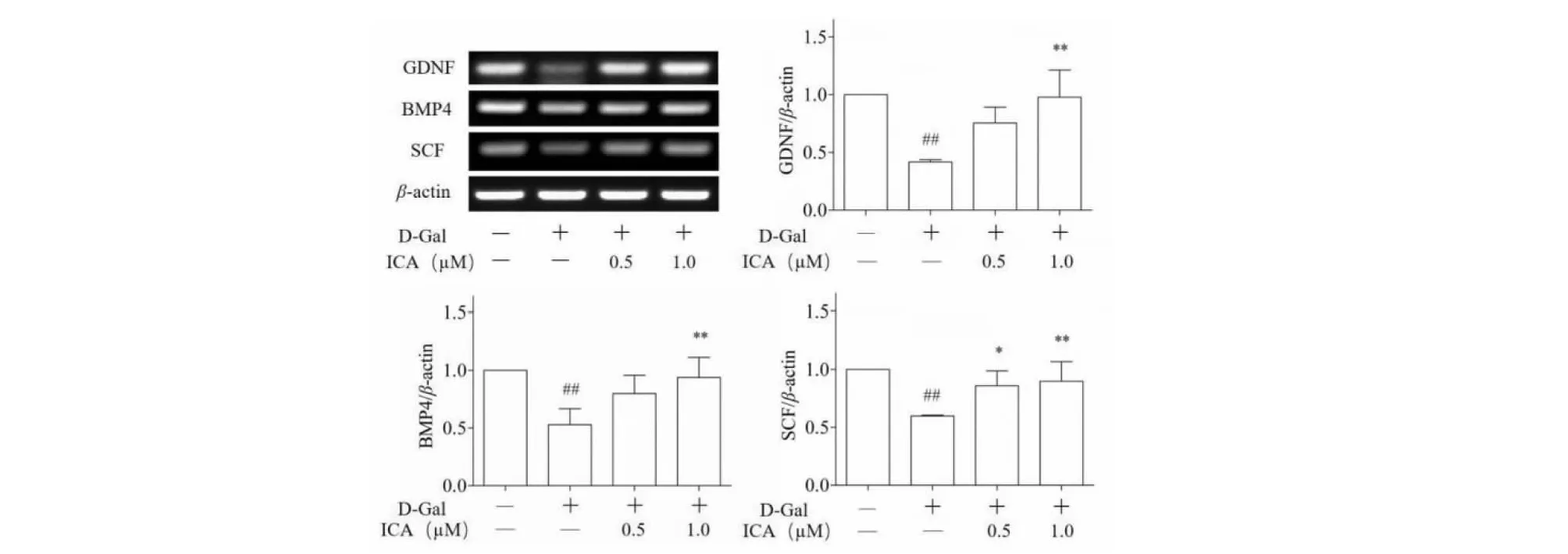
图3 ICA对15P-1细胞相关因子GDNF、BMP4和SCF mRNA水平的影响
2.4 ICA对15P-1细胞相关因子GDNF、BMP4和SCF蛋白表达水平的影响
结果如图4所示,与对照组相比,D-Gal处理组15P-1细胞因子GDNF、BMP4和SCF蛋白水平均显著下调,而ICA干预后可显著升高GDNF、BMP4和SCF蛋白水平,提示ICA可以改善D-gal所致15P-1细胞功能下降。
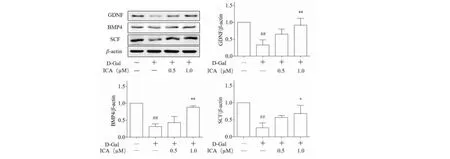
图4 ICA对15P-1细胞相关因子GDNF、BMP4和SCF蛋白表达水平的影响
2.5 ICA对15P-1细胞紧密连接相关蛋白Occludin和Claudin-1蛋白表达水平的影响
与Control组比较,D-Gal可诱导15P-1细胞Occludin和Claudin-1蛋白水平的显著下调,而ICA则可显著上调Occludin和Claudin-1蛋白水平,提示ICA对D-Gal所致15P-1细胞紧密连接损伤有明显的改善作用,结果见图5。
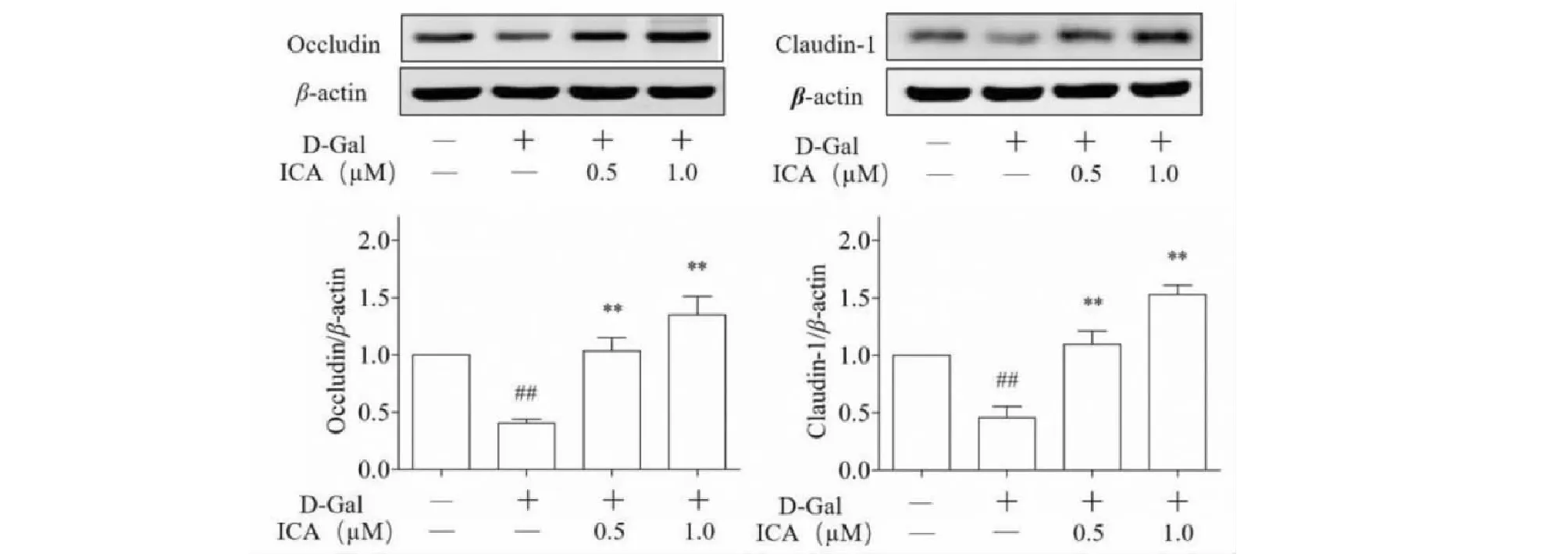
图5 ICA对15P-1细胞紧密连接相关蛋白Occludin和Claudin-1蛋白表达水平的影响
2.6 ICA对15P-1细胞Nrf2信号通路相关蛋白Nrf2、NQO-1和HO-1蛋白表达水平的影响
Western blot结果显示,与正常对照组相比,D-Gal处理组15P-1细胞Nrf2信号通路相关蛋白Nrf2、NQO-1和HO-1蛋白表达水平显著降低,而ICA干预后,15P-1细胞Nrf2信号通路相关蛋白Nrf2、NQO-1和HO-1蛋白表达水平均显著上升(见图6)。
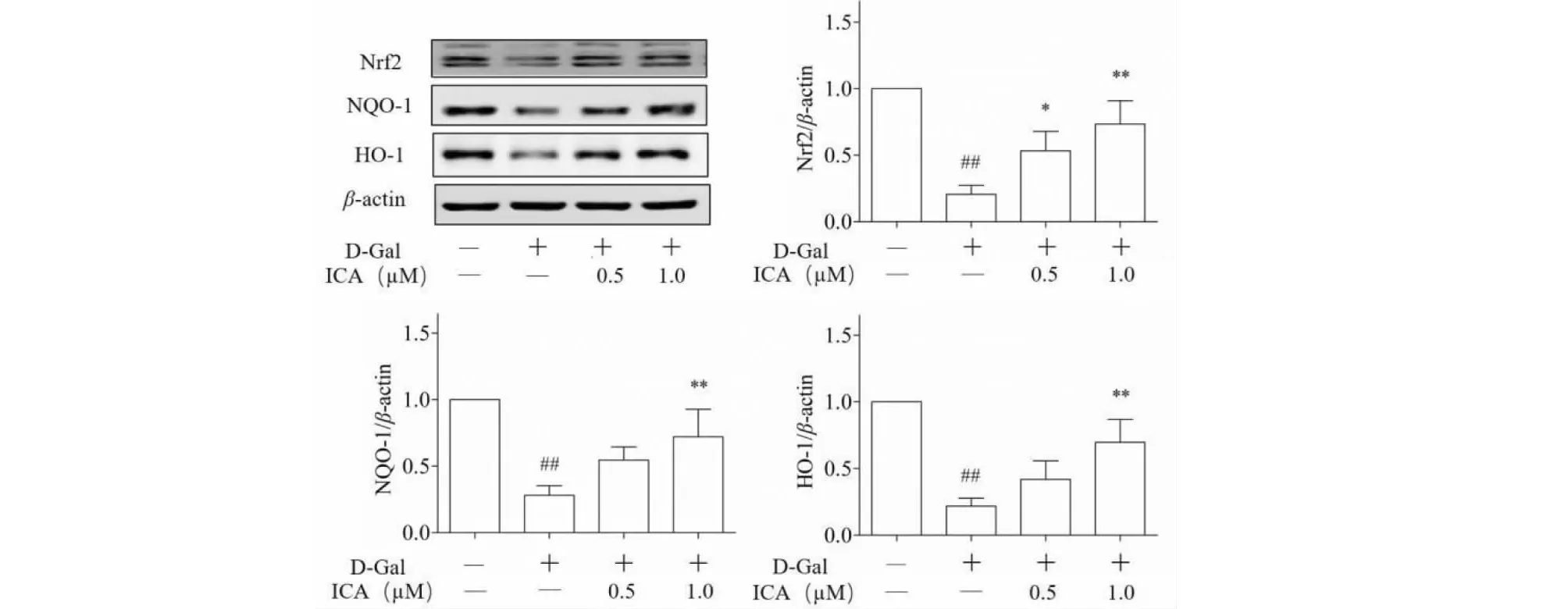
图6 ICA对 Nrf2信号通路相关蛋白Nrf2、HO-1和NQO-1的蛋白表达水平的影响
2.7 ICA对15P-1细胞中Nrf2表达及定位的影响
结果如图7所示,与对照组相比,D-Gal处理组胞核内Nrf2蛋白表达水平明显降低,而给予ICA干预后,胞核内Nrf2蛋白表达水平明显上升。
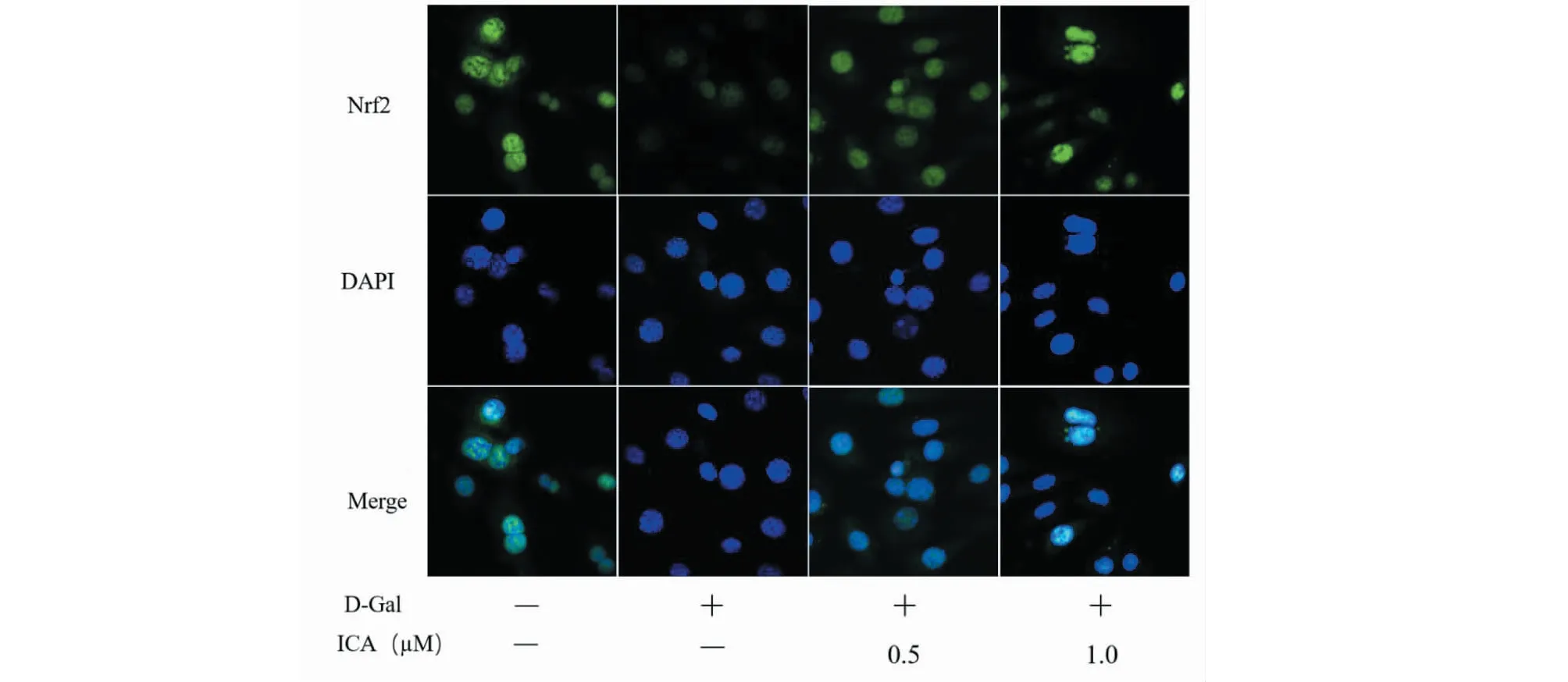
图7 ICA对15P-1细胞中Nrf2表达及定位的影响
3 讨论
近年来,不育已被WHO确认为一个公共卫生问题,在普通人群中发病率逐年增高,影响了全球约15%的育龄期夫妇[1]。调查研究显示,在美国以及其他西方国家中,精子数量每年减少1.5%,据估计,全球近7 000万对夫妇已成为不育症或不育症的受害者[10]。在WHO进行的一项大型流行病学调查发现,约有一半的夫妇不育是由男性因素造成的,而其机制尚不十分清楚[11]。
研究发现,D-Gal可使小鼠支持细胞系TM4细胞数量减少,细胞功能下降[12]。因此,我们选择D-Gal模型来评估ICA是否能减轻15P-1细胞损伤。有文献报道,35、70、140 μM ICA处理血管内皮细胞ECV-304后,细胞抑制率为1.2%,无明显细胞毒性。本实验MTT结果显示,与对照组相比,ICA单独处理15P-1细胞时,浓度为40 μM时IC50大于50%,提示ICA无明显细胞毒性。本课题组前期研究发现,ICA对D-Gal处理TM4细胞损伤有保护作用,且在0.5和1 μM浓度下有明显促增殖作用[13]。而本实验MTT结果也显示,与D-Gal处理组相比,ICA在0.125~1 μM以浓度依赖方式增加细胞存活率,在0.5和1 μM浓度下有明显促细胞增殖作用,ICA浓度大于1 μM时促增殖作用较前减弱,可能是由于本实验中D-Gal刺激15P-1细胞时间较长,细胞损伤较重,损伤的细胞对药物刺激的敏感性大大增加,从而表现出低浓度促进,高浓度抑制的现象。
睾丸支持细胞是定位于睾丸生精小管内与生精细胞直接相连的体细胞,通过分泌多种细胞因子如GDNF、BMP4及SCF等,调节精原干细胞的增殖分化,促进精子形成。GDNF是转化生长因子β超家族的一员,是调节精原干细胞增殖的重要因子,在雄性动物生殖细胞发育和睾丸早期发育中发挥重要作用。BMP4和SCF是促进精原干细胞分化的重要因子[14]。本课题组前期研究显示,淫羊藿总黄酮可上调自然衰老大鼠睾丸支持细胞分泌因子GDNF、BMP4及SCF mRNA和蛋白水平,改善支持细胞分泌功能[15]。结果显示,与对照组相比,D-Gal处理后支持细胞分泌因子mRNA及蛋白表达水平均显著下降,而给予ICA后15P-1支持细胞分泌因子mRNA及蛋白表达水平均显著上调。提示ICA能改善15P-1睾丸支持细胞的分泌功能。
支持细胞间紧密连接是血睾屏障最重要的组成部分,主要包括Occludin、Claudin、黏附蛋白三个跨膜蛋白家族及闭锁连接胞浆蛋白家族[16],细胞间紧密连接不仅可以保护生殖细胞不受免疫系统的侵害,给精子发生提供一个良好的生理环境,而且还允许前细线期精母细胞和后细线期精母细胞规律的通过血睾屏障,以便进一步发育[17]。研究发现,Occludin和Claudin是最早被鉴定的紧密连接整膜蛋白[18],而紧密连接能力和上皮屏障功能主要由Claudins介导。另有研究显示,在大鼠睾丸内注射合成的Occludin肽,可在27天后可逆的消融大部分精原细胞,而在体外敲除Occludin也会导致支持细胞紧密连接功能下降[19]。本实验结果显示,与对照组相比,D-Gal处理后15P-1细胞的紧密连接蛋白表达下降,而给予ICA后15P-1支持细胞紧密连接蛋白表达显著上调。提示ICA对15P-1支持细胞紧密连接蛋白损伤有保护作用。
机体处于正常状态下,Kelch样环氧氯丙烷相关蛋白-1(Kelch-like ECH-associated protein1,Keap1)募集Nrf2,在细胞质中形成一种复合物经泛素蛋白酶降解;当发生氧化应激时Nrf2与Keap1解离,Nrf2由胞质转移至胞核结合ARE,激活下游HO-1和NQO1等大量保护性基因的转录,进而抵抗各种刺激对机体产生的氧化应激损伤[20]。本课题组前期研究显示,ICA可通过激活Nrf2/HO-1信号通路,减轻自然衰老大鼠睾丸DNA损伤,改善衰老所致的生殖功能衰退,提示ICA改善生精功能障碍可能与Nrf2信号通路有关。前期研究显示,ICA可改善D-Gal诱导的睾丸支持细胞株TM4细胞损伤。因此,本研究采用Western blot法检测Nrf2通路蛋白,研究结果显示,与对照组相比,D-Gal刺激后15P-1细胞内Nrf2通路重要蛋白Nrf2、HO-1和NQO-1的表达水平均显著下调,而给予ICA后均显著上升。随后我们采用免疫荧光技术进一步检测了Nrf2的表达及定位,与正常对照组相比,D-Gal处理组15P-1细胞中胞核内Nrf2荧光表达减弱,而给予ICA后有所改善。以上结果提示,15P-1细胞功能和结构损伤与Nrf2信号通路下调进而导致细胞抗氧化能力下降有关,而ICA可能通过提高15P-1细胞抗氧化能力进而改善其损伤。
综上所述,ICA可以通过激活Nrf2信号通路,上调15P-1细胞分泌相关蛋白GDNF、BMP4和SCF及紧密连接相关蛋白Occludin和Claudin-1的表达水平,进而改善D-Gal诱导的15P-1细胞损伤。本实验为我们后续研究ICA对生殖细胞的保护作用及其机制奠定了一定的理论基础,以期更好的发掘中草药淫羊藿在生殖系统中的应用价值,同时为临床上治疗男性不育症提供了新的方向。
