鸡骨常山根中的一个新吲哚生物碱
2021-05-11段云凤马燕华杨春菊尹俊林曾广智
赖 奇,段云凤,马燕华,杨春菊,庄 敏,吕 典,尹俊林,曾广智
云南民族大学民族医药学院 民族药资源化学国家民委教育部重点实验室,昆明 650500
夹竹桃科(Apocynaceae)是热带区植物主要类型之一,全世界大约有250属,2 000余种,广泛分布在亚热带与热带地区。鸡骨常山(AlstoniayunnanensisDiels)为夹竹桃科鸡骨常山属直立灌木。该属植物还有大叶糖胶树,岩生羊角棉,糖胶树,黄花羊角棉,羊角棉[1]。其中鸡骨常山为中国特有种,主要分布于云南省[2],贵州省,广西等地。民间常用其根治头痛、发热、降压,外用具有消肿的作用。鸡骨常山化学成分主要为单吲哚类生物碱,如利血平、蛇根精、霹雳萝芙因等[3-7]。宫颈癌为威胁女性健康的重要疾病,是人类面临的重大公共安全卫生问题[8]。天然产物中不乏抗肿瘤药物的明星分子,如紫杉醇类、长春花类化合物[9]。本课题组,在前期的调查研究中发现,鸡骨常山根的总碱具有一定的抗肿瘤作用[10,11],为了从中发掘活性较好的单体化合物,我们对鸡骨常山的根部开展了化学成分研究。
1 仪器与材料
1.1 仪器和试剂
核磁共振仪BrukerAV400MHz(Bruker,美国);1810傅里叶(KBr压片)变换红外光谱仪(尼高力,美国);X-4显微熔点测试仪(巩义市予华仪器有限责任公司,中国);Autopol V plus鲁道夫高精度旋光仪(鲁道夫,美国);Sephadex LH-20凝胶柱色谱(GE Healthcare,美国);柱色谱级使用硅胶(100~200、200~300、300~400目)及GF254 薄层色谱硅胶板(青岛海洋化工厂,中国);Waters AutoSpec Premier P776高分辨磁质谱仪(Waters,美国);提取和分离过程中所涉及到的化学试剂均为分析纯(上海科技股份有限公司,中国)。Thermo Scientific 3425二氧化碳细胞培养箱(Thermo Scientific,美国);Molecular devices Spectra Maxi3x 型酶标仪(Molecular devices,美国),Agilent 6420 三重四极杆LC-MS(Agilent,美国);DMEM高糖完全培养基、胎牛血清(FBS)、谷氨酰胺Glutamine均购买于(Biological Industries,以色列);磺罗丹明B(SRB)(上海阿拉丁试剂有限公司,中国)。
1.2 材料
药材鸡骨常山产自云南临沧市永德县,经昆明采智公司采集植物样品并进行鉴定,植物标本保存于云南民族大学民族药资源化学国家民委-教育部重点实验室。细胞Hela(人宫颈癌细胞)源至于中国科学院的上海细胞库。
2 实验方法
2.1 提取与分离
干燥的鸡骨常山根2.91 kg,经过粉碎加工后,用95%工业甲醇冷浸提取3次。将3次甲醇提取液通过减压浓缩合并,得到根部的浸膏为150 g。将该浸膏混悬于适量的水中,先用适量分析纯石油醚萃取得到石油醚部分15 g,后用冰醋酸将混悬液体调至pH为3~4,使用分析纯的乙酸乙酯萃取得到A部分32 g,再用氨水将萃取后的混悬液调至pH为10左右,分析纯乙酸乙酯萃取得到B部分为7.2 g。将B部分用60~100目硅胶50 g拌样然后进行硅胶柱正向柱色谱,洗脱剂的梯度系统为石油醚-乙酸乙酯(50∶1)至纯乙酸乙酯再到二氯甲烷-甲醇(50∶1)到纯甲醇,TLC检测后合并极性大概相同组分,合并后得到了5个组分,分别标记为Fr.1~Fr.5。取Fr.1部分(1.2 g)用正相硅胶柱进行色谱分离,按照石油醚-乙酸乙酯(30∶1→10∶1)作为流动相梯度洗脱,每200 mL一个馏分,经TLC检测后合并展板位置相同组分,得到化合物2(120 mg)。Fr.2经正相硅胶柱及Sephadex LH-20色谱分离,再进一步经硅胶柱色谱柱分离纯化得化合物5(100 mg)。Fr.3部分纯甲醇溶解经纯甲醇体系凝胶分离后,再用硅胶柱色谱分离,流动相为乙酸乙酯,得化合物3(400 mg)。Fr.4部分用硅胶色谱分离,流动相为氯甲(50∶1→10∶1),再经过HPLC甲醇-水(50∶50→40∶60)30 min得到化合物1(23 mg)和化合物4(12 mg),见图1。
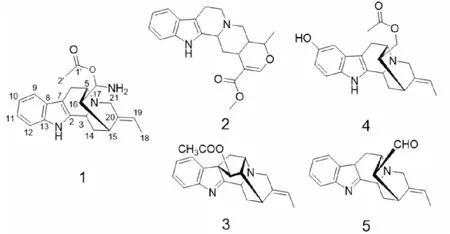
图1 鸡骨常山中分离得到的化合物
2.2 抗肿瘤活性筛选
选择对数生长期的Hela细胞,用含10% FBS的DMEM培养基制成悬液,每孔5 000细胞均匀接种于96孔板板中,每孔体积100 μL,培养24 h至细胞完全贴壁。将分离得到的化合物用DMSO配置成10 mM的储备液,细胞贴壁后每孔加入相应浓度待测化合物继续培养48 h。完成培养后,每孔添加20%三氯乙酸25 μL在4 ℃冰箱固定1 h,去除固定液,室温1%磺酰罗丹明B(SRB)染色1 h,1%醋酸清洗96孔板4次,自然风干24 h后每孔添加10mM的Tris溶液100 μL至完全溶解,然后在多功能酶标仪490~520 nm波长处检测其OD值,并用GraphPad Prism 8对数据进行统计分析,并作出图表。实验独立重复3次,每组6个副孔。
3 实验结果
3.1 化合物结构鉴定
化合物1白色固体(甲醇),HR-ESI-MS:m/z352.201 9[M+H]+(calcd for C21H26N3O2,352.202 0),推测该化合物分子式为C21H25N3O2,不饱和度为11;熔点为278~282 ℃;旋光度为0。IR(KBr):3 413、2 361、1 638、1 618、1 400、1 262、1 121、1 067、953、617、515 cm-1;红外光谱显示该化合物含有氨基(3 413 cm-1)和酯羰基官能团(1 638 cm-1),吲哚环(1 618、1 400 cm-1)。化合物1的13C NMR和DEPT谱显示该物质含有21个碳,分别为2个甲基(其中一个为乙酰基上的甲基δ22.8,一个末端甲基信号δ12.9),3个亚甲基(δ28.3、34.6、56.5),10个次甲基(δ28.6、46.8、51.5、57.0、76.6、111.9、118.3、118.7、119.8、122.1),6个季碳(δ104.2、128.7、130.3、135.0、138.6、173.3)。化合物1与文献报道的vellosiminol[12]相比较,两者波谱数据极为相似,具有单萜吲哚生物碱的特征,推测该化合物为一个具有(5、15)桥环单萜吲哚生物碱;这两个化合物不同之处在于∶化合物1在C-17上连接有一个乙酰基(δ173.3、22.8)和一个氨基(IR:3 413 cm-1),根据Scifinder检索,推测该化合物为新的单萜吲哚生物碱。由于提取分离过程中使用了氨水和乙酸,同时天然产物中氮氧杂缩醛类化合物较少[13,14],因此推测化合物1可能为分离过程中化合物5和氨水乙酸反应得到的产物。
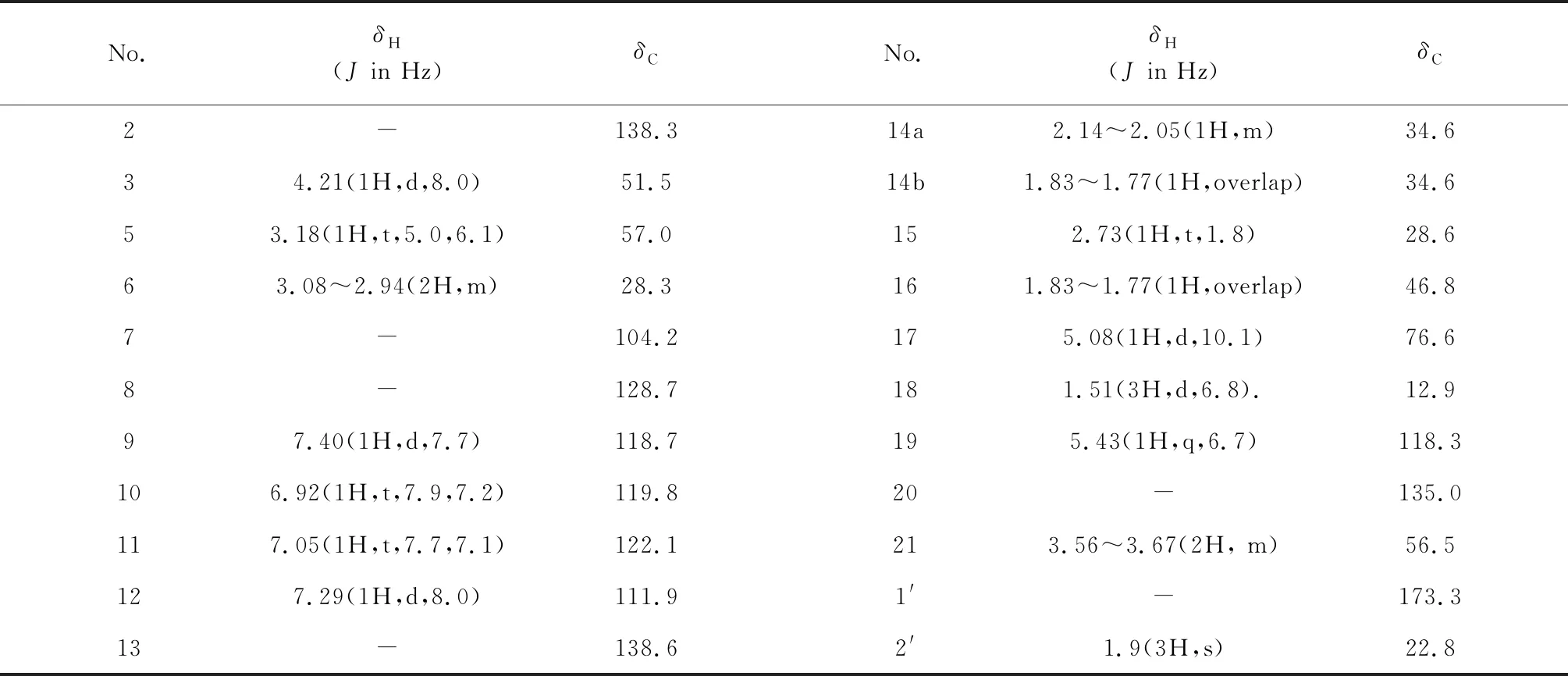
表1 化合物1的NMR数据(400 MHz,CDCl3)
在化合物1的1H-1HCOSY谱中(图2),H3-18与H-19相关说明C-18与C-19相连接;H-17与H-16相关说明C-17和C-16相连。而H2-14与H-3和H-15相关,说明C-3,C-14和C-15彼此相连。H-5与H2-6相关,说明C-5与C-6相连。H-16与H-5和H-15相关,说明C-16与C-15和C-5相连。在化合物1的HMBC谱中(图2),H3-18(δ1.5)甲基质子信号与季碳C-20(δ135.0)和C-19(δ118.3)信号相关,说明C-18与C-19和C-20彼此相连接;H3-2′(δ1.5)甲基质子信号和羰基碳C-1′(δ173.3)信号相关,说明C-2′和C-1′相连接。H-17(δ5.0)信号与C-1′(δ173.3)信号相关,说明C-17通过氧原子与C-1′相连。H-17(δ5.0)信号还与C-16(δ46.8)信号相关说明C-17和C-16相连。H-9(δ7.4)信号与次甲基信号C-8(δ138.6)、C-7(δ104.2)信号相关,所以C-9和C-8相连,C-8和C-7相连。为了确定化合物1相对立体构型,测定了化合物1的NOESY相关图谱(图2),在化合物1的NOESY相关图谱(图2)中,H-3与H-15相关,H-3与H-16相关,H-16与H-15相关,说明这些质子朝向相同,定义为β构型,H-5和H-15或H-3无直接相关,因此H-5朝向定义为α构型,这种结构,环系张力最小。H-19的耦合常数为6.7,化合物vellosiminol[12]耦合常数为7,两者几乎一致,说明该烯烃(C-19、C-20)为顺式构型。化合物1的详细结构鉴定数据原始图谱可从本刊官网免费下载(www.trcw.ac.cn)。
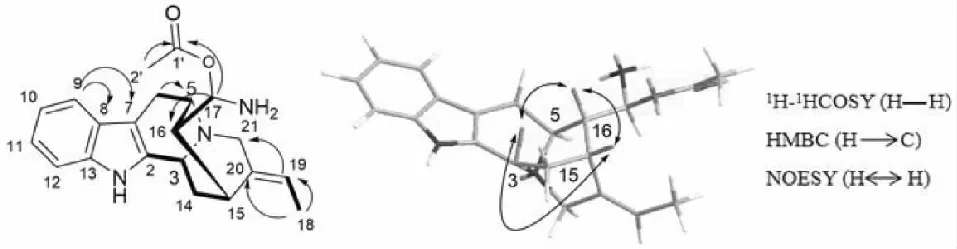
图2 化合物1的主要1H-1H COSY、HMBC、NOESY相关
化合物2白色或微黄色固体;分子式C21H24N2O3,ESI-MS:m/z352[M]+;1H NMR(400 MHz,CDCl3)δ:7.90(1H,s,N-H),7.57(1H,s,H-17),7.44(1H,d,J= 7.6 Hz,H-9),7.20(1H,d,J= 7.6 Hz,H-12),7.14~7.05(2H,m,H-10,11),4.53~4.47(1H,m,H-19),3.75(3H,s,H-23),3.35(1H,d,J= 11.5 Hz,H-3),3.11(1 H,dd,J= 12.3,1.9 Hz,H-21),2.99~2.88(6H,overlap,H-5,6,15,21),2.58~2.50(2H,overlap,H-5,14),1.70(1H,m,H-20),1.54(1H,dd,J= 24.6,12.1 Hz,H-14),1.41(3H,d,J= 6.2 Hz,H-18);13C NMR(400 MHz,CDCl3)δ:168.0(C-22),155.8(C-17),135.9(C-13),134.5(C-2),127.1(C-8),121.3(C-11),119.3(C-10),118.0(C-9),110.8(C-12),109.5(C-16),108.0(C-7),72.5(C-19),59.8(C-3),56.2(C-21),53.5(C-5),51.2(C-23),38.3(C-20),34.1(C-14),31.4(C-15),21.7(C-6),18.5(C-18)。以上数据与文献报道一致[15],鉴定其为tetrahydroalstonine。
化合物3透明油状;分子式C21H22N2O2,ESI-MS:m/z335[M+H]+,1H NMR(400 MHz, CDCl3)δ:7.62(1H,d,J= 7.7 Hz,H-9),7.45(1H,d,J= 6.9 Hz,H-12),7.39(1H,td,J= 7.7,1.3 Hz,H-11),7.22(1H,td,J= 7.5,1.0 Hz,H-10),5.31(1H,q,J= 6.7 Hz,H-17),2.17(3H,s,H-16),1.67(3H,d,J= 6.7 Hz,H-23);13C NMR(400 MHz,CDCl3)δ:183.7(C-3),169.9(C-22),156.6(C-13),137.9(C-8),136.4(C-18),128.6(C-11),125.4(C-10),123.8(C-9),120.9(C-12),115.6(C-17),77.7(C-7),64.4(C-3),58.03(C-20),56.1(C-21),54.1(C-19),49.0(C-5),37.3(C-6),27.5(C-15),26.4(C-14),21.1(C-23),12.9(C-16)。以上数据与文献报道一致[16],鉴定其为vinorine。
化合物4白色固体;分子式C21H24N2O3,ESI-MS:m/z353[M+H]+,1H NMR(400 MHz, DMSO-d6)δ:10.46(1H,s,Ar-OH),8.54(1H,s,N-H),7.06(1H,d,J= 9.1 Hz,H-12),6.67(1H,d,J= 2.0 Hz,H-9),6.51(1H,dd,J= 9.0,2.1 Hz,H-11),3.94(2H,d,J= 10.1 Hz,H-17),1.98(3H,s,H-23),1.53(3H,d,J= 7.1 Hz,H-18);13C NMR(400 MHz,DMSO-d6)δ:170.3(C-22),150.2(C-10),139.8(C-20),136.4(C-2),130.5(C-13),127.8(C-8),115.5(C-19),111.2(C-12),110.0(C-11),101.8(C-7),101.7(C-9),65.5(C-17),55.3(C-21),53.6(C-5),49.5(C-3),40.5(C-16),33.0(C-14),27.4(C-15),26.4(C-16),20.6(C-23),12.3(C-18)。以上数据与文献报道的一致[17],鉴定其为17-acetylsarpagine。
化合物5白色固体:分子式C19H20N2O,ESI-MS:m/z292[M]+,1H NMR(400 MHz, DMSO-d6)δ:10.86(1H,s,H-N),9.57(1H,s,H-17),7.45(1H,d,J= 8.1 Hz,H-9),7.34(1H,d,J= 8.1 Hz,H-12),7.16(1H,J= 7.4 Hz,H-11),7.10(1H,J= 7.2 Hz,H-10),5.31(1H,J= 6.8 Hz,H-19),4.31(1H,d,J= 9.9 Hz,H-3),3.62(1H,d,J= 17.0 Hz,H-21),3.50(1H,d,J= 16.7 Hz,H-21),3.44~3.48(1H,m,H-5),3.22(1H,d,J= 3.0 Hz,H-5),2.62(1H,d,J= 15.6 Hz,H-5),2.57(1H,d,J= 7.6 Hz,H-16),2.15(1H,t,J= 10.8,1.3 Hz,H-14),2.13(1H,td,J= 11.5,1.5 Hz,H-15),1.87(1H,d,J= 11.8 Hz,H-14);13C NMR(400 MHz,DMSO-d6)δ:203.1(C-17),139.1(C-2),136.1(C-13),135.9(C-20),127.0(C-8),120.3(C-11),118.2(C-10),117.4(C-9),115.2(C-19),111.0(C-12),102.1(C-8),55.1(C-16),54.4(C-16),49.8(C-5),49.5(C-1),32.7(C-14),26.8(C-6),26.3(C-15),12.3(C-18)。以上数据与文献报道一致[18],鉴定其为vellosimine。
3.2 体外肿瘤细胞毒活性筛选
本实验对化合物1~5进行了细胞毒活性的筛选,细胞毒活性检测采用黄酰罗丹明B(SRB)染色法进行测定,测试细胞株为Hela。在100 μmol/L浓度下进行初筛,化合物1、2、4无明显细胞毒性,而3、5具有较强的细胞毒性,抑制率分别为60.3%±2.5%和85.3%±4.5%,喜树碱为阳性对照浓度为5 μmol/L。为进一步验证3、5的细胞毒性,对3、5进行细胞毒活性实验,实验结果表明化合物3、5对Hela细胞具有一定的细胞毒性,化合物3IC50为89.4±1.2 μmol/L,化合物5IC50为15.6±0.7 μmol/L,阳性药物喜树碱IC50为5.21±1.3 μmol/L。
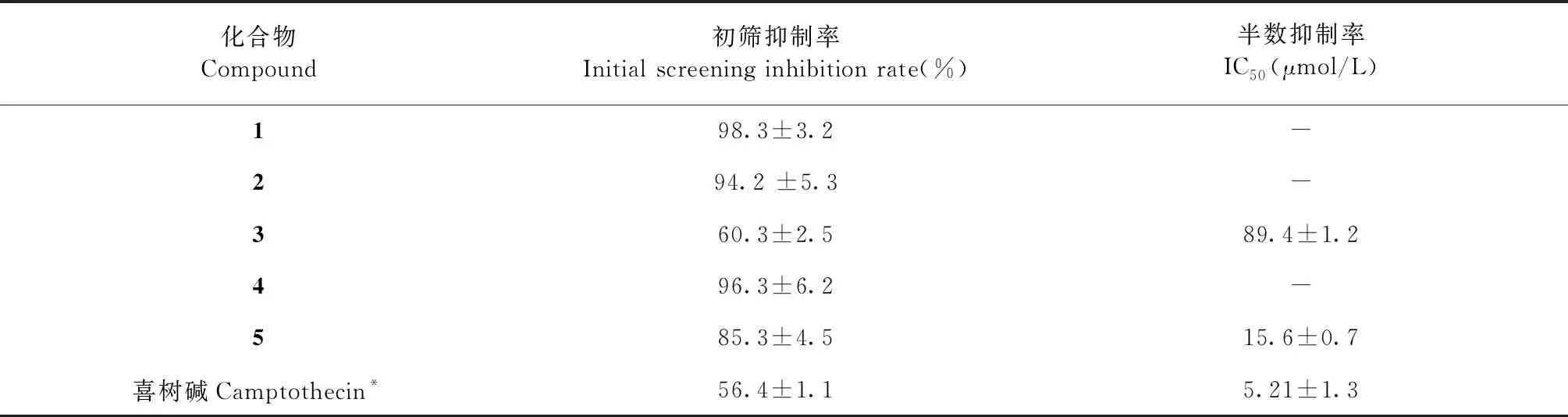
表2 鸡骨常山单体化合物对Hela细胞株毒活性
4 讨论与结论
本次研究从鸡骨常山根的乙酸乙酯萃取B部分分离得到5个单萜吲哚生物碱,其中化合物1为新的吲哚单萜生物碱,化合物3、5磺酰罗丹明B染色法[19]结果显示对宫颈癌细胞存在一定程度的细胞毒性及抗肿瘤活性,化合物3对坐骨神经损伤具有一定治疗作用[20],本研究一定程度上丰富了该属植物的化学成分及其活性的研究内容。宫颈癌为近年来对女性生命健康危害较大的一种疾病,因此找到有效的治疗药物,研究清楚其机理尤为关键,下一步拟针对各化合物进一步开展相关的生物活性及机理研究。综上所述,本研究确定了鸡骨常山根具有抗肿瘤活性的吲哚生物碱,对其化学成分展开研究具有一定应用价值,将天然产物与疾病治疗联系起来,对天然产物开发与研究具有一定的帮助。
