HIF-2α表达对低氧环境下胃癌细胞增殖、凋亡和细胞周期的影响
2021-04-28郭培玲闫兰芳陈双艳赵富锋
郭培玲,马 铭,闫兰芳,陈双艳,赵富锋,陈 蓉
四川省成都市双流区第一人民医院/四川大学华西空港医院医学检验科,四川成都 610200
胃癌是最常见的恶性肿瘤之一,每年约有100万新发胃癌病例,病死率在恶性肿瘤中位居第二[1]。作为典型的实体肿瘤之一,胃癌能够在短期内快速增长导致肿瘤组织内部存在缺血、缺氧区[2]。局部缺氧是胃癌发生发展的重要环节,肿瘤细胞在缺氧环境下形成一系列补偿机制以适应低氧微环境,从而促进肿瘤增长[3-4]。在胃癌适应缺氧的补偿机制中,缺氧诱导因子-α(HIF-α)起主导作用,其中作用最显著的是HIF-1α和HIF-2α[5]。HIF-1α及HIF-2α的阳性表达均能够通过诱导局部缺氧环境的形成,加剧癌细胞核DNA的转录速度,提高癌细胞的浸润和黏附能力[6]。现有的研究主要报道了HIF-2α在如小细胞肺癌[7]、结肠癌[8]、肝癌[9]等癌症中的作用。有关HIF-2α在胃癌中的研究相对较少。因此,本文旨在应用特异性HIF-2α小干扰RNA(siRNA)下调低氧诱导下胃癌细胞BGC823中HIF-2α的表达,探讨HIF-2α对低氧环境下胃癌BGC823细胞增殖、凋亡和细胞周期的影响,为胃癌分子靶向治疗提供试验基础。
1 材料与方法
1.1材料来源 人胃癌细胞株BGC823购自中国科学院上海生科院细胞资源中心;RPMI1640细胞培养基、胎牛血清及0.25%胰蛋白酶购自美国Gibco公司;HIF-2α siRNA由上海吉玛股份有限公司设计并合成;Lipo 6000转染试剂、Trizol RNA提取试剂盒、CCK-8分析试剂盒和Annexin Ⅴ-FITC/PI双染试剂盒购自上海碧云天生物技术有限公司。
1.2方法
1.2.1细胞低氧培养 胃癌BGC823细胞置于含10%胎牛血清的RPMI1640培养液(37 ℃培养箱,5%的CO2)培养,胰酶消化传代。低氧环境采用200 μmol/L 氯化钴(CoCl2)诱导,细胞于低氧环境中培养24 h后收集用于检测。
1.2.2细胞转染与分组 细胞低氧诱导培养后,细胞融合度达到85%左右时,在Lipo 6000脂质体介导下转染细胞。试验分为3组,即BGC823常氧培养组,BGC823低氧诱导组与BGC823(HIF-2α-/-)低氧诱导组。
1.2.3RT-PCR检测HIF-2α mRNA表达 收集转染48 h后的各组细胞,按照 Trizol RNA提取试剂盒说明书步骤操作,逆转录成cDNA,RT-PCR方法检测各组细胞中HIF-2α mRNA表达。试验均重复检测3次,计算Ct值,采用2-ΔΔCt法进行计算分析。
1.2.4CCK-8法检测细胞增殖 取对数生长期的细胞消化后制备成细胞悬液,以2×104/mL密度接种于96孔板,每孔100 μL,贴壁过夜。每组各设6个复孔,在培养24、36、48、60、72 h后,每孔加入10 μL CCK-8溶液,孵育3 h,酶标仪测定450 nm处的吸光度值(A450 nm),绘制细胞生长曲线分析细胞增殖情况。
1.2.5PI单染检测细胞周期 收集各组对数生长期细胞,用细胞筛过滤,磷酸缓冲盐溶液(PBS)洗涤2次,计数1×105个细胞,加入75%预冷乙醇4 ℃固定过夜,加入5 μL PI染色液,轻摇10 min避光混匀后,上流式细胞仪进行周期变化检测。
1.2.6Annexin Ⅴ-FITC/PI双染检测细胞凋亡情况 收集各组对数生长期细胞,用细胞筛过滤,PBS洗涤2次,计数2×105个细胞,加入0.3 mL Binding buffer重悬细胞,再加入5 μL Annexin Ⅴ-FITC和5 μL PI,避光温育15 min,加入400 μL×Binding buffer,流式细胞仪检测凋亡细胞的百分比。
1.2.7免疫印迹法(Western blot)检测各组细胞中HIF-2α蛋白的表达情况 收集对数生长期细胞,裂解细胞提取总蛋白,二喹啉甲酸(BCA)法对蛋白进行定量,100 ℃下变性5 min。将样本等量上样至12%的SDS-PAGE凝胶,电泳分离蛋白后恒流转至PVDF膜,5%脱脂乳粉封闭2 h,分别加入稀释的一抗4 ℃振荡孵育过夜,TBST漂洗后室温振荡孵育二抗60 min,ECL试剂盒显色,凝胶成像分析仪扫描,计算灰度值,比对各组HIF-2α蛋白的表达情况。
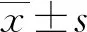
2 结 果
2.1低氧诱导HIF-2α基因和蛋白的表达 RT-PCR结果显示,BGC823常氧培养组中细胞在常氧环境下有少量HIF-2α mRNA和蛋白表达。BGC823低氧诱导组中细胞在CoCl2诱导的低氧环境下HIF-2α mRNA和蛋白表达显著上调,与BGC823常氧培养组比较,差异有统计学意义(P<0.05)。BGC823(HIF-2α-/-)低氧诱导组中特异性转染HIF-2α siRNA后细胞在低氧环境下HIF-2α mRNA和蛋白表达显著下调,与BGC823低氧诱导组相比差异有统计学意义(P<0.05)。BGC823常氧培养组与BGC823(HIF-2α-/-)低氧诱导组比较,HIF-2α mRNA和蛋白表达差异无统计学意义(P>0.05)。见图1。
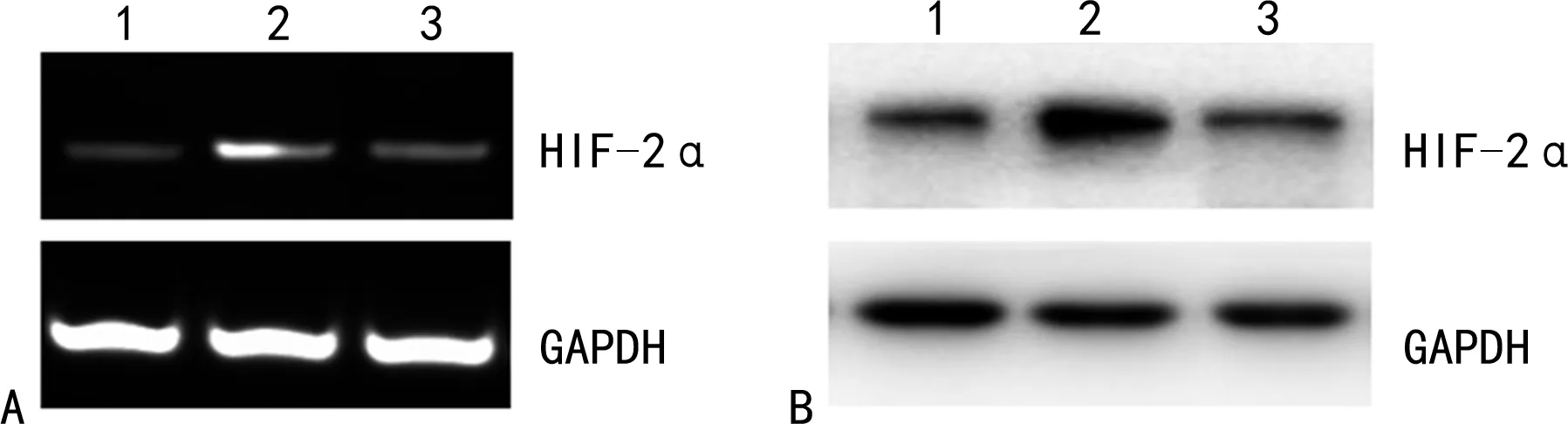
注:1为BGC823常氧培养组;2为BGC823低氧诱导组;3为BGC823(HIF-2α-/-)低氧诱导组。A为RT-PCR法检测各组细胞中HIF-2α mRNA的表达情况;B为Western blot检测各组细胞中HIF-2α蛋白的表达情况;GAPDH为甘油醛-3-磷酸脱氢酶。
2.2各组BGC823细胞的增殖情况 CCK-8法检测结果显示,与BGC823常氧培养组相比,BGC823低氧诱导组细胞在24、36、48、60、72 h时间点的A450 nm均显著升高(P<0.01)。与BGC823低氧诱导组相比,BGC823(HIF-2α-/-)低氧诱导组对应时间点的A450 nm均显著降低(P<0.05)。BGC823(HIF-2α-/-)低氧诱导组与BGC823常氧培养组相比,差异无统计学意义(P>0.05)。见图2。

注:A为BGC823常氧培养组;B为BGC823低氧诱导组;C为BGC823(HIF-2α-/-)低氧诱导组;与BGC823常氧培养组比较,**P<0.01。
2.3各组BGC823细胞在细胞周期中G2期细胞所占比例 流式细胞仪检测结果显示,BGC823常氧培养组细胞周期中G2期细胞占比为23.73%,BGC823低氧诱导组细胞G2期细胞占比为20.25%,两组差异有统计学意义(P<0.05)。BGC823(HIF-2α-/-)低氧诱导组细胞G2期细胞占25.52%,明显高于BGC823低氧诱导组(P<0.05)。
2.4各组BGC823细胞的凋亡情况比较 流式细胞仪检测结果显示,与BGC823常氧培养组相比,BGC823低氧诱导组细胞凋亡比例显著降低(P<0.05)。与BGC823低氧诱导组相比,BGC823(HIF-2α-/-)低氧诱导组细胞凋亡比例显著升高(P<0.05)。BGC823(HIF-2α-/-)低氧诱导组与BGC823常氧培养组相比,差异无统计学意义(P>0.05)。见图3。
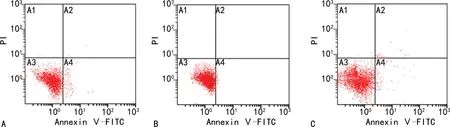
注:A为BGC823常氧培养组;B为BGC823低氧诱导组;C为BGC823(HIF-2α-/-)低氧诱导组。
3 讨 论
胃癌是我国最常见的消化道恶性肿瘤之一,据统计胃癌居全球恶性肿瘤发病率的第5位,病死率居第3位,在亚洲胃癌病死率仅次于肺癌,给患者带来巨大的卫生经济负担[10]。 由于胃癌起病比较隐匿、无明显特异性症状,缺乏精准的早期诊断技术,在发现时常常已是中晚期,晚期胃癌患者5年生存率仅为5%~17%,严重影响了人类的生命健康[11]。目前,外科手术和放化疗仍然是主要的治疗手段,但是30%~40%的胃癌患者在初诊时就失去了根治手术的机会,长期使用化疗药物又普遍出现耐药现象,导致整体治疗效果有限。因此,深入探索胃癌发生、发展的相关机制,有助于寻求新的诊断、预防及治疗策略。
胃癌属于实体瘤,在肿瘤细胞快速增殖与血管新生滞后等多重因素共同作用下,实体瘤内部普遍存在低氧区域。低氧环境可进一步诱导肿瘤细胞产生HIFs,HIFs可通过调控血管内皮生长因子(VEGF)的表达从而诱导肿瘤产生新生血管[12]。HIFs包括HIF-1、HIF-2和HIF-3,其中以HIF-1的研究居多,HIF-2次之。HIF-2是由相关学者克隆出的一种含有bHLH.PAS域的细胞因子,HIF-2α是HIF-2的功能性亚基和活性亚基,包括15个外显子和14个内含子,基因长约120 kb,相对分子质量为96.5×103[13]。缺氧条件可激活HIF-2α的转录活性,参与肿瘤细胞的血管生成、侵袭转移及放化疗抵抗。MIZOKAMI等[14]在研究胃癌及正常胃黏膜上皮组织中HIF-2α mRNA及蛋白的表达时,发现HIF-2α在胃癌组织的表达明显高于正常胃黏膜上皮组织,提示HIF-2α与胃癌关系密切。GRIFFITHS等[15]在研究HIF-2α与胃癌患者预后的关系时,发现HIF-2α在多变量分析中没有独立的预后意义,不能作为一种常规的预后指标。吴友亮等[16]研究发现在胃癌患者中HIF-2α的阳性表达率平均提高45%,且在合并远处转移的患者中,阳性表达率上升更为显著。这些研究已充分证实HIF-2α与胃癌发生、发展关系密切,但是其具体调控机制尚未完全清楚。
在探索HIF-2α与胃癌的信号通路的研究中,WANG等[17]发现JNK抑制剂能够阻断HIF-1α和HIF-2α的表达,提示HIF-2α通过JNK信号通路参与抑制胃癌细胞的侵袭能力。在研究HIF-2α与肿瘤血管生成的关系中,WU等[18]指出在非小细胞肺癌中HIF-2α与VEGF共同主导肿瘤血管生成过程。但SONG等[19]指出缺氧环境下胃癌中VEGF和葡萄糖代谢相关基因表达的是HIF-1α和HIF-1β,而不是HIF-2α。但是,HIF-2α在肿瘤组织和血管内皮的表达比HIF-1α更强烈[20],因此以HIF-2α为靶点的抗癌研究仍然具有深远的价值。
本研究通过模拟胃癌低氧环境,发现BGC823低氧诱导组细胞增殖速度与常氧培养组比较明显升高,低氧环境可显著促进BGC823细胞的HIF-2α蛋白的表达,这与相关研究报道相一致[21]。肿瘤的进展离不开肿瘤细胞的过度增殖和凋亡减弱,并与细胞周期的调控异常有密切关系。细胞周期遵循G1-S-G2-M的发展规律,细胞一旦从G1期跨入S期则不再依靠外来信息刺激而自动完成分裂过程[22]。本研究通过siRNA技术下调BGC823细胞中HIF-2α的表达后能够促进细胞凋亡。与BGC823低氧诱导组相比,BGC823(HIF-2α-/-)低氧诱导组细胞的凋亡比例升高,其机制可能与低氧环境中HIF-2α低表达能够阻滞肿瘤细胞在G2期有关。
综上所述,本研究结果提示HIF-2α表达情况影响低氧环境下胃癌细胞增殖、凋亡和细胞周期。下调HIF-2α表达可通过抑制细胞增殖、促进细胞凋亡,来减缓胃癌的恶性发展。
