低氧在Erastin 诱导的胰腺导管腺癌细胞铁死亡中的作用及其机制
2021-07-29高钦玥吴琪炜魏士杰龚爱华朱海涛王冬青
高钦玥 宋 廉 吴琪炜 魏士杰 刘 赛 龚爱华 朱海涛 王冬青
1.江苏大学附属医院影像科,江苏镇江 212000;2.江苏大学医学院,江苏镇江 212000
铁死亡,2012 年新定义的一种细胞程序性死亡[1],由铁依赖性的磷脂过氧化物堆积引起[2-3]。正常生理条件下,谷胱甘肽过氧化物酶4(glutathione peroxidase 4,GPX4)以还原型谷胱甘肽(glutathione,GSH)为底物将细胞毒性的过氧化脂质转化为无毒的脂醇[4],当小分子化合物Erastin 作用谷氨酸/胱氨酸转运体(XC-系统)时[5-6],抑制胱氨酸转入导致还原型GSH 合成降低并引起GPX4 活性下降[7-8],最终胞内脂质过氧化物不能被及时清除发生铁死亡[9]。胰腺导管腺癌(pancreatic ductal adeno carcinoma,PDAC)已被证实依赖半胱氨酸代谢预防活性氧(reactive oxygen species,ROS)过多诱发的铁死亡,抑制XC-系统药物可能成为临床PDAC 治疗的重要手段[10-11]。但低氧是PDAC 药物治疗抵抗原因之一[12-13],低氧是否引起PDAC 中的Erastin 的耐药及其具体机制仍需验证。本研究将Erastin 用于低氧培养的PDAC 细胞中检测铁死亡指标变化,并探讨低氧通过调控去乙酰酶Sirtuin3(SIRT3)影响铁死亡的机制。
1 材料与方法
1.1 细胞、试剂和仪器
人PDAC 细胞株PANC1,鼠PDAC 细胞panc02(中国科学院上海细胞研究所);DMEM 高糖培养基(SH30243.01),PBS(SH30256.01)购于美国Hyclone 公司;澳洲胎牛血清(10099141)购于美国Gibco 公司;铁死亡挽救剂Ferrostatin-1(HY-100579),坏死挽救剂Necrostatin-1(HY-15760),凋亡挽救剂Z-VAD-FMK(HY-16658B),SIRT3 抑制剂3-TYP(HY-108331),Erastin(HY-15763)购于美国Med Chem Express 公司;引物合成于上海生工公司;6 孔细胞培养板(3516)、96 孔细胞培养板(3599)购于美国Corning 公司;CCK-8试剂盒(CK04)购于日本同仁化学;BCA 蛋白检测试剂盒(23227)购于Thermo Fisher Scientific 公司。多功能酶标仪800 TS 购于美国Bio Tek 公司;倒置荧光显微镜Axio Observer A1 购于蔡司公司;RT-qPCR 仪CFX96 购于美国Bio-Rad 公司;台式离心机购于Thermo Fisher Scientific 公司。
1.2 研究方法
1.2.1 细胞培养 PANC1、panc02 用含10%胎牛血清的高糖DMEM 培养,常规传代,置于37℃、5%CO2细胞培养箱。低氧培养:细胞置于低氧培养盒,充入低氧混合气(1%O2,5%CO2,94%N2,南大恒通气体厂),充气10 min 放入37℃培养箱,隔天换气1 次。
1.2.2 细胞活性检测 取对数生长期PANC1,panc02细胞接种于96 孔板,每组设3 个复孔,每孔2000 个细胞;次日细胞贴壁后,经DMSO 或Erastin(5.0 μmol/L)处理,分别置于常氧和低氧培养条件;72 h 后,吸净上清,将100 μL 培养基添加10 μL 细胞计数试剂-8(cell counting kit-8,CCK8)的混合溶液加入每孔,常氧或低氧孵育1~2 h,酶标仪测定450 nm 处各组的OD 值。其他药物处理浓度分别为Ferrostatin-1(1 μmol/L),Necrostatin-1(1 μmol/L),Z-VAD-FMK(1 μmol/L),SIRT3 抑制剂3-TYP(20.0 nmol/L)。
1.2.3 RT-qPCR 检测SIRT3 mRNA 的表达水平 取对数生长期的PANC1 细胞种于六孔板中,经DMSO 和Erastin(5.0 μmol/L)分别处理后放入常氧和缺氧培养条件,孵育72 h 用TRIzol 试剂提取总RNA,按照试剂盒说明书得到cDNA(K1691,Thermo ScientificTM)。反应条件:95℃5 s,61.7℃30 s,72℃30 s,共40 个循环。SIRT3 引物序列为5’-GCATTCCAGACTTCAGATCGC-3’,5’-GTGGCAGAGGCAAAGGTTCC-3’,以ACTB 基因为内参照(5’-CACCATTGGCAATGAGCGGTTC-3’,5’-AGGTCTTTGCGGATGTCCACGT-3’),每个基因设3 个复孔,使用2-ΔΔCt值计算目的基因的相对表达量。
1.2.4 MDA 和还原性GSH 测定 细胞培养方式和处理时间同“1.2.3”,根据产品说明书使用丙二醛(MDA)检测试剂盒(A003-1,南京建成)和微量还原型GSH(A006-2,南京建成)测定MDA 和还原型GSH 的相对浓度,BCA法测定样品的蛋白浓度。
1.2.5 小鼠模型 C57 老鼠购于江苏大学动物中心,生产许可证号:SCXK(苏)2018-0010,合格证编号:202010408。饲养条件:相对湿度40%,温度26℃,适应性饲养1 周。低氧或常氧预培养72 h 的panc02 细胞(每只5×105细胞)皮下注射到雌性C57 左后侧造模。采用随机数字表法分组(共20 只,每组5 只):①常氧DMSO 组:注射等体积DMSO;②常氧Erastin组:注射15 mg/kg Erastin 溶液;③低氧DMSO 组:注射等体积DMSO;④低氧Erastin 组:注射15 mg/kg Erastin 溶液。当肿瘤体积达到约80 mm3时,治疗14 d,隔2 d 注射1 次。通过测量肿瘤重量、长度(L)和宽度(W)监测小鼠肿瘤的生长;基于卡钳测量的肿瘤体积采用修正椭球公式计算[肿瘤体积=1/2(LW2)]。
1.3 统计学方法
采用SPSS 20.0 统计软件对实验数据进行分析。计量资料以均数±标准差()表示,组间比较采用单因素方差分析,进一步两两比较采用LSD-t 检验。以P <0.05为差异有统计学意义。
2 结果
2.1 低氧抑制Erastin 诱导PANC1 细胞铁死亡的效果
常氧Erastin 组加入Ferrostatin-1 的细胞活性高于常氧Erastin 组,差异有高度统计学意义(P <0.01)。加入Z-VAD-FMK 和Necrostatin-1 的细胞活性与常氧Erastin 组比较,差异无统计学意义(P >0.05),见图1A。低氧Erastin 组的细胞活性及还原型GSH 相对含量高于常氧Erastin 组,MDA 相对含量低于常氧Erastin 组,差异有统计学意义(P <0.05),见图1B~D。
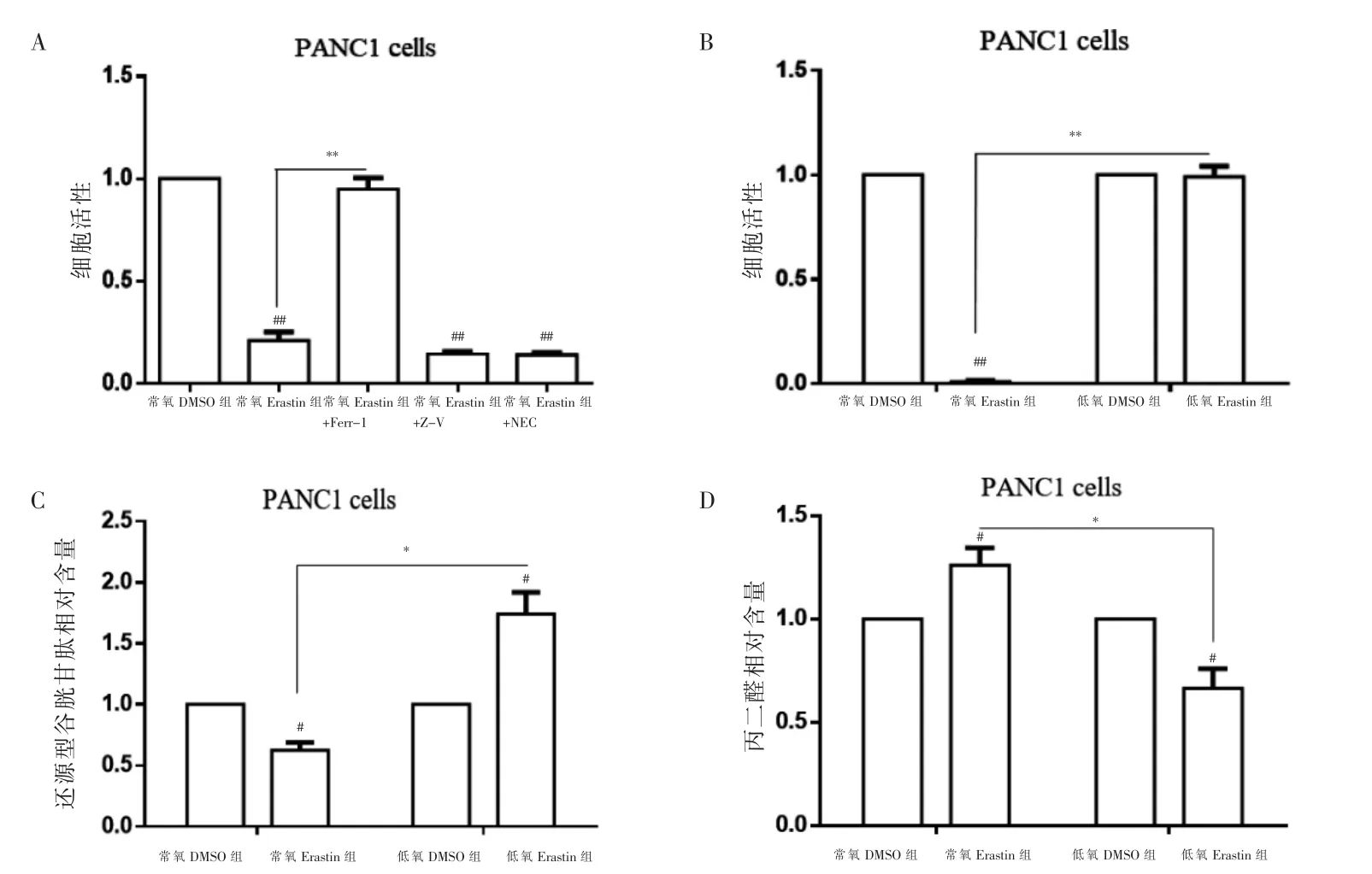
图1 低氧抑制Erastin 诱导PDAC 细胞铁死亡的效果
2.2 低氧上调SIRT3 抑制Erastin 诱导PDAC 细胞铁死亡的效果
低氧Erastin 组的SIRT3 mRNA 相对表达量高于常氧Erastin 组,差异有统计学意义(P <0.05),见图2A。低氧Erastin 组SIRT3 表达被抑制后的细胞活性低于低氧Erastin 组,差异有统计学意义(P <0.05),常氧Erastin 组加或不加3-TYP 的细胞活性未见变化,差异无统计学意义(P >0.05),见图2B。

图2 低氧上调SIRT3 抑制Erastin 诱导PDAC 细胞铁死亡的效果
2.3 低氧抑制Erastin 体内治疗效果
panc02 的低氧Erastin 组细胞活性高于常氧Erastin 组,差异有统计学意义(P <0.05),见图3A。常氧Erastin 组的肿瘤体积小于常氧DMSO 组,差异有统计学意义(P <0.05)。低氧Erastin 组的肿瘤大小与低氧DMSO 组比较,差异无统计学意义(P >0.05),见图3B。

图3 低氧抑制Erastin 体内治疗的效果
3 讨论
本研究中Erastin 引起的细胞死亡仅可被铁死亡挽救剂抑制,凋亡和坏死抑制剂不能挽救,且常氧Erastin 组的还原型GSH 相对水平减少,脂质过氧化物MDA 增高,符合Erastin 诱导铁死亡的特征[14-16]。低氧Erastin 组的细胞活性水平明显高于常氧Erastin组。并且低氧Erastin 组内抗氧化物还原型GSH 升高,MDA 水平减少,提示低氧Erastin 组的抗氧化水平升高。以上显示,低氧抑制Erastin 诱导的PDAC 细胞铁死亡。
Erastin 引起的半胱氨酸缺乏[17]促进谷氨酰胺分解引起线粒体膜电位超极化和ROS 增加[18-19]。SIRT3作为重要的线粒体蛋白脱乙酰酶,调控细胞内ROS水平和维持线粒体正常功能[20-21]。SIRT3 mRNA 相对水平在低氧Erastin 组中高于常氧Erastin 组的相对表达量,且抑制SIRT3 的表达后,低氧Erastin 组的细胞活性下降,提示SIRT3 在低氧抑制Erastin 诱导PDAC铁死亡中发挥作用。鉴于低氧诱导因子-1α 过表达细胞株和化学性低氧微环境[22]并没有真正的氧气剥夺,本研究根据文献提前72 h 低氧预培养panc02 使细胞处于慢性低氧状态[23-25]。研究结果显示,治疗第2 周,常氧Erastin 组开始有肿瘤抑制效果,低氧Erastin 组肿瘤体积与低氧DMSO 组比较,差异无统计学意义(P >0.05),证实体内低氧抑制Erastin 诱导的胰腺导管腺瘤铁死亡。
综上所述,本研究首次阐明低氧通过SIRT3 抑制Erastin 诱导的PDAC 铁死亡,为胰腺癌的临床治疗提供了新思路,但仍有不足之处,未进行SIRT3 基因质粒干扰验证以及体内低氧模型可进一步优化。
