前蛋白转化酶枯草溶菌素9对革兰阴性菌脓毒症预后的评估价值*
2021-04-28贺军宇邹国英
祝 青,郭 琪,吴 颖,贺军宇,邹国英△,吴 意
1.湖南中医药大学临床医学院检验教研室,湖南长沙 410208;2.湖南省脑科医院检验科,湖南长沙 410007;3.湖南省人民医院检验科,湖南长沙 410005
脓毒症是病原体感染机体引起免疫反应失衡而导致危及生命的器官功能障碍,是重症监护病房(ICU)患者主要的死亡原因,病死率可高达20%[1]。革兰阴性菌(G-)脓毒症病情发展迅速、危险急骤,若不及时治疗,患者则容易在短时间内发展成为脓毒症休克,甚至死亡[2]。目前临床常用降钙素原(PCT)、C反应蛋白(CRP)、白细胞介素(IL)-6、乳酸(LAC)、急性生理与慢性健康状况评分(APACHEⅡ评分)早期诊断脓毒症,但上述指标缺乏特异性、容易受药物治疗情况影响,目前有关评估G-脓毒症疾病严重程度和预后的研究较少[3-4]。有研究提示,前蛋白转化酶枯草溶菌素9(PCSK9)是治疗脓毒症的潜在靶点[5]。脂多糖(LPS)是触发G-脓毒症炎性反应的主要致病因素,通过调节低密度脂蛋白受体(LDLR)清除LPS,PCSK9可以通过下调LDLR数量而影响LPS的清除[6]。因此本文通过检测患者血清中PCSK9水平,评估其在G-脓毒症不同感染程度、病情严重程度、预后效能诊断中的价值,为指导临床治疗G-脓毒症提供依据。
1 资料与方法
1.1一般资料 选取2019年9月至2020年9月入住湖南省脑科医院(以下简称“本院”)ICU 48 h的90例G-脓毒症患者为G-脓毒症组,其中男49例、女41例,平均年龄(63.3±6.8)岁。另选择38例革兰阳性菌(G+)脓毒症患者为G+脓毒症组,其中男16例、女22例,平均年龄(60.8±8.6)岁。纳入标准:临床症状均有发热(体温≥38 ℃),有感染症状或血培养阳性,序贯器官衰竭评分(SOFA评分)≥2分的患者。选取同期临床症状表现为发热但血培养为阴性的40例患者为单纯全身炎症反应综合征组(单纯SIRS组),其中男22例、女18例,平均年龄(64.8±7.2)岁。选取同期本院体检中心的40例健康者为健康对照组,其中男20例、女20例,平均年龄(63.8±8.4)岁。排除标准:(1)入住ICU时间<24 h;(2)患有急慢性传染病、肿瘤及自身免疫性疾病者;(3)患有糖尿病、冠心病、高脂血症患者。4组研究对象的性别、年龄比较,差异无统计学意义(P>0.05),具有可比性。根据文献[7]对脓毒症患者进行诊断:感染(血液、尿、脑脊液、伤口、呼吸道分泌物、其他体液等标本培养阳性),同时SOFA评分≥2分的患者[8]。SIRS诊断标准:符合下述2项或2项以上即可诊断SIRS。(1)体温>38 ℃或<36 ℃。(2)心率>90次/分或低血压(收缩压<90 mm Hg,或较基线降低>40 mm Hg)。(3)呼吸急促(>20次/分)或通气障碍(动脉血二氧化碳分压<32 mm Hg)。(4)外周血白细胞计数>12.0×109/L或<4.0×109/L,或未成熟白细胞比例>10%,但排除可以引起上述急性异常改变的其他原因。根据APACHEⅡ评分[9]判断G-脓毒症患者的病情严重程度,分为轻度组(≤43分)、中度组(>43~53分)和重度组(>53分);根据G-脓毒症患者出院时预后情况,将病情稳定、好转、治愈的患者记为预后良好组,将患者出院时意识昏迷、昏睡、放弃治疗、死亡的患者记为预后不良组。本研究获医院伦理会审核批准。
1.2仪器与试剂 Multiskan NK3酶标仪(默飞世尔仪器有限公司);Cobas E601电化学发光分析仪(Roche公司);CL-6000i全自动发光分析仪(迈瑞有限公司);PCSK9和载脂蛋白M(apoM)酶联免疫吸附(ELISA)检测试剂盒(长沙生物科技有限公司产品);IL-6和PCT电化学发光试剂盒,Roche配套产品(Roche公司);LAC测定试剂盒(湖南永和阳光生物科技股份有限公司);CRP试剂盒(九强生物技术股份有限公司)。
1.3方法
1.3.1标本采集与处理 采集研究对象空腹静脉血,3 000 r/min离心10 min,吸取血清3 mL于EP管置-80 ℃冻存备用。
1.3.2各指标的检测 血清PCSK9和apoM水平的测定采用ELISA法,严格按试剂盒操作:设标准品孔、空白孔和样本孔,分别加入血清50 μL,再加入酶标记物100 μL,37 ℃孵育60 min,洗涤1 min,共洗涤5次,加底物A和B液各50 μL,于37 ℃温育15 min显色,终止反应后在450 nm波长处测定吸光度值(A450 nm),计算PCSK9和apoM水平。血清IL-6和PCT的检测采用电化学发光法,按仪器与试剂盒操作说明在Cobas E601电化学发光分析仪上测定。血清CRP测定采用乳胶免疫比浊法,血清LAC测定采用乳酸氧化酶法,按照各自的试剂盒说明书进行操作,在CL-6000i全自动发光分析仪上分析结果。
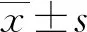
2 结 果
2.1各组研究对象血清中PCT、IL-6和CRP水平的比较 与健康对照组比较,单纯SIRS组、G+脓毒症组、G-脓毒症组血清PCT、IL-6、CRP水平明显增高(P<0.05);与单纯SIRS组比较,G-脓毒症组血清CRP水平明显升高(P<0.05);与G+脓毒症组比较,G-脓毒症组血清PCT、CRP水平明显增高(P<0.05),见表1。

表1 各组研究对象血清中PCT、IL-6和CRP水平的比较[M(P25,P75)]
2.2各组研究对象血清中LAC、PCSK9和apoM水平的比较 与健康对照组比较,单纯SIRS组、G+脓毒症组、G-脓毒症组血清LAC、PCSK9水平明显升高,但apoM水平明显降低(P<0.05);与单纯SIRS组和G+脓毒症组比较,G-脓毒症组血清PCSK9、LAC水平明显升高(P<0.05),apoM水平明显降低(P<0.05);G-脓毒症组血清apoM水平明显低于单纯SIRS组(P<0.05),见表2。

表2 各组研究对象血清中LAC、PCSK9和apoM水平比较[M(P25,P75)]
2.3G-脓毒症不同病情严重程度患者血清中PCSK9和apoM的比较 随着G-脓毒症病情的加重,PCSK9水平在轻度组、中度组、重度组中呈增高趋势,但apoM水平呈降低趋势(P<0.05),见表3。
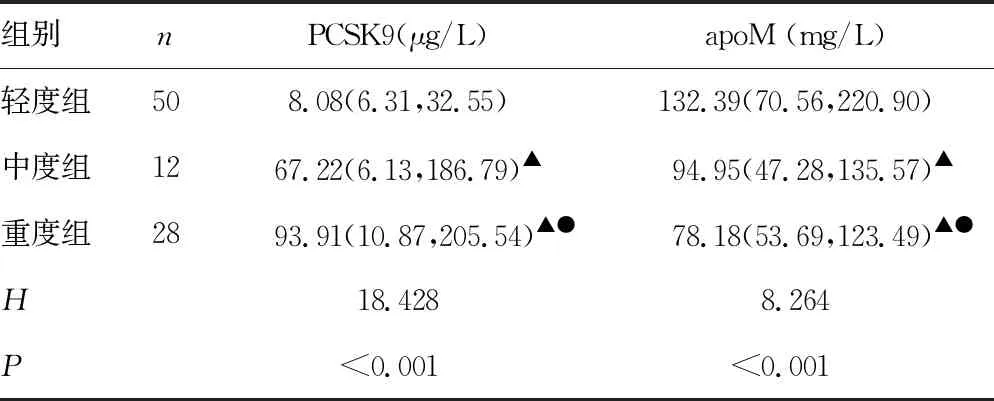
表3 G-脓毒症不同严重程度患者血清中PCSK9和apoM水平的比较[M(P25,P75)]
2.4影响G-脓毒症患者预后的单因素分析 对患者出院时预后情况进行分析,其中预后不良组26例,预后良好组64例。与预后良好组比较,预后不良组血清PSCK9、PCT、LAC、CRP及APOCHEⅡ评分明显增高,但apoM水平明显降低(P<0.05),见表4。

表4 影响G-脓毒症患者预后的单因素分析[M(P25,P75)]

组别nPCSK9(μg/L)apoM(mg/L)APACHEⅡ评分(分)SOFA评分(分)预后良好组647.78(6.31,32.55)147.04(83.39,220.90)25.00(17.00,37.00)4.00(3.00,6.00)预后不良组2696.31(25.53,207.03)64.50(40.42,120.40)37.00(25.00,43.00)5.00(3.00,6.00)Z-5.3804.617-2.753-0.055P<0.001<0.0010.0060.957
2.5影响G-脓毒症预后的多因素分析 多因素Logistic回归分析结果显示,PSCK9、apoM、APACHEⅡ评分是G-脓毒症预后的独立影响因素(P<0.05),见表5。
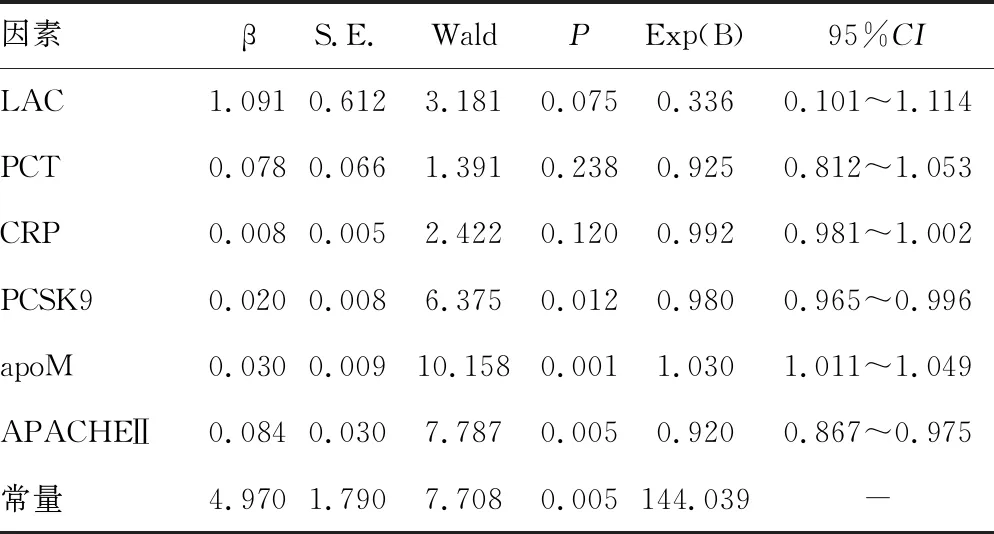
表5 影响G-脓毒症预后的多因素Logistic回归分析
2.6apoM及PCSK9预测G-脓毒症的预后效能 apoM和PCSK9预测G-脓毒症预后不良的曲线下面积(AUC)分别为0.817 8和0.794 0,低于APACHEⅡ评分的0.877 1。但PCSK9的特异度(94.44%)高于APACHEⅡ评分(90.74%),apoM的灵敏度(86.49%)高于APACHEⅡ评分(78.38%)。
3 讨 论
脓毒症是感染、休克、外伤等的常见并发症,发病率及病死率仍居高不下,成为ICU患者主要的死因之一。诊断脓毒症的金标准是血培养,但耗时过长。目前已有170余种不同的生物标志物可对脓毒症进行诊断和评价,但是尚缺乏特异度和灵敏度均较高的生物标志物[10]。PCT、IL-6和CRP是目前临床常用且参考意义较大的细菌感染标志物,但缺乏特异性,非感染性疾病患者PCT水平也会升高[11]。研究表明,ICU患者血清三酰甘油水平与脓毒症病死率相关[12]。脓毒症的致病因素多,涉及炎症、免疫、凝血等多系统、多器官的病理生理过程,因此寻找能用于早诊断、病情判断、评估预后的生物学标志物尤为重要。
G-脓毒症是由G-感染所致的脓毒症,其主要致病因素为G-的LPS。LPS通过Toll样受体4(TLR4)信号通路触发炎性反应,刺激炎症细胞释放相关炎症因子,导致弥散性血管内凝血(DIC)、多器官功能障碍综合征(MODS),若不及时治疗,可出现脓毒症休克,甚至死亡[13]。机体中的LPS通过LDLR途径在肝脏发生反应,经胆管、肠道排出体外[14]。PCSK9由肝脏合成、分泌入血,通过调控胆固醇代谢途径影响脓毒症脂代谢紊乱特异性分子的代谢[15]。生理情况下,肝细胞膜表面上的受体LDLR与血液低密度脂蛋白胆固醇(LDL-C)结合形成复合物,通过胞吞进入细胞内,在低pH值时LDLR在内体小泡中与LDL-C分离,LDL-C被溶酶体降解,LDLR重新回到肝细胞表面被重复利用。研究表明,PCSK9是LDLR的关键性负调节因子,脓毒症患者中PCSK9水平增加,PCSK9入血与LDLR结合形成复合物,复合物迁移至溶酶体中被降解,LDLR无法回到肝细胞表面被重复利用,从而影响脂蛋白对LPS的吸收,降低LPS的清除率[16]。PCSK9通过TLR4受体激活NF-KB信号通路激活炎症,加重脓毒症的病情。本研究结果显示,G-脓毒症组患者血清PCKS9、IL-6、CRP、PCT、LAC水平均明显高于健康对照组,且G-脓毒症患者血清PCSK9水平明显高于单纯SIRS组和G+脓毒症组(P<0.05),进一步研究发现,PCSK9水平随着病情进展呈明显增高趋势。因此,监测脓毒症患者血清PCSK9水平对早期诊断G-脓毒症、评估G-脓毒症的病情有一定积极意义。apoM是LDL和高密度脂蛋白(HDL)的主要成分,与多功能生物活性脂质介质S1P结合,保护血管内皮屏障功能[17]。脓毒症患者血浆S1P水平于发病后6~8 h下降,apoM 于发病后12~24 h降低,内皮屏障功能被破坏,血管渗漏增加,脓毒症病情越严重,apoM水平越低,越易引发休克[18]。本研究发现,G-脓毒症组血清apoM水平明显低于健康对照组和单纯SIRS组,G-脓毒症患者血清apoM水平随着病情进展呈明显降低趋势,且预后不良组血清apoM水平明显低于预后良好组,表明血清apoM水平降低对G-脓毒症的诊断、病情判断有一定意义。
通过单因素及多因素Logistic回归分析发现,APACHEⅡ评分、PCSK9、apoM是评估G-脓毒症预后的独立影响因素。ROC曲线分析提示,PCSK9、apoM和APACHEⅡ评分均能较好地预测G-脓毒症的预后。
综上所述,G-脓毒症患者的血清PCSK9、apoM水平与健康对照者差异明显,两者水平与G-脓毒症的病情相关,是G-脓毒症预后的独立影响因素。血清PCSK9、apoM水平与APACHEⅡ评分可用于评估G-脓毒症的预后。在实际工作,可与APACHEⅡ评分联合使用,判断G-脓毒症的病情与预后。但本研究病例数较少,研究结果可能存在偏倚,还需要大样本研究进行验证。
