初级纤毛在肿瘤发生发展中的研究进展
2021-04-25杨明清肖胜军
杨明清,肖胜军
纤毛是一种来源于细胞基体并突出于细胞表面的特殊细胞器,有3种类型:运动纤毛(motile cilia)、初级纤毛(primary cilia)和节点纤毛(nodal cilia)[1]。其中初级纤毛分布于哺乳动物中几乎所有类型的细胞表面,其异常会导致多种人类疾病(如肾囊肿[2]、视网膜变性[2])和肿瘤(如黑色素瘤[3])的发生,所以初级纤毛的异常影响着肿瘤的发生、发展。该文就初级纤毛的基本结构、组装与解体的动态过程、纤毛相关信号通路及纤毛异常与肿瘤发生、发展关系进行一系统综述。
1 初级纤毛的结构
初级纤毛是一种以微管为结构基础的不具有运动功能的细胞器,其含有一个“9+0”的轴丝,无中央微管和动力蛋白臂。其结构一般分为3个区域:基体(basal body, BB)、过渡区(transition zone, TZ)和轴丝(axoneme)。其中基体是一个重塑的母中心粒(mother centriole, MC),初级纤毛从此结构伸出;而过渡区是基体与轴丝之间长约0.5 μm的区域;另外轴丝是由环状排列的9个经过翻译后修饰的双微管结构组成,这三个区域相互连接,构成初级纤毛的基本结构(图1)。初级纤毛的纤毛膜包裹着微管且与细胞质膜相接[4],但二者的脂质和蛋白质含量不同[4-6],这是它具有不同于细胞膜特化功能的分子结构基础。总之,初级纤毛的基本结构是纤毛发挥特定功能的物质基础。
2 初级纤毛的组装与解体
初级纤毛的组装与解体经常与有丝分裂偶联在一起,它只能在细胞周期的G0期或G1期形成,在G1/S期或G2/M期被解体吸收[7-8]。当中心体结构演变出MC进而转化为BB时,初级纤毛开始形成;而当细胞准备进入分裂期之前,初级纤毛开始解体。
2.1 初级纤毛的组装初级纤毛的组装通常开始于细胞周期G0/G1期,当有丝分裂原缺乏或细胞进行分化需要退出细胞周期的分裂期时,初级纤毛开始组装。
初级纤毛的组装是从一个子中心粒逐渐成熟为MC开始的。血清饥饿之后,高尔基体的小细胞质囊泡(pre-ciliary vesicles, PCVs)依赖特定的激肽和动力蛋白(kinesin family member C1, KIFC1)沿微管转运至成熟的MC远端[9-11]。PCVs在MC远端附属物附近停靠,随后依赖中心体肌动蛋白网络与多巴胺(dopamine, DA)对接。当PCVs与DA完成对接后,膜形成蛋白(EPS15-homology domain-containing 1, EHD1)被募集到PCVs上,促进大量的PCVs在MC远端融合成一个大纤毛囊泡进而覆盖了MC的整个远端。随着PCVs的不断运输,纤毛帽不断扩大、微管不断生长,进而将轴丝不断的包裹在双层质膜中。其中纤毛膜的组装伴随着中心体从细胞中心向细胞表面迁移,基体通过DA锚定在细胞质膜且与其融合之后,轴丝内的微管及其包囊的纤毛膜进一步生长[12]。新生的纤毛通过其纤毛膜与质膜的对接,建立这些结构区域的连续性。
纤毛完成组装之后,通过储存在纤毛基部的可溶性蛋白屏障和过渡区的功能来维持其生长所需的蛋白质,通过门控机制来保持其独特的基本结构。
2.2 初级纤毛的解体相比于纤毛的组装来说,我们对该细胞器的解体机制知之甚少。在培养哺乳动物细胞实验中表明,纤毛要经过双相方式分解[13],初级纤毛进行第一次解体发生在有丝分裂原刺激静止期细胞之后(G1期),第二次解体发生在有丝分裂前。
有丝分裂激酶——极光激酶(Aurora A)在促进初级纤毛的解体中发挥着重要作用[14]。当初级纤毛准备解体时,Aurora A被激活使组蛋白去乙酰化酶(histone deacetylase 6, HDAC6)发生磷酸化,这就导致了轴丝内的微管蛋白不稳定和去乙酰化,最终促进初级纤毛的解体。另外去聚合激肽Kinesin-13家族成员Kif2a和Kif24也与初级纤毛的解体相关。其中Kif2a是定位于两个中心粒近端以及MC亚远端的附属物,其被G2/M期的激酶Plk163磷酸化并激活。活化的Kif2a促进纤毛微管的解聚,在增殖信号发出之后不久激发纤毛的解体;而Kif24主要通过与中心粒卷曲螺旋蛋白110(centriolar coiled coil protein 110, CP110)的结合来发挥作用[15]。Kif24的敲除和CP110缺失影响着增殖细胞中初级纤毛的组装,同时Kif24通过丝/苏氨酸激酶NeK2[16]介导的磷酸化增强微管的解聚活性[16]。Nek2在S期和G2期表达,确保Kif24在缺乏纤毛的细胞中具有活性。研究表明,Kif24的作用是抑制解聚微管的延伸,防止在有丝分裂前纤毛进行异常组装[17]。总之,Kif2a和Kif24被S/G2期(Nek2)或G2/M期(Plk163)表达的激酶激活,进一步将细胞周期与维持有丝分裂所必需的纤毛解体过程联系起来。
纤毛解体之后会进行纤毛膜的重塑。在纤毛吸收时,纤毛口袋(ciliary pocket, cipo)发生主动重塑,它是一个富含肌动蛋白的、围绕纤毛轴丝近端区域的纤毛周围亚结构。由于纤毛是一个动态的细胞器,其维持需要囊泡源源不断的运输到cipo膜进行停靠然后等待着释放。总之,cipo的重塑进一步加速了纤毛的解体。
3 初级纤毛相关的信号通路
初级纤毛是Hedgehog(Hh)、Wnt、Notch、PDGFRα和TGFβ等多条信号通路的关键调节因素。本文主要阐述Hh、Notch和Wnt这三条信号通路。
3.1 Hh信号通路Hh信号通路主要包括Hh配体[Sonic(SHH)、Indian(IHH)和Desert(DHH)]、肿瘤抑制膜蛋白1(Patched1, PTCH1)和7次跨膜结构域G蛋白偶联受体样蛋白(Smoothened, SMO),糖原合成酶激酶(Glycogen synthase kinase, GSK)、蛋白激酶A(protein kinase A, PKA)和酪蛋白激酶1(casein kinase 1, CK1),G蛋白偶联受体(G protein-coupled receptors, GPR)、融合同源物抑制因子(suppressor of fused, SUFU)、神经胶质瘤相关癌基因同源蛋白1(Glioma-associated oncogene homolog1, GLI1)、GLI2、GLI3。
当Hh配体出现且与PTCH1结合之后,Hh信号通路被激活。PTCH1被排除到纤毛之外,进而解除了其对SMO的抑制作用,此时SMO通过其羧基端第7个跨膜结构域后的一个共同的疏水性和碱基残基序列定位于初级纤毛。SMO在纤毛上的积累激活了SUFU以及阻断GLI转录因子的水解,进而促进GLI与SUFU的解离。之后全长的GLI转录因子经过一系列的翻译后修饰转化为GLI的激活形式并转运到细胞核,在细胞核中结合转录共激活因子促进靶基因的表达。
当Hh配体不存在时,初级纤毛膜上的PTCH1抑制SMO进入初级纤毛。在这情况下,GLI2和GLI3的C端部分被水解掉,这就去除了它们的转录激活结构域,使它们发挥其N端的转录抑制功能从而抑制Hh靶基因表达。由于只有全长的GLI蛋白定位于初级纤毛[18-19],而GLI蛋白水解形式从纤毛脱落开始,所以定位在纤毛的全长GLI蛋白与聚集在纤毛顶端的SUFU相互作用进而阻止GLI转录因子的核转位。
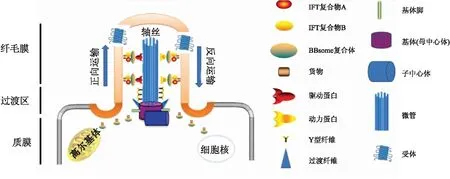
图1 初级纤毛骨架由9个双联微管组成(即轴丝),其轴丝起源于母中心粒,而初级纤毛的货物运输依靠IFT-B和IFT-A以及驱动蛋白和动力蛋白来向纤毛顶端(顺向)和纤毛基部(逆向)进行转运
3.2 Wnt信号通路Wnt信号通路可以分为经典型(β-catenin依赖性)和非经典型(β-catenin非依赖性)两种类型。由于非经典型Wnt信号通路的具体机制尚不清楚,所以本文主要描述经典型Wnt信号通路。
Wnt信号通路的糖原合成酶(glycogen synthase kinase, GSK)和结肠腺瘤样息肉病蛋白(adenomatous polyposis coli, APC)均定位于初级纤毛上[20]。研究表明,纤毛蛋白中的反转蛋白(inversin, INVS)调节Wnt通路中关键效应因子DSH片段极性蛋白1(dishevelled segment polarity protein 1, DVL1)的表达和定位且使其降解,进而调控Wnt信号通路[21]。
经典型Wnt信号通路在失活状态下,APC和AXIN(是负责β-catenin复合物形成的一种浓度限制因子)组成的复合物触发GSK3和CK1对β-catenin的磷酸化、泛素化和最终的降解[22]。而在激活状态下,Wnt配体与卷曲蛋白受体(frizzled, FZ)和低密度脂蛋白相关蛋白(low density lipoprotein-related proteins, LRP)受体结合激活蓬乱蛋白(dishevelled, DSH)。DSH将APC和AXIN组成的复合物聚集到质膜上来抑制β-catenin磷酸化,导致β-catenin不被降解而聚集于细胞质中,之后β-catenin转位到细胞核中激活相应的靶基因进行相应的表达。
3.3 Notch信号通路初级纤毛对Notch通路的影响似乎具有组织特异性。目前对于Notch信号通路的了解较少,所以本文仅进行简要的概括。
当Notch配体的细胞外结构域与Notch受体(Notch1~4)结合时启动Notch信号通路,随后位于初级纤毛基体近端的γ-分泌酶复合体裂解已与配体结合的Notch蛋白,进而释放Notch胞内结构域(Notch1 intracellular domain, NICD),最终NICD进入细胞核作为转录因子激活相应的靶基因表达。
4 初级纤毛与肿瘤
初级纤毛异常会导致多囊肾[23]、视网膜变性[23]和恶性肿瘤[3]等多种疾病。然而初级纤毛与癌症之间的联系取决于肿瘤的类型,在同一肿瘤内以及不同肿瘤亚型之间均存在差异。肿瘤的特征包括细胞无止境的分裂和凋亡能力受损,而正常细胞内或细胞间的信号通路发生改变也会使初级纤毛介导的信号通路紊乱,进而导致肿瘤的发生、发展。初级纤毛的解体必须发生在有丝分裂之前,其解体在人类疾病(特别是肿瘤)中具有重大意义。在肿瘤治疗中,初级纤毛也是一个不可忽略的新型靶标。下面我们将通过纤毛及其相关信号通路的异常导致肿瘤的发生和发展进行探讨。
4.1 与Hh信号通路相关的肿瘤Hh作为初级纤毛主要的信号通路与许多肿瘤相关,其中皮肤癌中的基底细胞癌比较常见。其发生与Hh信号通路中一些因子的改变(如PTCH1、SUFU、SMO、GLI转录因子)有着密切的联系。大多数散发性基底细胞癌中PTCH1至少有1个等位基因发生功能缺失性突变,阻止Hh信号通路级联的抑制性;其他少数散发性基底细胞癌中膜蛋白SMO存在功能获得性突变,导致Hh通路的过渡激活[24]。当缺乏Hh配体时,转录因子GLI被磷酸化、泛素化并部分裂解为抑制物形式,阻止其核转位进而激活靶基因。当存在Hh配体时,SMO易位入初级纤毛,使聚集在初级纤毛顶端的GLI与SUFU复合物解离并释放出GLI活性物质进行核转位激活相应的靶基因。有研究表明,在散发性基底细胞癌中发现SUFU功能缺失性突变使纤毛顶端复合物解离释放出GLI转录因子,进而导致GLI的转录增加[24-25]。
总之,探索Hh信号通路调控因子的变化可能为阻止某些肿瘤的进一步发展提供了新的选择。
4.2 与Wnt信号通路相关的肿瘤在APC基因突变导致的结直肠癌中,Wnt信号通路被过度激活。APC基因突变会引起β-catenin复合物功能丧失或增加,导致β-catenin核转位反式激活Wnt的靶基因,进而促进肿瘤的发生、发展[26]。
在黑色素瘤的研究中表明,甲基转移酶(enhancer of zeste homolog 2, EZH2)是纤毛基因的沉默子,它能够通过组蛋白甲基化抑制基因的表达,所以恶性黑色素瘤中EZH2表达与初级纤毛的表达水平呈负相关。因此EZH2对黑色素瘤细胞纤毛基因的抑制促进了初级纤毛的解体,进而促进Wnt信号通路。
在前列腺癌中[27],正常前列腺组织中的纤毛细胞比例比前列腺上皮内瘤和浸润性前列腺癌中的纤毛比例高,而前列腺癌细胞纤毛较少且拥有高水平的核β-catenin从而激活经典型Wnt信号通路。
4.3 与Notch信号通路相关的肿瘤Notch信号通路中Notch1受体是致癌基因Ras的媒介[28],而Ras基因在早期乳腺癌的发生、发展中起着核心作用。其它Notch成员在乳腺癌中也发挥着各自不同的作用,Notch2高表达与高分化乳腺癌患者的生存率相关[29];Notch3在体内具有转化的潜力,其上调会导致乳腺癌的发生[30]。总之,Notch信号通路在乳腺癌的发生、发展中扮演着重要角色。
5 总结与展望
初级纤毛是一种来源于微管的特殊细胞器,在调节细胞生长、分化以及相关信号通路中发挥着重要作用,初级纤毛的异常在肿瘤的发生、发展中起重要作用。初级纤毛异常可以启动肿瘤的发生,并激活多条肿瘤相关的信号通路;因此阐明肿瘤中初级纤毛异常的相关机制,对于靶向干预异常纤毛治疗肿瘤具有重要价值。
